Презентація на тему:
Якість медичної допомоги
Завантажити презентацію
Якість медичної допомоги
Завантажити презентаціюПрезентація по слайдам:
Директор Фармакологічного Центру МОЗ Украіни Чумак Віктор Тимофійович Chumak@pharma-center.kiev.ua, http://www.pharma-center.kiev.ua/ ОСНОВНІ ПИТАННЯ і ЗАСАДИ РОЗВИТКУ РЕЄСТРАЦІЇ ТА ОБІГУ ЛІКАРСЬКИХ ЗАСОБІВ В УКРАЇНІ ВТО
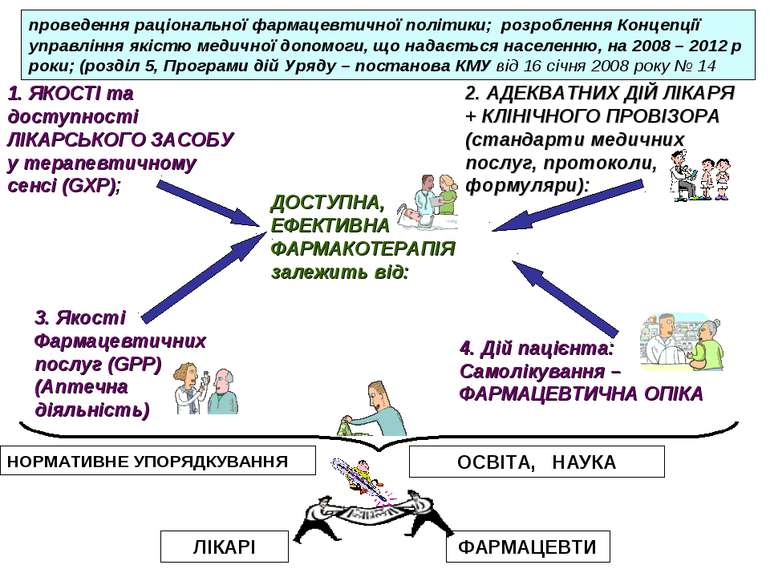
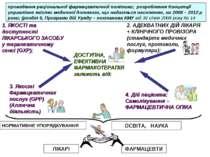
ДОСТУПНА, ЕФЕКТИВНА ФАРМАКОТЕРАПІЯ залежить від: 1. ЯКОСТІ та доступності ЛІКАРСЬКОГО ЗАСОБУ у терапевтичному сенсі (GXP); 2. АДЕКВАТНИХ ДІЙ ЛІКАРЯ + КЛІНІЧНОГО ПРОВІЗОРА (стандарти медичних послуг, протоколи, формуляри): 3. Якості Фармацевтичних послуг (GPP) (Аптечна діяльність) 4. Дій пацієнта: Самолікування – ФАРМАЦЕВТИЧНА ОПІКА ОСВІТА, НАУКА НОРМАТИВНЕ УПОРЯДКУВАННЯ ЛІКАРІ ФАРМАЦЕВТИ проведення раціональної фармацевтичної політики; розроблення Концепції управління якістю медичної допомоги, що надається населенню, на 2008 – 2012 р роки; (розділ 5, Програми дій Уряду – постанова КМУ від 16 січня 2008 року № 14
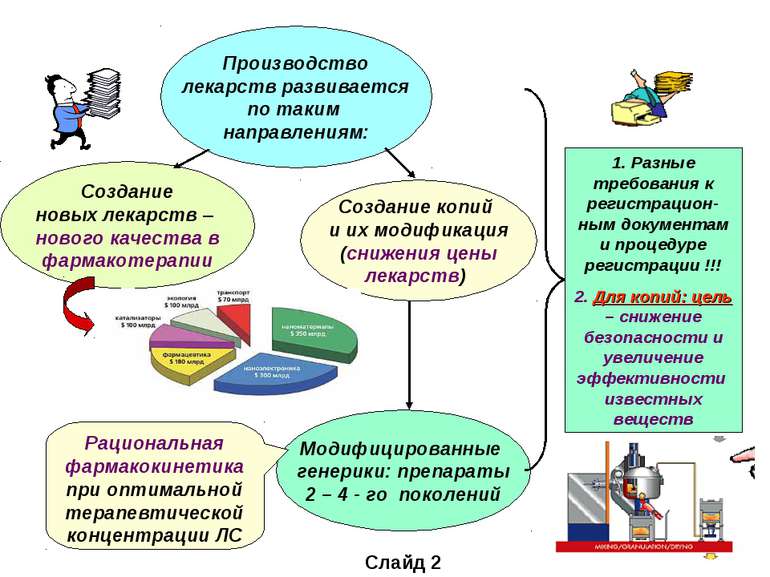
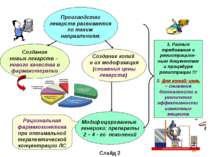
Производство лекарств развивается по таким направлениям: Создание новых лекарств – нового качества в фармакотерапии Модифицированные генерики: препараты 2 – 4 - го поколений Создание копий и их модификация (снижения цены лекарств) 1. Разные требования к регистрацион-ным документам и процедуре регистрации !!! 2. Для копий: цель – снижение безопасности и увеличение эффективности известных веществ Рациональная фармакокинетика при оптимальной терапевтической концентрации ЛС Слайд 2
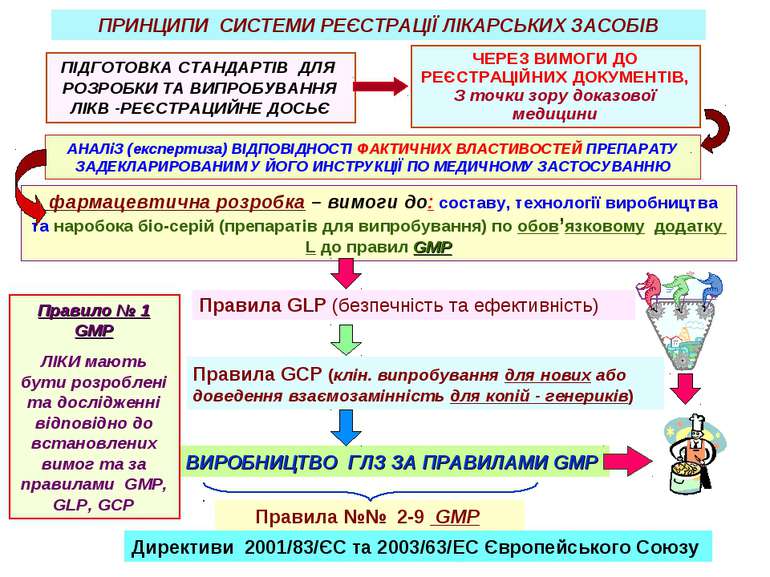
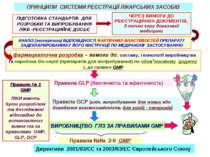
ПРИНЦИПИ СИСТЕМИ РЕЄСТРАЦІЇ ЛІКАРСЬКИХ ЗАСОБІВ ПІДГОТОВКА СТАНДАРТІВ ДЛЯ РОЗРОБКИ ТА ВИПРОБУВАННЯ ЛІКВ -РЕЄСТРАЦИЙНЕ ДОСЬЄ Правила GLP (безпечність та ефективність) Правила GCP (клін. випробування для нових або доведення взаємозамінність для копій - генериків) ЧЕРЕЗ ВИМОГИ ДО РЕЄСТРАЦІЙНИХ ДОКУМЕНТІВ, З точки зору доказової медицини фармацевтична розробка – вимоги до: составу, технології виробництва та наробока біо-серій (препаратів для випробування) по обов’язковому додатку L до правил GMP ВИРОБНИЦТВО ГЛЗ ЗА ПРАВИЛАМИ GMP Правила №№ 2-9 GMP АНАЛіЗ (експертиза) ВІДПОВІДНОСТІ ФАКТИЧНИХ ВЛАСТИВОСТЕЙ ПРЕПАРАТУ ЗАДЕКЛАРИРОВАНИМ У ЙОГО ИНСТРУКЦІЇ ПО МЕДИЧНОМУ ЗАСТОСУВАННЮ Правило № 1 GMP ЛІКИ мають бути розроблені та дослідженні відповідно до встановлених вимог та за правилами GMP, GLP, GCP Директиви 2001/83/ЄС та 2003/63/EC Європейського Союзу
СОВЕТСКИЕ ПРЕДСТАВЛЕНИЯ О ЛЕКАРСТВЕ – В ОТЛИЧИЕ ОТ ДИРЕКТИВЫ ЕС № 65/65 , 1965 г. Порядок организации работ по созданию и промышленному освоению новых лекарственных средств на предприятиях и в организациях министерства медицинской промышленности. Основные положения. – ОМУ 64-33-81, М. Минмедпром СССР, 1981 г. 3.1. Поисковые исследования, включая доклиническое и клиническое изучение нового препарата (полученного в лаборатории); Положительные результаты клинических испытаний служили основанием для научно-технической разработки нового лекарственного средства для производства (доработки или переработки состава лекарственной формы). 3.2 Научно-техническая разработка (лекарственного средства) проводится на основании утвержденного протокола Фармакологического комитета, рекомендующего новое лекарственное средство к применению в медицинской практике и планового задания на проведение данной работы. (Испытывался и утверждена инструкция по медицинскому применению для исследуемого препарата — лабораторного и его качество не было еще спроецировано в масштабах промышленного производства)
Система забезпечення якості лікарських засобів передбачає чіткі правила та процедури щодо питань (Наказ МОЗ № 838/17.12.2007): GMP, GLP, GCP, GMP GPP GDP 1. Розробки лікарського засобу (фармацевтична розробка та виготовлення серій лікарського засобу для випробування по технології, яка має бути відтворена для серійного виробництва цього лікарського засобу) – наказ МОЗ № 637/2003; № 426/2005; №190/2007; 2. Випробування, обсяг та вимоги до яких визначає МОЗ (накази МОЗ № 441 /2001; № 426/2005; № 66/2006; №190/2007; №245/2007); 3. Підготовка реєстраційного досьє (наказ МОЗ 426/2005; №500/2006; №185/2003) 4. Експертиза реєстраційного досьє та державна реєстрація лікарського засобу (постанова КМУ № 376 від 20.05.05; наказ МОЗ № 426/2005; № 95/2006; № 536/2007) 5. Вимоги до виробництва лікарських засобів та постановки на виробництво ЛЗ, які визначаються з врахуванням наведених принципів; 6. Інспектування та ліцензування виробництва ЛЗ; 7. Дотримання під час серійного виробництва вимог до лікарського засобу, задекларованих у реєстраційних матеріалах; 8. Після реєстраційні зміни та нагляд (наказ МОЗ № 497/2001; №426/2005; № 898/2006; постанова КМУ № 376 від 20.05.05) 9. Дотримання правил та умов зберігання лікарського засобу під час реалізації та застосування, визначених при його державні реєстрації. ???
КЕРІВНИЦТВО ПО ПРОВЕДЕННЮ ОЦІНКИ ЕКВІВАЛЕНТНОСТІ FDA – Guidance for Industry. Waiver of In Vivo Bioavailability and Bioequivalence Studies for Immediate-Release Solid Oral Dosage Forms Based an a Biopharmaceutics Classification System, 2000 Guideline for Bioequivalence Studies for Different Strengths of Oral Solid Dosage Forms, Japan, 14.02.2000 CPMP/EWP/QWP/1401/98 Note for Guidance on the Investigation of Bioavailability and Bioequivalence, 2001 WHO Technical Report Series 937. WHO Expert Committee on Specifications for Pharmaceutical Preparations, 2006 Наказ МЗ України від 17.04.2007 р. № 190 Еквівалентність
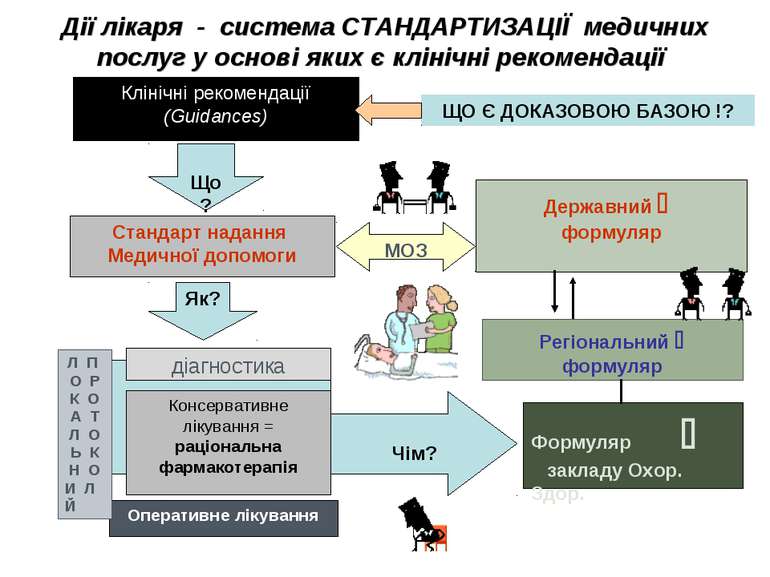
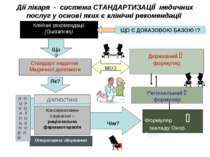
Дії лікаря - система СТАНДАРТИЗАЦІЇ медичних послуг у основі яких є клінічні рекомендації Клінічні рекомендації (Guidances) Що? Стандарт надання Медичної допомоги Як? діагностика Оперативне лікування Чім? Формуляр закладу Охор. Здор. Консервативне лікування = раціональна фармакотерапія Л П О Р К О А Т Л О Ь К Н О И Л Й Регіональний формуляр Державний формуляр МОЗ ЩО Є ДОКАЗОВОЮ БАЗОЮ !?
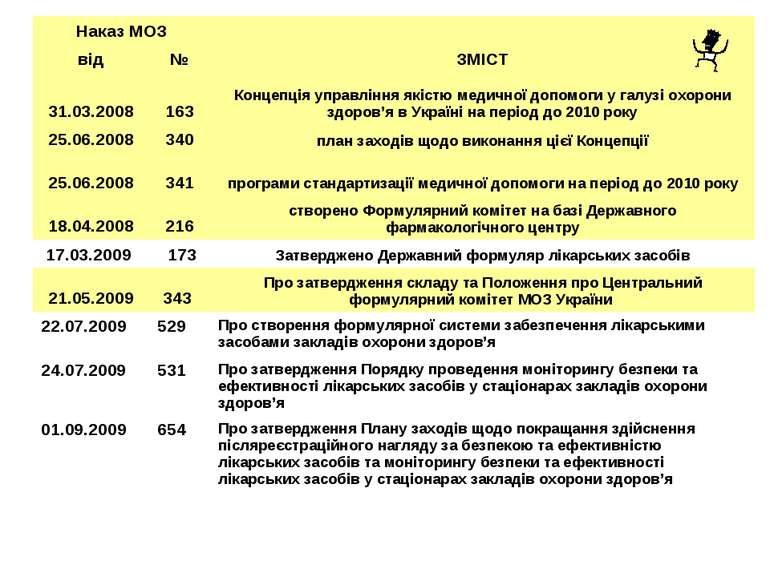
Наказ МОЗ ЗМІСТ від № 31.03.2008 163 Концепція управління якістю медичної допомоги у галузі охорони здоров’я в Україні на період до 2010 року 25.06.2008 340 план заходів щодо виконання цієї Концепції 25.06.2008 341 програми стандартизації медичної допомоги на період до 2010 року 18.04.2008 216 створено Формулярний комітет на базі Державного фармакологічного центру 17.03.2009 173 Затверджено Державний формуляр лікарських засобів 21.05.2009 343 Про затвердження складу та Положення про Центральний формулярний комітет МОЗ України 22.07.2009 529 Про створення формулярної системи забезпечення лікарськими засобами закладів охорони здоров’я 24.07.2009 531 Про затвердження Порядку проведення моніторингу безпеки та ефективності лікарських засобів у стаціонарах закладів охорони здоров’я 01.09.2009 654 Про затвердження Плану заходів щодо покращання здійснення післяреєстраційного нагляду за безпекою та ефективністю лікарських засобів та моніторингу безпеки та ефективності лікарських засобів у стаціонарах закладів охорони здоров’я
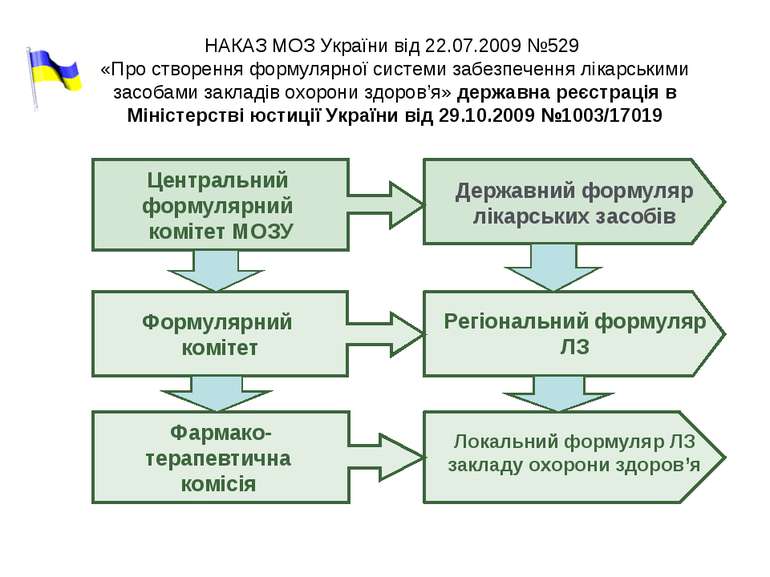
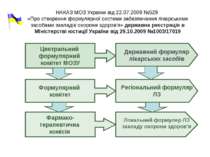
НАКАЗ МОЗ України від 22.07.2009 №529 «Про створення формулярної системи забезпечення лікарськими засобами закладів охорони здоров’я» державна реєстрація в Міністерстві юстиції України від 29.10.2009 №1003/17019 Державний формуляр лікарських засобів Регіональний формуляр ЛЗ Локальний формуляр ЛЗ закладу охорони здоров’я Центральний формулярний комітет МОЗУ Формулярний комітет Фармако- терапевтична комісія
Інструменти управління якістю медичної допомоги (міжнародний досвід) Клінічні настанови, засновані на доказової медицині Медичні стандарти Національний формуляр Клінічні індикатори Організаційний аудит Клінічний аудит Забезпечення якості (механізми)
Інструменти впливу на якість медичної допомоги Загальні інструменти: ліцензування, акредитація, сертифікація, стандартизація, зовнішній контроль/аудит, внутрішній контроль/аудит, моніторинг безпеки та ефективності лікування Україна Євросоюз Ретроспективна оцінка якості медичної допомоги та «каральні» заходи Особливості Проспективна діяльність з управління якістю медичної допомоги 1.Медико-технологічні документи під назвою «Стандарти», «Протоколи», «Алгоритми», «Нормативи» тощо 2.Контроль результатів лікування окремими експертами 3.Рекомендований характер Державного Формуляра 4.Нормування діяльності фармацевтичних закладів Центральний рівень управління галуззю 1.Клінічні настанови 2.Стандарти з критеріями якості 3.Системи індикаторів для клінічного аудиту 4.Формулярна система 5.Належна аптечна практика 1.Відпуск лікарських засобів за рецептами 2.Самолікування та поліпрагмазія 3.Експертні оцінки результатів медичної допомоги відносно середньостатистичного рівня Локальний рівень – надання медичної допомоги 1.Фармацевтичне обслуговування 2.Локальний протокол (клінічний маршрут), інтегрований в медичну картку пацієнта 3.Клінічний аудит
Відмінності механізму забезпечення якості медичної допомоги В Україні Експертиза якості надання медичної допомоги (на трьох рівнях) 1-й рівень: лікар-пацієнт (індивідуальний); 2-й рівень: рівень ЛПЗ (рівень закладів) 3-й рівень: оцінюється мережа закладів охорони здоров,я (територіальній). В країнах ЄС Професійний аудит Клінічний аудит Організаційний аудит Фінансовий аудит
Забезпечення якості фармакотерапії у частині застосування ліків Загальні інструменти: ліцензування, акредитація, сертифікація, стандартизація, зовнішній контроль/аудит, внутрішній контроль/аудит, моніторинг безпеки та ефективності лікування Україна Сфера діяльності Євросоюз 1.Фрагментарна діяльність у сфері фінансових механізмів фармацевтичної практики; 2.Регулювання та контроль рецептурного сектора лікарських засобів та обслуговування пільгових категорій населення Фармація 1.Систематична діяльність з регулювання якості фармацевтичної практики: 1.1. сприяння поліпшенню стану здоров’я, з попередження захворювань та досягнення цілей охорони здоров’я. 1.2. постачання та застосування лікарських засобів та пристроїв для їх використання або з іншими аспектами лікування. 1.3. відповідальне самолікування, у тому числі консультування щодо ліків та, за необхідності, надання ліків та/або інших видів лікування пацієнтів з симптомами та розладами, які припустимо лікувати амбулаторно.1.4. вплив на призначення та застосування лікарських засобів. 1.Моніторинг ефективності та безпеки лікарських засобів 2. Рекомендований характер Державного Формуляра 3. Медико-технологічні документи містять лікарські засоби, заборонені до застосування Медичне застосування лікарських засобів 1.Моніторинг ефективності та безпеки лікарських засобів 2. Обов’язковість до виконання формулярних списків (або їх аналогів)
Просвіта та запобігання погіршення здоров’я населення – 4 стандарти Забезпечення правильного застосування рецептурних препаратів і виробів медичного призначення – 6 стандартів; Самолікування – ФАРМАЦЕВТИЧНА ОПІКА - 4 стандарти; Вплив на виписку та використання лікарських засобів та виробів медичного призначення – 9 стандартів РАЗОМ ТРЕБА РОЗРОБИТИ ТА ВТІЛИТИ 23 СТАНДАРТИ, щоб 24 тис. аптечних закладів перетворилися у заклади охорони здоров‘я “КЕРІВНИЦТВО ПО РОЗРОБЦІ ТА ВТІЛЕННЮ СТАНДАРТІВ ЩОДО НАЛЕЖНОЇ АПТЕЧНОЇ ПРАКТИКИ (ФАРМАЦЕВТИЧНИХ ПОСЛУГ) – GPP” ВООЗ, Копенгаген, Данія, травень 2001 р. Стаття 16. Заклади охорони здоров'я Закону “Основи законодавства України про охорону здоров'я” Безпосередню охорону здоров'я населення забезпечують санітарно-профілактичні, лікувально-профілактичні, фізкультурно-оздоровчі, санаторно-курортні, аптечні, науково-медичні та інші заклади охорони здоров'я.
1. Попередження захворювання та сприяння прихильності лікуванню при ВІЛ/СНІД 2. Симптоматичне лікування алергії; 3. Формування аптечки першої допомоги для службових приміщень; 4. Формування домашньої аптечки першої допомоги; 5. Формування аптечки першої допомоги для немовлят; 6. Формування аптечки першої допомоги для подорожей; 7. Симптоматичне лікування болю в горлі; 8. Симптоматичне лікування дисбактеріозу; 9. Симптоматичне лікування діареї; 10. Сприяння відмові від тютюнопаління; 11. Симптоматичне лікування забиття і синців; 12. Симптоматичне лікування кашлю; 13. Симптоматичне лікування опіків; 14. Симптоматичне лікування подряпин; 15. Симптоматичне лікування стресу; 16. Попередження захворювання та сприяння прихильності лікуванню при туберкульозі Проект наказу МОЗ: “Про затвердження протоколів фармацевтичного обслуговування” на погодженні у МОЗ
Жизнь подобна собачьей упряжке. Если не идешь впереди, то всегда видить одно и тоже – Льюис Гриззард. СПАСИБО ЗА ВНИМАНИЕ ЕСЛИ ВАС ЗАИНТЕРЕСОВАЛ МАТЕРИАЛ, посещайте наш сайт: http://www.pharma-center.kiev.ua/
Схожі презентації
Категорії