Презентація на тему:
Наука Біохімія
Завантажити презентацію
Наука Біохімія
Завантажити презентаціюПрезентація по слайдам:
Біохімія як наука. Молекулярний склад живих організмів. Будова, структура, властивості та біологічні функції білків.
Білки - це складні високомолекулярні азотвмісні з'єднання, що складаються з амінокислот, сполучених пептидними зв'язками. До складу білків входить 20 основних амінокислот.
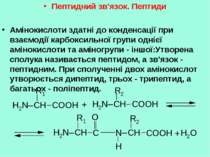
Амінокислоти До складу білків входять -амінокислоти, тобто такі, в яких аміногрупа розташована біля другого атома С. Між аміно- і карбоксильною групами знаходиться тільки один -С атом. В процесах обміну речовин утворюються і інші види амінокислот. Наприклад, -аміномасляна кислота (ГАМК) - є медіатором центральної нервової системи.
Відомо 20 -амінокислот, які генетично кодуються, і декілька їх похідних, що утворюються шляхом ферментативної модифікації. Загальну формулу -амінокислоти можна зобразити так: де R- вуглеводневий радикал. Радикал може бути аліфатичний або циклічний, містити різні функціональні групи. Одна із двадцяти -амінокислот (пролін) є не аміно-, а імінокислотою, тому що її атом азоту входить до складу циклу.
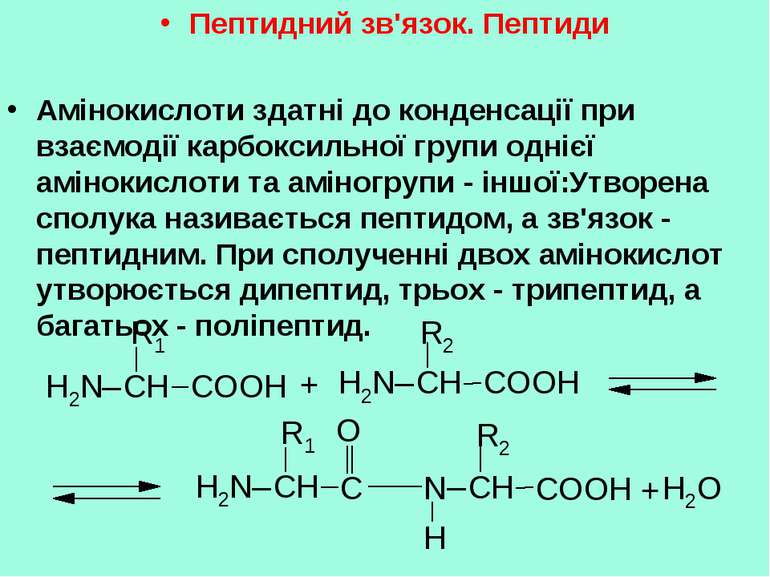
Пептидний зв'язок. Пептиди Амінокислоти здатні до конденсації при взаємодії карбоксильної групи однієї амінокислоти та аміногрупи - іншої:Утворена сполука називається пептидом, а зв'язок - пептидним. При сполученні двох амінокислот утворюється дипептид, трьох - трипептид, а багатьох - поліпептид.
Біологічні функції білків: пластична (структурна) каталітична (ферментативна) транспортна (транспортують живильні речовини, О2 і СО2, мінеральні, лікарські речовини, гормони, вітаміни) захисна (імунна, буферна, гемостатична) регуляторна (гормони білково-пептидної природи) енергетична механічна (скорочення м'язів і ін.)
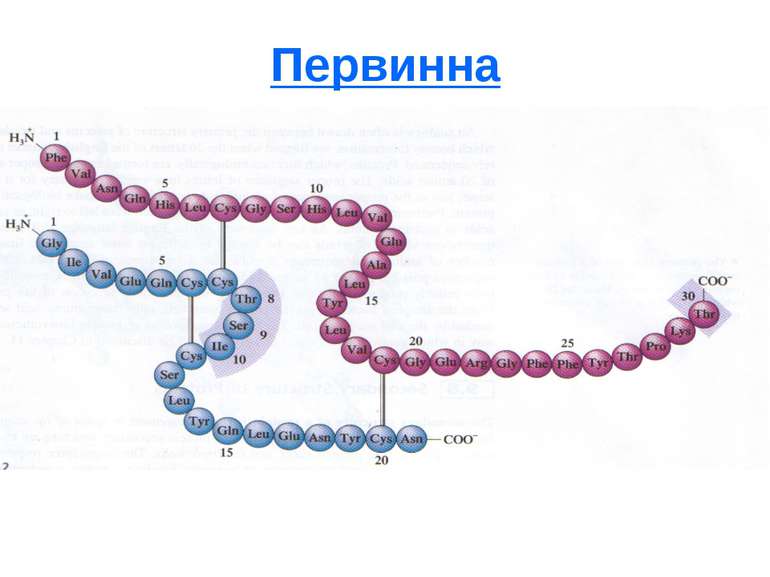
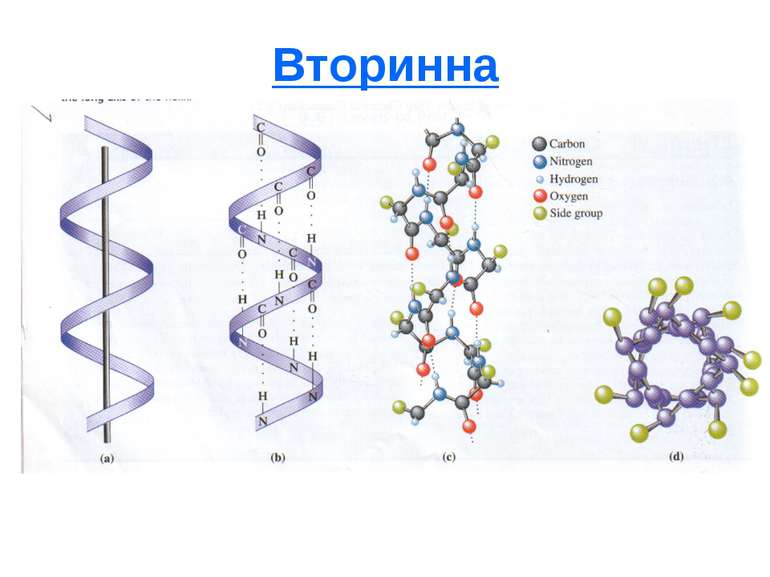
4 види структури білка Первинна - вказує на види амінокислот, їх кількість в даній молекулі білка і послідовність їх чергування. Має тільки пептидні зв'язки. Визначається по здатності деяких речовин (2,4 динітрофторбензол, фенілізотіоціанат, ферменти екзопептидази) специфічно приєднуватися до кінцевих амінокислот пептидного ланцюга. Вторинна - форма поліпептидного ланцюга, що регулярно повторюється, в просторі. Це спіраль (глобулярні білки) і β конфігурація (фібрілярні білки). Стабілізується водневими (частково дисульфідними) зв'язками. Ковалентний зв'язок: пептидний і дисульфідний Визначається спектрофотометричним методом.
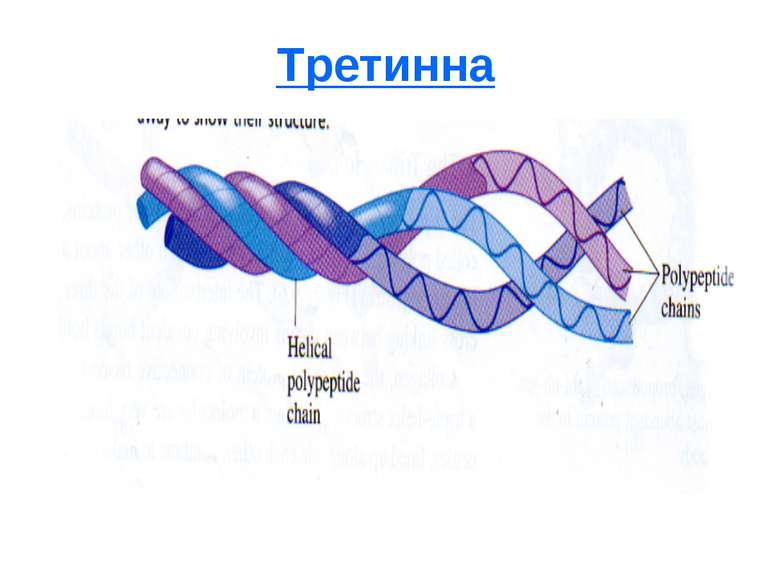
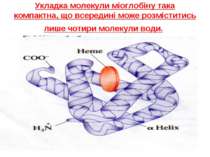
Третинна - вказує на форму білкової молекули (глобули, клубочки). Стабілізується водневими, дисульфідними, а також іонними (між полярними амінокислотами), гідрофобними (між аполярними амінокислотами). Визначається методом рентгеноструктурного аналізу. Четвертинна - мають тільки білки, які складаються з декількох поліпептидних ланцюгів з третинною структурою (протомерів). Молекулу такого білка називають олігомером. Протомери зв'язані водневими, іонними зв'язками (рідше - ковалентними). Приклад гемоглобін - складається з 2 - і 2 ланцюгів, сполучених з 4 молекулами гему.
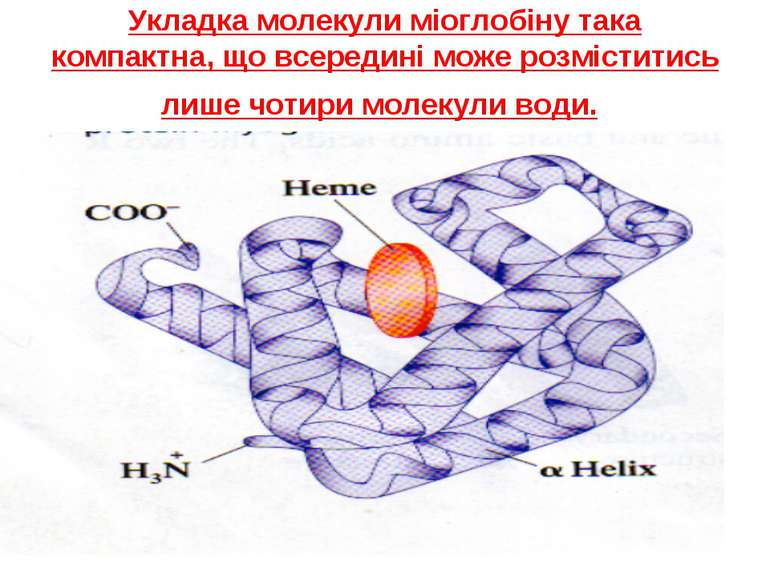
Укладка молекули міоглобіну така компактна, що всередині може розміститись лише чотири молекули води.
Доменні білки - це регулярно повторюючісь глобули, утворені одним поліпептидним ланцюгом. Мають окремі імуноглобуліни. Ці структури також визначаються рентгеноструктурним аналізом.
Физико-хімічні властивості білків молекулярна маса розчинність амфотерність електричний заряд, ізоелектрична точка здатність до осадження
Молекулярна маса білків знаходиться в межах від 5000 до декількох мільйонів. Визначається методом седиментації (за швидкістю осадження в ультрацентрифузі), фільтрацією гелю, електрофорезом. Розчинність (гідрофільність). У молекул білка на поверхні є вільні іоногенні групи (-СООН -NH2, - SH) амінокислот лізину, аргініну, глутамінової, аспарагінової кислот, цистеїну і ін. При розчиненні у воді вони утворюють іони, які притягають диполі води. Така орієнтація Н2О навколо молекул білка називається гідратною оболонкою.
Стабільність молекул білка в розчині визначається: Зарядом молекул білка Гідратною оболонкою Заряд білкових молекул залежить від співвідношення вільних - СООН і NH2 - груп ( тобто кислих і лужних амінокислот) і від рН середовища. Такий стан білка, при якому він не має заряду, називається ізоелектричним станом. рН середовища, при якому білок електронейтральний, називається ізоелектричною точкою білка. При цьому білок нестабільний в розчині, легко випадає в осад. Ізоелектрична точка кислих білків (більше за СООН - груп) знаходиться при рН менше 7,0, а лужних - при рН більше 7,0. Білки крові кислі, а рН крові 7,36 - 7,40, тому вони мають негативний заряд. Для альбумінів це рН - 4,7 Для глобулінів - рН - 6,5 При рН нижче за ізоелектричну точку білок набуває заряд «+». При рН вище за ізоелектричну точку - заряд «-».
Буферна функція білків означає, що білки здатні підтримувати рН середовища, тобто нейтралізувати надлишок кислоти і лугу. Така властивість білків, коли вони можуть проявляти в кислому середовищі властивості лугу, а в лужній властивості кислоти називається амфотерністю.
Осадження 1. Оборотнє 2. Необоротнє Приклад оборотного осадження: висолювання (осадження високими концентраціями нейтральних солей сульфату амонію (NH4)2SO4, NaCl і ін. При цьому відбувається конкуренція між молекулами білка і солі за воду. Білок від солі можна відокремити методом діалізу (використовують напівпроникну оболонку, через яку проходять тільки молекули солі).
Осадження Необоротне осадження - денатурація. Відбувається при дії високої температури, сильних кислот, солей важких металів, алкалоїдів, ультразвуку, радіації, високого тиску. При цьому білок втрачає свою нативну структуру, (окрім первинної), біологічні властивості.
Осадження Денатурація використовується в медичній практиці: При визначенні білка в сечі (осадження кислотами), при стерилізації інструментів, перев'язувального матеріалу, хірургічного одягу (температура, тиск), білок використовують як антидот при отруєнні солями важких металів (молоко, білок яєць), алкалоїдні реактиви використовуються як терпкі засоби при захворюваннях шлунку, кишечника, опіках і т.д.
Класифікація білків За фізико-хімічними властивостями За формою: фібрилярні і глобулярні За розчинністю: гідрофобні і гідрофільні За зарядом: катіонні, аніонні, нейтральні За походженням: рослинного, мікробного і тваринного походження За функцією: 1) ферменти, 2) гормони, 3) скоротливі За хімічною структурою: прості (апопротеїни) і складні (голопротеїни).
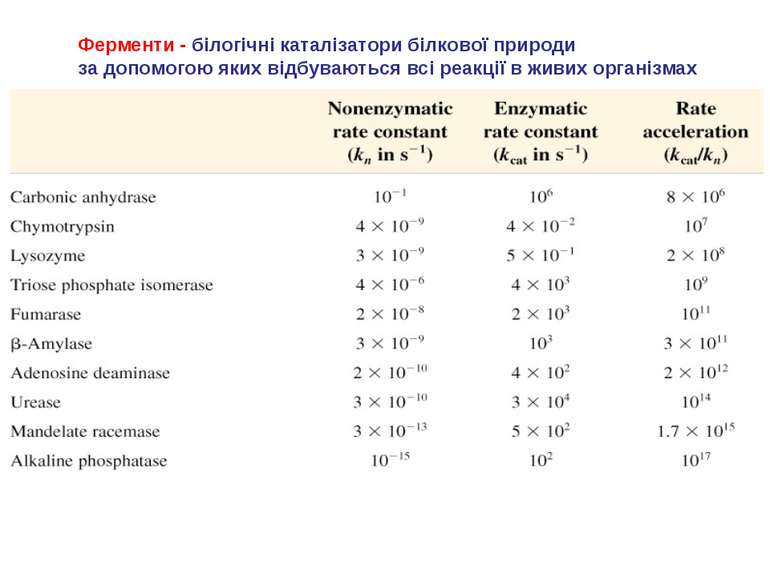
Ферменти - білогічні каталізатори білкової природи за допомогою яких відбуваються всі реакції в живих організмах
Коферменти Коферменти діють як переносники водню, електронів, груп атомів (1) Метаболічні коферменти – синтезуються з метаболітів Коферменти – похідні вітамінів Вітаміни не синтезуються в організмі і мусять бути отримані з їжею Класифікація коферментів
1. Каталізують тільки темодинамічно можливі реакції. 2. Не змінюються в процесі реакції. 3. Не змінюють точки рівноваги і напрямку реакції. 4. Каталізують реакції в мікрокількостях. 5. Діють формуючи транзитний комплекс із субстратом, таким чином стабілізуючи транзитний стан. Спільність між хімічними каталізаторами і ферментами:
Специфічні властивості ферментів: 1. Прискорюють реакції у більшому ступені, ніж неорганічні каталізатори 2. Специфічність дії 3. Чутливість до температури 4. Чутливість до pH
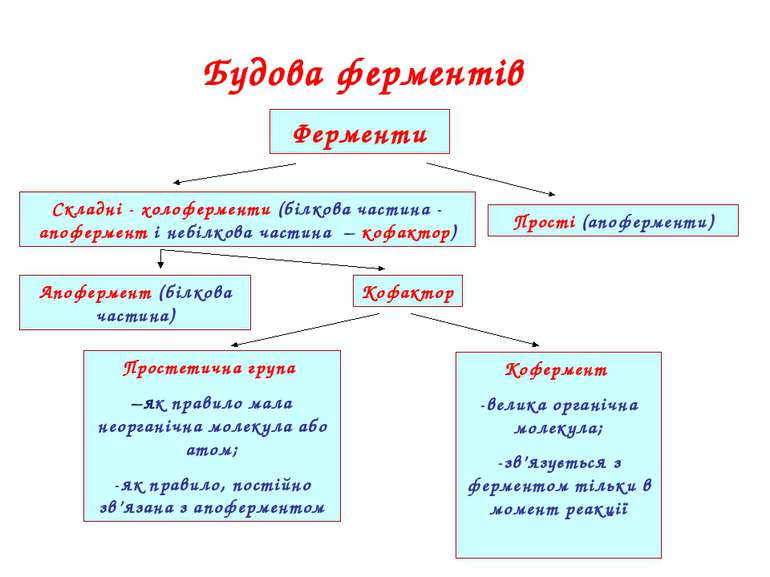
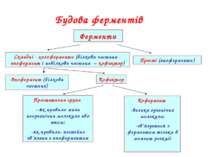
Будова ферментів Ферменти Складні - холоферменти (білкова частина - апофермент і небілкова частина – кофактор) Прості (апоферменти) Апофермент (білкова частина) Кофактор Простетична група –як правило мала неорганічна молекула або атом; -як правило, постійно зв’язана з апоферментом Кофермент -велика органічна молекула; -зв’язується з ферментом тільки в момент реакції
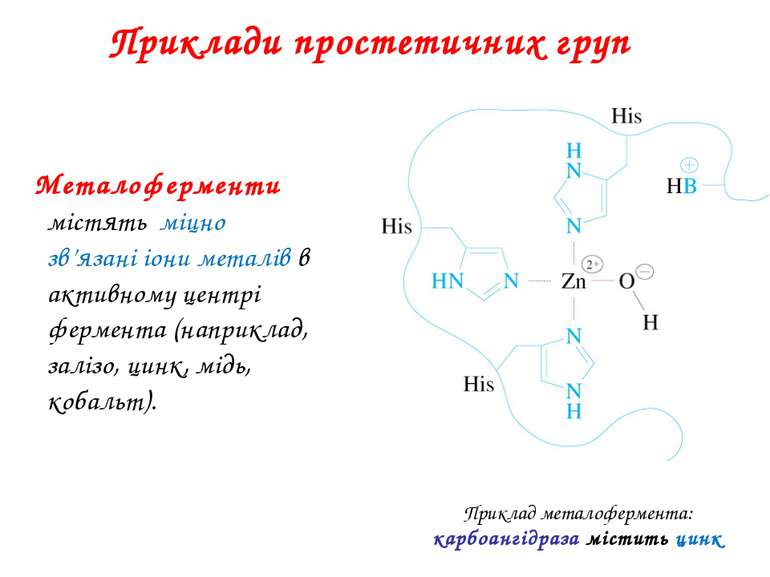
Приклади простетичних груп Металоферменти містять міцно зв’язані іони металів в активному центрі фермента (наприклад, залізо, цинк, мідь, кобальт).
Коферменти Коферменти діють як переносники водню, електронів, груп атомів (1) Метаболічні коферменти – синтезуються з метаболітів Коферменти – похідні вітамінів Вітаміни не синтезуються в організмі і мусять бути отримані з їжею Класифікація коферментів
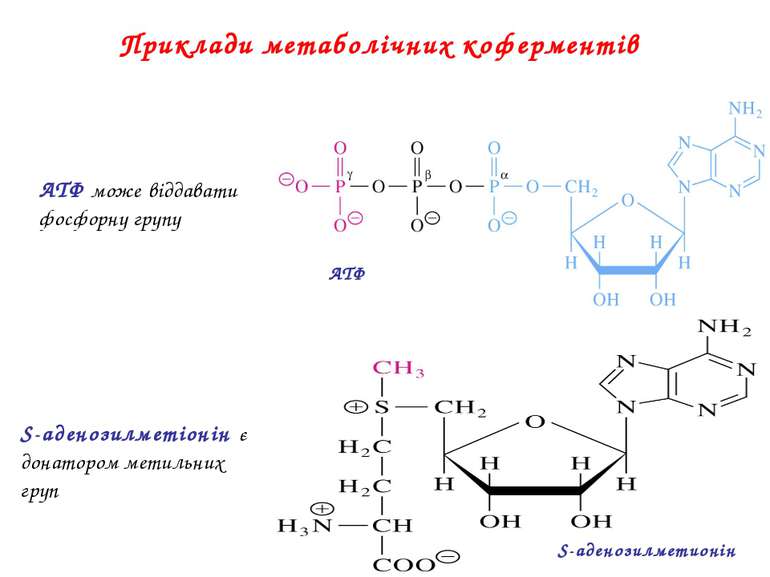
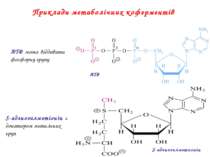
Приклади метаболічних коферментів ATФ S-аденозилметионін АТФ може віддавати фосфорну групу S-аденозилметіонін є донатором метильних груп
Коферменти – похідні вітамінів Вітаміни необхідні для синтезу коферментів повинні бути отримані з їжею Дефіцит вітамінів викликає недостатність відповідного кофермента і, як результат, розвиток хвороби
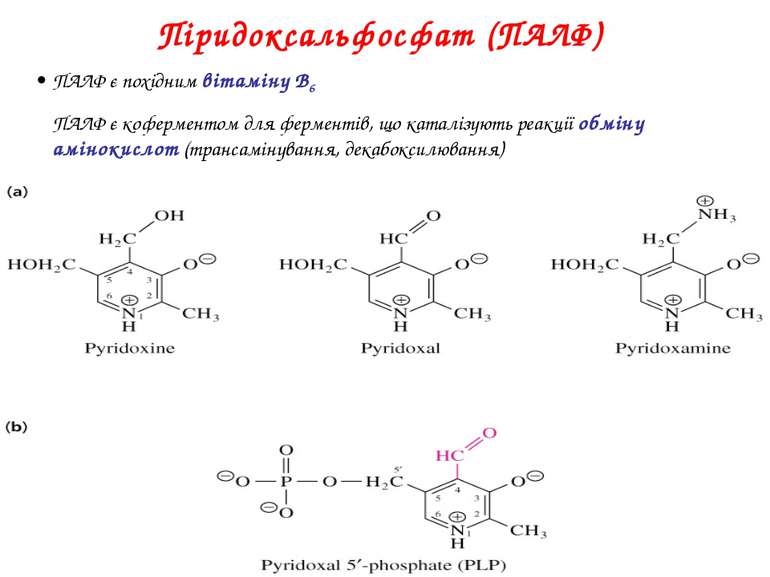
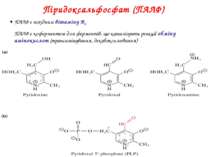
Піридоксальфосфат (ПАЛФ) ПАЛФ є похідним вітаміну B6 ПАЛФ є коферментом для ферментів, що каталізують реакції обміну амінокислот (трансамінування, декабоксилювання)
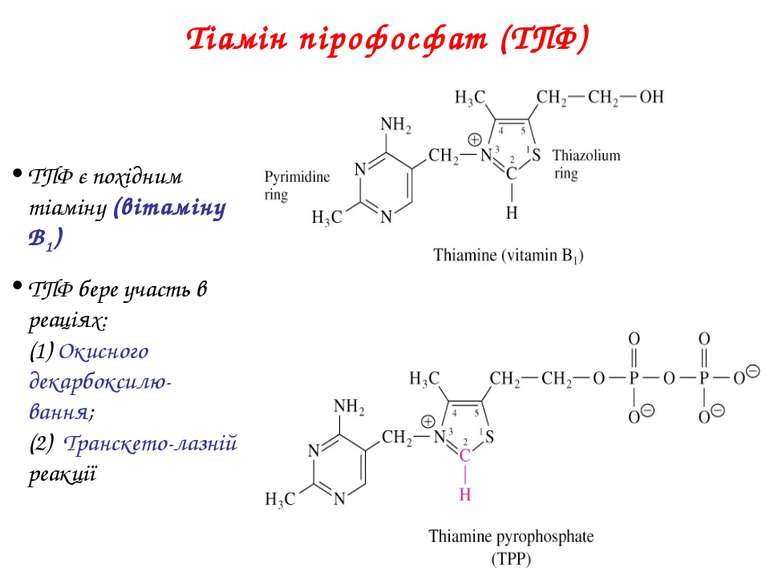
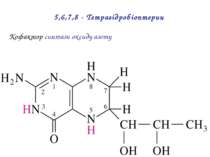
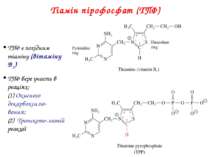
Тіамін пірофосфат (ТПФ) ТПФ є похідним тіаміну (вітаміну B1) ТПФ бере участь в реаціях: (1) Окисного декарбоксилю-вання; (2) Транскето-лазній реакції
Активні центри ферментів Активний центр – специфічна ділянка фермента до якої приєднується субстрат Субстрат, як правило, мала молекула Фермент – велика білкова молекула Тому субстрат приєднується до специфічної ділянки на ферменті
Характеристика активних центрів Специфічність (абсолютна, відносна(групова), стереоспецифічність) Мала трьохвимірна ділянка фермента. Субстрат взаємодіє тільки з 3-5 амінокислотними залишками. Залишки можуть бути далеко один від одного в послідовності амінокислот. Зв’язує субстрат за допомогою нековалентних слабких зв’язків. Розрізняють контактну і каталітичну ділянки Складний фермент в активному центрі містить кофактор або простетичну групу
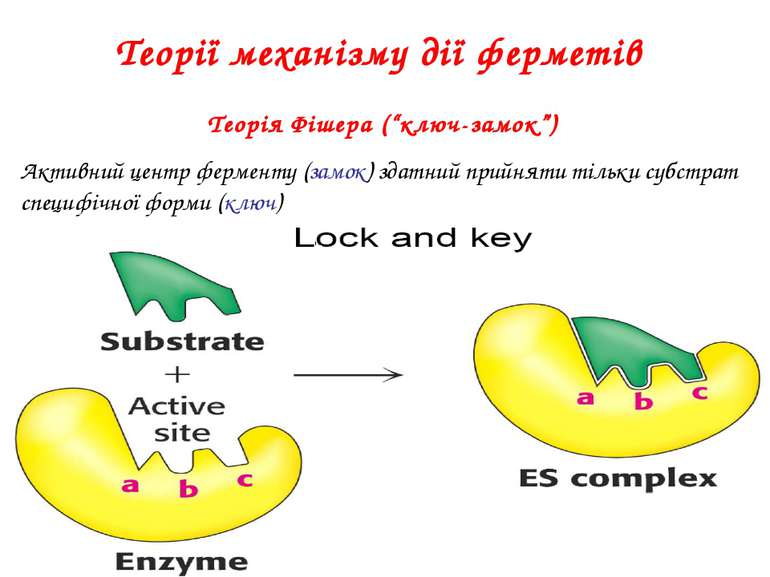
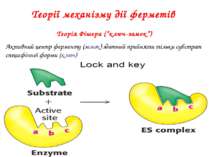
Теорії механізму дії ферметів Теорія Фішера (“ключ-замок”) Активний центр ферменту (замок) здатний прийняти тільки субстрат специфічної форми (ключ)
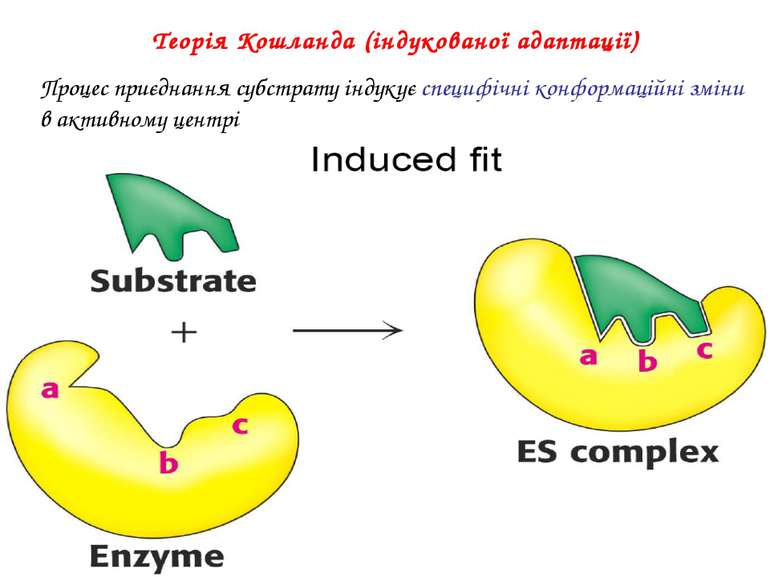
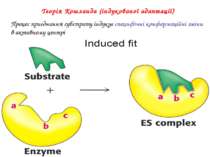
Теорія Кошланда (індукованої адаптації) Процес приєднання субстрату індукує специфічні конформаційні зміни в активному центрі
Властивості ферментів Специфічність дії Абсолютна – один фермент діє тільки на один субстрат (уреаза розщеплює тільки сечовину; аргіназа розщелює тільки аргінін) Відносна – одинфермент діє на різні субстрати які мають одинаковий тип зв’язку (пепсин розщеплює різні білки) Стереоспецифічність – деякі ферменти каталізують перетворення тільки субстратів, які знаходяться в певній геометричній конфігурації, цис- або транс-
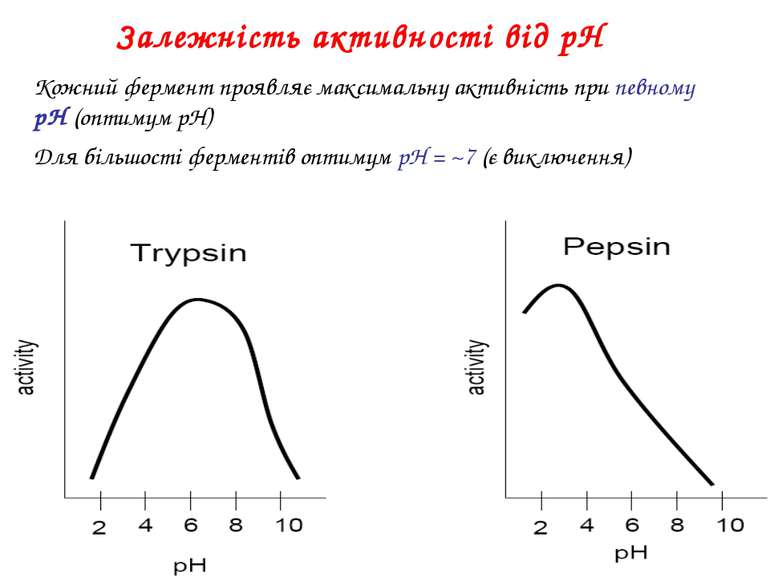
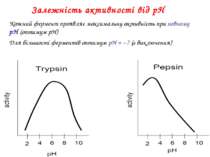
Залежність активності від рН Кожний фермент проявляє максимальну активність при певному pH (оптимум pH) Для більшості ферментів оптимум pH = ~7 (є виключення)
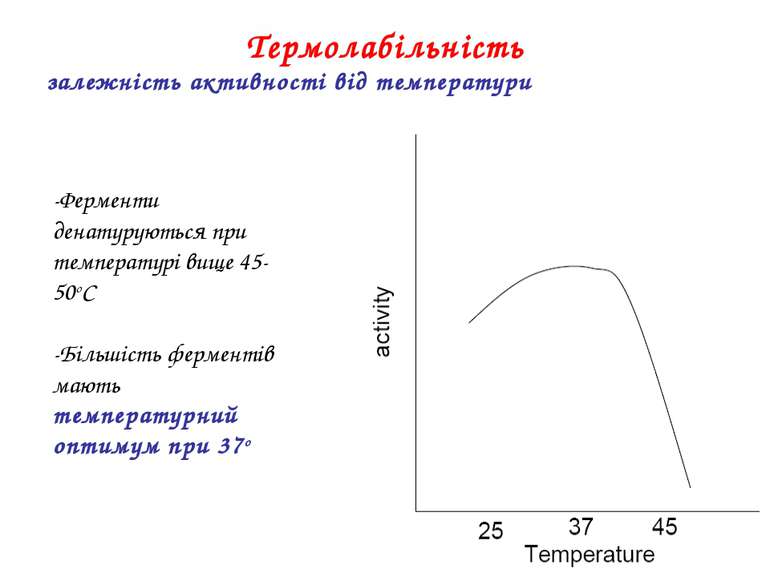
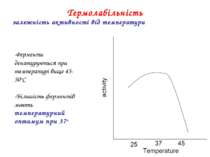
-Ферменти денатуруються при температурі вище 45-50oC -Більшість ферментів мають температурний оптимум при 37o Термолабільність залежність активності від температури
Класифікація ферментів Загальні назви Утворюються додаванням суфікса –аза до назви субстрату Приклад: - тирозиназа – окислює тирозин; - мальтаза – гідролізує мальтозу Загальні назви не описують хімізму реакції Тривіальні назви Приклад: пепсин, каталаза, трипсин. Не дають інформації про субстрат, продукт чи хімізм реакції
Принципи міжнародної класифікації Шість класів відповідно до типу реакції Кожний фермент має класифікаційний номер, що складається з чотирьох цифр: EC: 2.3.4.2 Перша цифра – клас фермента; друга – підклас; третя – підпідклас; четверта – порядковий номер фермента в підпідкласі.
Інгібування Ферментів Різні хімічні агенти (метаболіти, аналоги субстратів, токсини, лікарські засоби, метали і ін.) можуть інгібувати активність ферментів Інгібітор – зв’язується з ферментом і попереджає формування комплекса ЕS або його розщеплення до E + P
Зворотні і незворотні інгібітори Зворотні інігібітори – після зв’язування з ферментом (утворення EI комплексу) швидко дисоціює Фермент пригнічений тільки коли зв’язаний з інгібітором EI комплекс утримується разом за допомогою слабких нековалентних зв’язків Три типи зворотнього інгібування: Конкурентне, Неконкурентне, Безконкурентне
Конкурентне гальмування •Інгібітор за структурою подібний до субстрату, тому зв’язується з тим самим активним центром •Фермент не може розрізнити інгібітор і субстрат •Приєднання інгібітора до активного центру попереджує зв’язування субстрату •Конкурентний інгібітор знижує швидкість каталізу зменшуючи кількість молекул ферменту, зв’язаних із субстратом •Інгібітор може бути витіснений з активного центру шляхом збільшеня концентрації субстрату Зворотнє інгібування
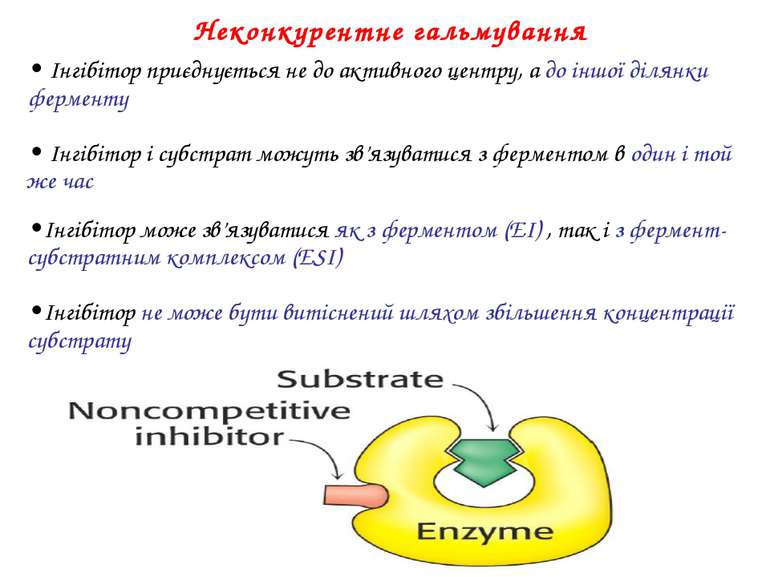
• Інгібітор приєднується не до активного центру, а до іншої ділянки ферменту • Інгібітор і субстрат можуть зв’язуватися з ферментом в один і той же час •Інгібітор може зв’язуватися як з ферментом (EI) , так і з фермент-субстратним комплексом (ESI) •Інгібітор не може бути витіснений шляхом збільшення концентрації субстрату Неконкурентне гальмування
Поліферментні комплекси - різні ферменти, що каталізують послідовні реакції одного процесу і простоово розміщуються в одному місці -продукт однієї реакції переноситься прямо на активний центр наступного ферменту -значно підвищується швидкість реакції Поліфункціональні ферменти – в залежності від умов один фермент може мати різні (часом протилежні) активності Поліферментні комплекси і поліфункціональні ферменти
Схожі презентації
Категорії