Презентація на тему:
Співвідношення об’ємів газів у хімічних реакціях. Обчислення об’ємних співвідношень газів за хімічними рівняннями
Завантажити презентацію
Співвідношення об’ємів газів у хімічних реакціях. Обчислення об’ємних співвідношень газів за хімічними рівняннями
Завантажити презентаціюПрезентація по слайдам:
Співвідношення об’ємів газів у хімічних реакціях. Обчислення об’ємних співвідношень газів за хімічними рівняннями
Запитання Порівняйте фізичні властивості алканів, алкенів і алкінів. Назвіть загальні хімічні властивості вуглеводнів. Які реакції (приєднання, заміщення) характерні для алканів? Чому? Які реакції (приєднання, заміщення) характерні для алкенів? Чому?
З наведених на дошці речовин виберіть ті, що знебарвлюють бромну воду. Наведіть приклад рівнянь реакцій.
Вивчення нового матеріалу Амедео Авогадро сформулював закон: В однакових об’ємах різних газів міститься однакова кількість молекул. А. Авогадро зробив висновок, що, якщо взяти 1 моль, тобто 6,02·1923 молекул будь-яких газів, то вони займатимуть однаковий об’єм. Але при цьому вимірюватися цей об’єм має за однакових умов, тобто за однакових температури й тиску.
Нормальні умови (н. у.): Т = 273 К або t = 0°С; Р = 101,3 кПа або Р = 1 атм. = 760 мм рт. ст. Об’єм 1 моль речовини називають молярним об’ємом (Vm). Для газів за нормальних умов він дорівнює 22,4 л/моль. Відповідно до закону Авогадро, 1 моль будь-якого газу займає однаковий об’єм, що за нормальних умов дорівнює 22,4 л/моль.
Завдання 2 Обчисліть, який об’єм кисню потрібен для спалювання 1 м3 метану. Відповідь: 2 м3 кисню.
Завдання 3 Обчисліть об’єм ацетилену, для повного гідрування якого витратили 20 л водню. Відповідь: 10 л ацетилену.
Завдання 4 Обчисліть об’єм кисню, що потрібен для спалювання 40 л суміші, яка містить 20 % метану, 40 % етану й 40 % етену. C2H6 + 3,5O2 → 2CO2 + 3H2O C2H4 + 3O2 → 2CO2 + 2H2O CH4 + 2O2 → CO2 + 2H2O V (C2H4) = 40·0,2 = 8 (л). V (CH4) = 40·0,4 = 16 (л). V (C2H2) = 16 л. V (O2) = 16 + 40 +48 = 104 (л). Відповідь: 104 л кисню.
Завдання 5 Обчисліть об’єм водню, який потрібен для повного гідрування речовини Х. Варіант Об’єм речовини Х, л Формула речовини Х Рівняння гідрування Об’єм водню, л 1 10 C 3 H4 2 15 C 2 H2 3 25 C 2 H4 4 18 C 3 H6 5 20 C 3 H4 6 35 C 2 H2 7 10 C 4 H8 8 20 C 3 H6 9 28 C 2 H2 10 17 C 2 H4
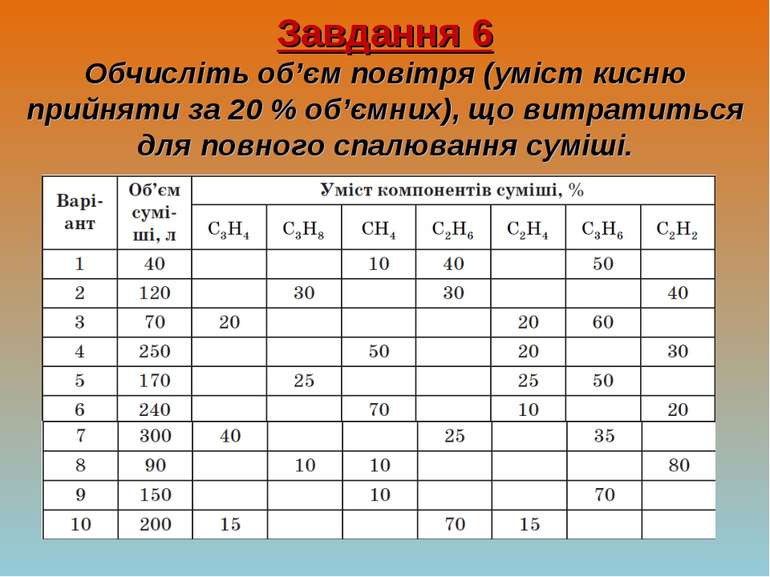
Завдання 6 Обчисліть об’єм повітря (уміст кисню прийняти за 20 % об’ємних), що витратиться для повного спалювання суміші.
Домашнє завдання Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Схожі презентації
Категорії