Презентація на тему:
Коригувальні гнучкі елементи щодо галузі охорони здоров’я
Завантажити презентацію
Коригувальні гнучкі елементи щодо галузі охорони здоров’я
Завантажити презентаціюПрезентація по слайдам:
Коригувальні гнучкі елементи щодо галузі охорони здоров’я «Права інтелектуальної власності та доступ до основних лікарських засобів: проблеми та можливості у переговорах щодо угод про вільну торгівлю, багатосторонніх інструментах і національному законодавстві» 21-22 червня 2010 р., Київ, Україна Тену Афавіа Група з ВІЛ/СНІДу, ПРООН
Основні коригувальні гнучкі елементи ТРІПС Загальні принципи (статті 7 і 8) Паралельний імпорт Обов'язкове ліцензування і використання державою Обмежені винятки з патентних прав Застосування законодавства про конкуренцію
Цілі Угоди ТРІПС (стаття 7) “Захист та контроль за дотриманням прав інтелектуальної власності повинні сприяти запровадженню технологічних нововведень та передачі і розповсюдженню технологій для обопільної вигоди виробників і користувачів технологічних знань у такий спосіб, що сприяє соціальному та економічному добробуту, а також балансу прав і обов'язків”.
Принципи Угоди ТРІПС (стаття 8) “Члени можуть при формулюванні або внесенні змін та доповнень до своїх законів і правил здійснювати заходи, необхідні для захисту здоров'я та харчування населення, а також спонукати суспільний інтерес у секторах, життєво важливих для їх соціально-економічного та технологічного розвитку, за умови, що такі заходи узгоджуються з положеннями цієї Угоди. Відповідні заходи за умови, що вони відповідають положенням цієї Угоди, можуть бути необхідні, щоб запобігти зловживанню правами інтелектуальної власності власниками цих прав”.
Паралельний імпорт Стаття 6 Угоди ТРІПС “Для цілей врегулювання суперечок за цією Угодою, згідно з положеннями Статей 3 та 4, ніщо в цій Угоді не використовується для вирішення питання вичерпання прав інтелектуальної власності”. Надає країнам право імпортувати патентований продукт із будь-якої іншої держави-члена СОТ, де продукт запатентований, за меншою ціною. Отримувати згоду власника патенту непотрібно. Дохійська декларація про Угоду ТРІПС і громадське здоров’я підтверджує право вибирати вичерпання прав: національний, регіональний або міжнародний режим. Рекомендація: міжнародне вичерпання.
Приклади практики паралельного імпорту в інших державах Кенія: Закон про промислову власність (2001) Розділ 58.2. Обмеження прав. Права за патентом не поширюються на дії стосовно виробів, випущених на ринок у Кенії чи в будь-якій іншій країні або імпортованих до Кенії”. Стаття 37 Положення про промислову власність (2002). Обмеження права за патентом у розділі 58(2) цього Закону поширюється на дії стосовно виробів, імпортованих із країни, де ці вироби були законним чином випущені на ринок. Індія: Патентний закон Індії, стаття 107А “Певні дії не вважаються порушенням. Для цілей цього Закону: імпорт патентованих продуктів будь-якою особою від особи, яка належним чином уповноважена законом виробляти та продавати та розповсюджувати даний виріб, не вважається порушенням патентних прав”.
Поправка до Закону ПАР про контроль над лікарськими засобами та супутніми речовинами (1997) Розділ 15(С) уповноважує Міністра приписувати умови постачання доступних за ціною ліків, зокрема паралельний імпорт. Паралельний імпорт визначений у даному законі наступним чином: як ввезення лікарського засобу, захищеного патентом / зареєстрованого у ПАР; випущеного на ринок поза межами ПАР власником патенту чи за його згоди. Асоціація фармацевтичних підприємств (АФП) подала до Вищого суду заяву на предмет того, щоб запобігти набуття законом чинності. У скаргах зазначалося, що положення є надто широкими та передбачають нерегульоване обов'язкове ліцензування. Активна національна і міжнародна кампанія призвела до того, щоб АФП відкликала заяву. Після цього Міністерство охорони здоров’я випустило заяву про те, що вищезазначений закон буде застосовуватися тільки для паралельного імпорту.
Обов'язкова ліцензія – стаття 31 Також регламентується статтею 5 Паризької конвенції 1883 року, яку підписала Україна. Видача ліцензії третій особі для використання патенту без згоди його власника. Держави-члени СОТ зберігають за собою право визначати підстави для видачі обов'язкової ліцензії (підтверджено у Дохійській декларації). Типові підстави для видачі обов'язкової ліцензії: - в інтересах суспільства; - надзвичайна ситуація в країні чи інші обставини крайньої необхідності; - для усунення недоліків у громадському здоров’ї та харчуванні; - невикористання або недостатня робота; - усунення антиконкурентної практики (стаття 40). Обов'язкові ліцензії видавалися у кількох країнах із високим, середнім і низьким рівнем доходів; багатовіковий коригувальний захід, обмежуючий монопольні права власника патенту.
Умови видачі ОЛ Щоб отримати обов'язкову ліцензію, необхідно показати, що попередні переговори на прийнятних умовах для отримання дозволу від власника патенту не мали успіху. За винятком випадків, коли ОЛ видається на наступних підставах: - обставини крайньої необхідності, зокрема криза у галузі охорони здоров’я населення; - некомерційне використання в інтересах суспільства (накази про використання державою); - усунення антиконкурентної практики. ОЛ повинна супроводжуватися виплатою “адекватної винагороди” власникові патенту (стаття 31(h)). - Див. Керівні принципи ПРООН/ВООЗ щодо виплати винагороди. - Нещодавно використовувалося урядом Еквадору при видачі ОЛ. ОЛ має видаватися переважно для забезпечення внутрішнього ринку (стаття 31(f)). Власник патенту повинен бути поінформований якомога швидше, наскільки це практично можливо.
Накази про використання державою Використання державою обов'язкових ліцензій. “Некомерційне використання в інтересах суспільства”. Уряд (відомство, департамент або державний підрядник) використовує патент в інтересах суспільства без згоди власника патенту. Прискорена методика. Попередні переговори з власником патенту не потрібні (стаття 31(b)). Власник патенту повинен бути поінформований якомога швидше, наскільки це практично можливо. Виплата “адекватної винагороди” власникові патенту.
Індонезія жовтень 2004 ВД (виробництво) - ламівудин, невірапін 7-8 років (термін дії патенту, що залишився) 0,5% чистої продажної вартості АРВ власникові патенту Малайзія жовтень 2003 ВД для імпорту: диданозін, зідовудин, диданозін+зідовудин 2 роки Пропонувалося 4% Таїланд листопад 2006 ВД для імпорту/виробництва: іфавіренц До 31 грудня 2011 р. 0,5% Таїланд січень 2006 ВД для імпорту/виробництва: клопідогрель Термін дії патенту закінчився, або він більше не потрібний 0,5% Таїланд січень 2007 ВД для імпорту/виробництва: лопінавір/ритонавір До 31 січня 2012 р. 0,5% загального обсяг продажу імпортованого/ випущеного у країні Таїланд січень 2008 3 ліцензії на використання державою на протипухлинні ліки Термін дії патенту закінчився, або він більше не потрібний 3-5% Бразилія травень 2007 ВД на імпорт іфавіренца 5 років 1,5%
Обов'язкові ліцензії, видані в Таїланді у 2006-2008 рр. У 2001 р. у Таїланді було впроваджено загальну систему медичного страхування. З 2003 р. уряд проводить політику загального доступу до антиретровірусних препаратів. За 2001-2007 роки Таїланд збільшив витрати на доступ до препаратів для лікування ВІЛ/СНІДу вдесятеро, і за цим показником лідирує серед країн, що розвиваються, з доходами нижче середнього рівня. У доповіді Світового банку щодо Таїланду за 2006 рік відзначено невдачу переговорів щодо цін. У листопаді 2006 р. Таїланд видав наказ на використання державою іфавіренцу (АРВ препарату 1 лінії). У січні 2007 р. уряд видав наказ на використання калетри (АРВ комбінація 2 лінії лопінавіру та ритонавіру) та клопідогрелю (для серцевих захворювань). Таїланд стикнувся з активним протестом із боку фармацевтичних компаній-власників патенту. Використання гнучкості ТРІПС вітали декілька агенцій ООН і НУО. У січні 2008 р. уряд видав наказ на використання летрозолу, доцетакселю, ерлотінібу та іматінібу (всі ці препарати – для лікування раку).
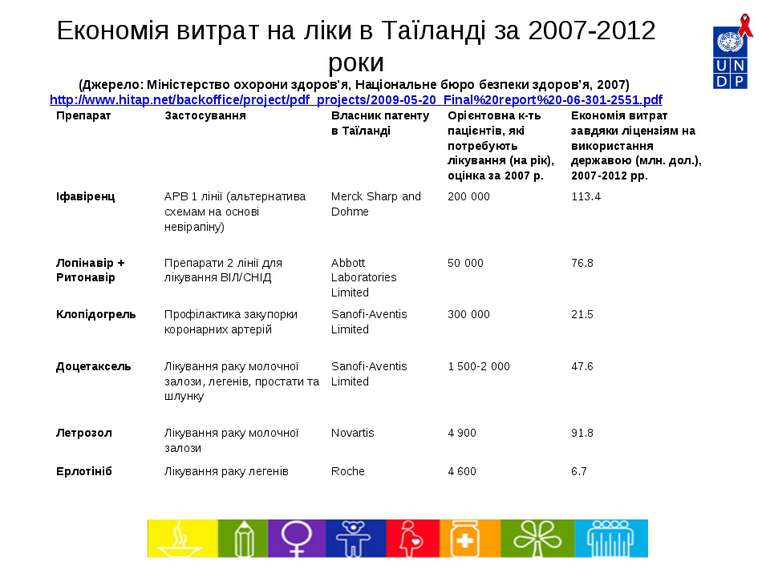
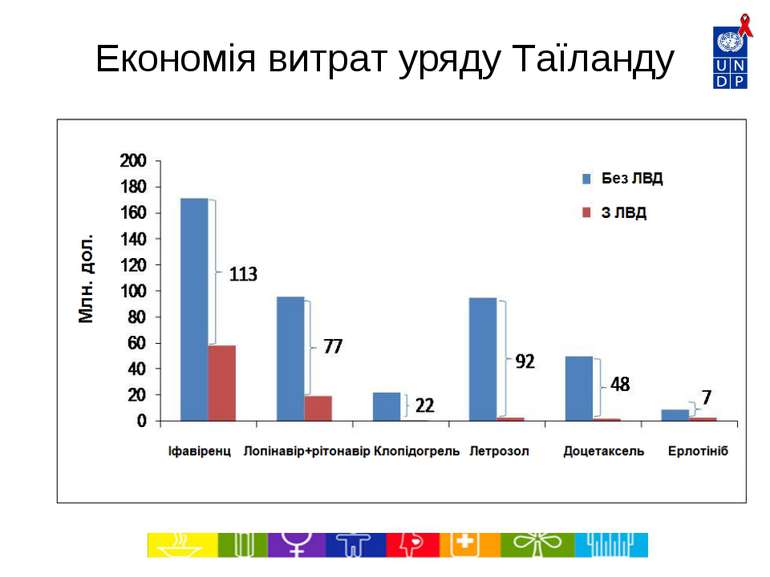
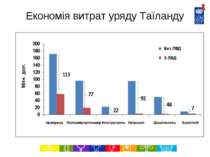
Економія витрат на ліки в Таїланді за 2007-2012 роки (Джерело: Міністерство охорони здоров’я, Національне бюро безпеки здоров’я, 2007) http://www.hitap.net/backoffice/project/pdf_projects/2009-05-20_Final%20report%20-06-301-2551.pdf Препарат Застосування Власник патенту в Таїланді Орієнтовна к-ть пацієнтів, які потребують лікування (на рік), оцінка за 2007 р. Економія витрат завдяки ліцензіям на використання державою (млн. дол.), 2007-2012 рр. Іфавіренц АРВ 1 лінії (альтернатива схемам на основі невірапіну) Merck Sharp and Dohme 200 000 113.4 Лопінавір + Ритонавір Препарати 2 лінії для лікування ВІЛ/СНІД Abbott Laboratories Limited 50 000 76.8 Клопідогрель Профілактика закупорки коронарних артерій Sanofi-Aventis Limited 300 000 21.5 Доцетаксель Лікування раку молочної залози, легенів, простати та шлунку Sanofi-Aventis Limited 1 500-2 000 47.6 Летрозол Лікування раку молочної залози Novartis 4 900 91.8 Ерлотініб Лікування раку легенів Roche 4 600 6.7
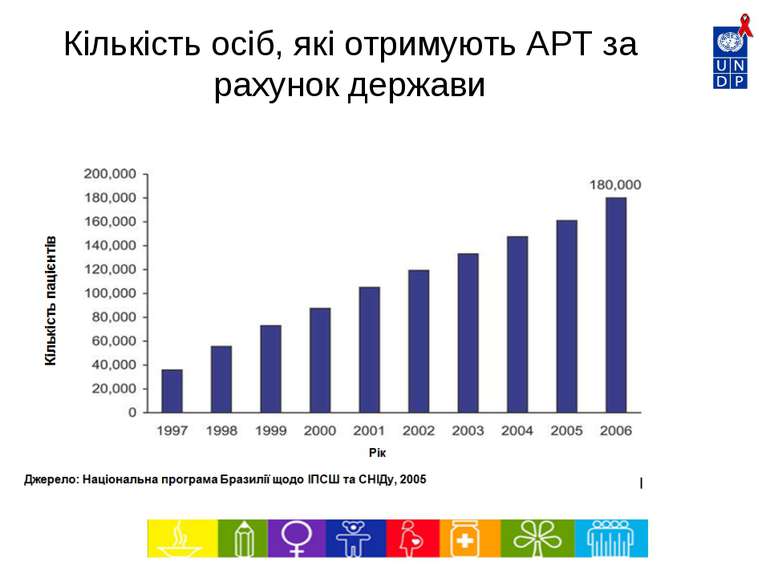
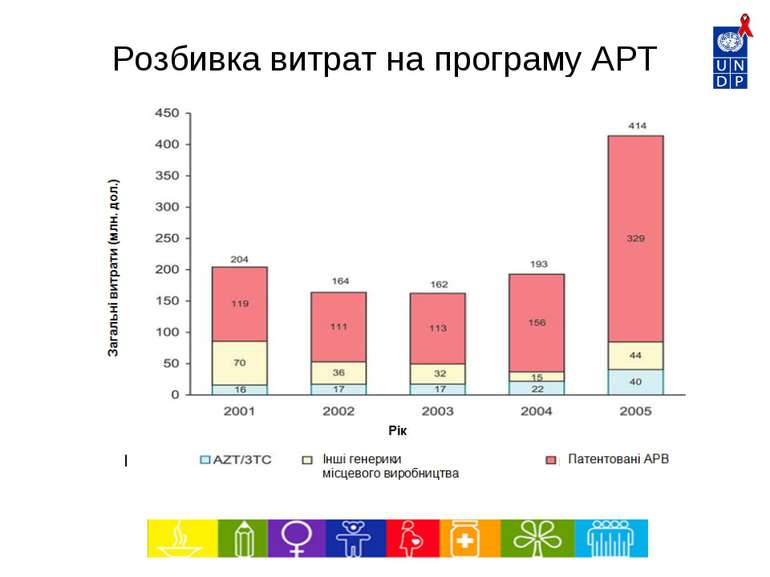
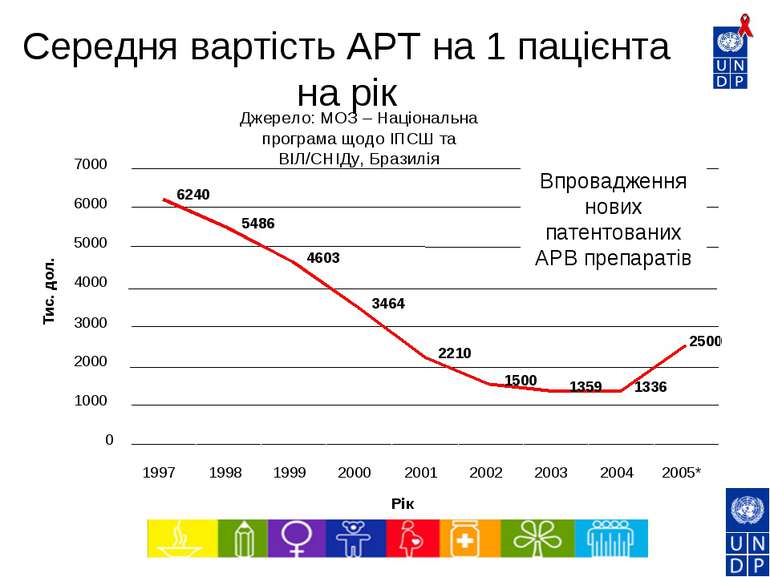
6240 5486 4603 3464 2210 1500 1359 1336 2500 0 1000 2000 3000 4000 5000 6000 7000 1997 1998 1999 2000 2001 2002 2003 2004 2005* Рік Тис. дол. Впровадження нових патентованих АРВ препаратів Джерело: МОЗ – Національна програма щодо ІПСШ та ВІЛ/СНІДу, Бразилія Середня вартість АРТ на 1 пацієнта на рік
Використання обов'язкових ліцензій у Бразилії Калетра Калетра – важливий компонент лікування 2 лінії, його застосовують 25 тис. пацієнтів у Бразилії. Бразилія імпортувала калетру за ціною 1,17 дол. за 1 табл., місцеві виробники могли виготовляти її за 0,41 дол./табл. Бразилія погрожувала видати ОЛ на місцеве виробництво. Тривалі переговори призвели до зниження ціни з 1,17 до 0,63 дол. та укладення угоди про передачу технології виробництва бразильських генериків. Іфавіренц 38% бразильців використовували іфавіренц за ціною 1,59 дол./табл., або 580 дол. на 1 пацієнта на рік. Компанія MSD пропонувала Таїланду іфавіренц по 245 дол. на 1 пацієнта на рік, або 0,65 дол./табл., і все одне Таїланд видав ОЛ. ЮНІСЕФ зміг закупити іфавіренц, попередньо перевірений на відповідність умовам ВООЗ, за ціною 166 дол. на 1 пацієнта на рік. Бразильський уряд у період з березня 2006 р. до квітня 2007 р. намагався обговорити зниження ціни, але MSD запропонувала мінімум 1,10 дол./табл. Бразилія видала обов'язкову ліцензію на місцеве виробництво іфавіренцу за ціною 0,45 дол./табл.
Досвід обов'язкового ліцензування в Мозамбіку 4 травня 2004 р. Міністерство промисловості та торгівлі видало Указ №18/99. В ОЛ було сказано, що на кінець 2002 р. у Мозамбіку понад 1,5 млн. людей жило зі СНІДом. В ОЛ було згадано гнучкість, яку забезпечує Дохійська декларація: “АРВ препарати вже доступні… власники міжнародних патентів не забезпечили такі препарати за доступними цінами для більшості громадян Мозамбіку”. “потрійна комбінація ламівудину, ставудину та невірапіну виявилася… однім із найбільш ефективних АРВ засобів, але три міжнародні власники патентів на такі окремі препарати не дійшли згоди щодо виробництва цієї комбінації”. Компанії Pharco Mozambique Ltd була видана ОЛ на виробництво3TC, D4T та NVP. Загальний обсяг ліцензійних платежів був встановлений за ставкою 2% від загального обігу. Термін дії ОЛ привязаний до “надзвичайної ситуації в країні”, створеної пандемією ВІЛ/СНІДу. Ціна АФІ означала, що місцеве виробництво було нерентабельним.
Уроки, винесені з досвіду Мозамбіку Не ясно, чи були патенти на 3TC, D4T і NVP видані у Мозамбіку. Інформацію щодо реєстрації патентів іноді дуже складно відшукати. Власники патентів часто мають декілька патентів на один препарат у різних формах, і патентні установи інколи не знають, що саме патентується. Ліцензійні платежі були малими, але вони могли б бути й меншими. Згідно з доповіддю ВООЗ/ПРООН щодо ліцензійних платежів на основі ІЛР, для Мозамбіку ці платежі могли б бути обмежені цифрою 0,16%. http://www.who.int/medicines/areas/technical_cooperation/WHOTCM2005.1_OMS.pdf
Загальні винятки з патентних прав Стаття 30 “Члени можуть надавати обмежені винятки з виключних прав, що надаються патентом, за умови, що такі винятки не будуть суттєво суперечити нормальному використанню патенту та завдавати суттєвої шкоди законним інтересам власника патенту, з огляду на інтереси третіх сторін”. Дозволяє третій стороні використовувати патент у зазначений та обмежений спосіб без згоди власника патенту. Виправдано, тому що за певних обставин обмежене використання запатентованих винаходів потрібно для досягнення цілей державної політики щодо заохочення інновацій та сприяння виробництву генеричних лікарських засобів. Приклади: дослідження, експериментальне використння у наукових або комерційних цілях; ранній виняток у робочому порядку (“виняток Болар”): використання патенту до закінчення строку його дії для затвердження для генериків; виняток для навчальних і освітніх цілей; попереднє використання; Індивідуальні приписи.
Виняток Болар Виробники генериків повинні подавати дані про біоеквівалентність для отримання дозволу на збут; це може зайняти багато років. Передбачає використання запатентованого продукту (тобто термін дії патенту повинен закінчитися для використання у формуванні даних). Без винятку Болар фактичний термін дії патенту може дорівнювати 20 рокам плюс час, потрібний для отримання даних / дозволу на збут. Roche Products Inc проти Bolar Pharmaceuticals та інших. Виняток Болар у законодавстві США (1984): виробництво генериків може початися у день закінчення терміну дії патенту. Це означає, що можна використовувати патентований продукт для виробництва генерика, коли термін дії патенту ще не сплив. Включений до законів багатьох країн, наприклад, Канади, Австралії, ПАР.
Спір між ЄК та Канадою у СОТ щодо винятку Болар У 1993 р. Канада внесла зміни у свій патентний закон, щоб передбачити виняток, схожий на виняток Болар: - Положення Болар у законодавстві Канади дозволяє виробництво на наступний день після закінчення терміну дії патенту. - Також допускається нагромадження генерика протягом шести місяців до закінчення терміну дії патенту. - Європейська Комісія заперечила обидва положення, і у 1998 році звернулася до механізму врегулювання спорів СОТ. Орган СОТ із урегулювання спорів визначив, що ранній виняток у робочому порядку відповідає статті 30 ТРІПС. Орган також визначив, що нагромадження не відповідає статті 30 (див. WT/DS114/R).
Антиконкурентні заходи Стаття 40 п. 1 “Члени домовляються, що деяка ліцензійна практика або умови, які мають відношення до прав інтелектуальної власності, що обмежують конкуренцію, можуть мати негативні наслідки для торгівлі і можуть бути перешкодою для передачі та розповсюдження технологій”. Стаття 40 п. 2 “Ніщо в цій Угоді не перешкоджає Членам визначати у своєму законодавстві ліцензійну практику та умови, які можуть в окремих випадках означати зловживання правами інтелектуальної власності, що негативно впливатиме на конкуренцію на відповідному ринку”. Стаття 31 п. (k) “Члени не зобов'язані застосовувати умови, викладені у підпараграфах (b) та (f), де таке використання дозволяється для виправлення практики, яку визначено після судового або адміністративного процесу як антиконкурентну”. Тобто обов'язкова ліцензія, видана для антиконкурентних дій, не потребує попередніх переговорів із власником патенту чи виконання умови про те, що вироблені ліки повинні бути призначені здебільшого для місцевого споживання.
Законодавство про конкуренцію як гнучкий елемент ТРІПС: досвід ПАР Розділ 49 Закону ПАР про конкуренцію дозволяє “будь-якій особі подавати скаргу на гадану заборонену практику”. Люди, які живуть із СНІДом, подали скаргу на компанії GSK та BI щодо зависоких цін на певні АРВ препарати, що робить ці компанії безпосередньо відповідальними за передчасну смерть ЛЖС. Hazel Tau та інші проти GlaxoSmithKline та Boehringer Ingelheim. Скаржники стверджували, що навіть з урахуванням витрат на дослідження і розробки чинні ціни є надмірно високими. Комісія з конкуренції вирішила, що стягувані ціни є надмірно високими, та направила справу до суду з питань конкуренції. GSK і BI врегулювали справу у позасудовому порядку, уклавши нові добровільні ліцензії. Нові “добровільні” ліцензії мали хороші умови, ставка ліцензійних платежів була знижена з 40% до 5%. Обмеження на використання всередині країни усунені, виробники генериків тепер можуть експортувати їх до країн регіону на південь від Сахари.
Висновки Угода ТРІПС має мінімальні зобов'язання для України, але містить багато гнучких елементів. Включення цих гнучких елементів у національне законодавство має керуватися стратегічними внутрішніми цілями. Включення в законодавство іноді можна використовувати як переговірний засіб для зниження цін (наприклад, калетра у Бразилії, Кенія). Користуючись цією гнучкістю, можна підтримувати доступність за ціною національних програм лікування. Країнам слід бути уважними, підписуючи угоди про вільну торгівлю, що містять положення, обмежуючі використання гнучкості.
Схожі презентації
Категорії