Презентація на тему:
Загальна характеристика d-елементів. Типи хімічних реакцій за їх участю. d-Елементи IВ групи. Купрум, Арґентум, Аурум. d-Елементи IІВ групи. Цинк, Кадмій, Меркурій
Завантажити презентацію
Загальна характеристика d-елементів. Типи хімічних реакцій за їх участю. d-Елементи IВ групи. Купрум, Арґентум, Аурум. d-Елементи IІВ групи. Цинк, Кадмій, Меркурій
Завантажити презентаціюПрезентація по слайдам:
Загальна характеристика d-елементів. Типи хімічних реакцій за їх участю. d-Елементи IВ групи. Купрум, Арґентум, Аурум. d-Елементи IІВ групи. Цинк, Кадмій, Меркурій Загальна характеристика d-елементів, порівняльна характеристика елементів головних і побічних підгруп. Характерні особливості d-елементів: ступені окиснення, утворення комплексів, забарвлення катіонних та аніонних комплексів, участь в ОВР. Зміна кислотно-основних та окисно-відновних властивостей сполук зі зміною ступеня окиснення. Вторинна періодичність у родинах d-елементів, лантаноїдне стиснення. Лантаноїди та актиноїди як аналоги d-елементів IIIB групи. Причини подібності f-елементів, валентні електрони. Поняття біогенні мікроелементи, їх вміст в організмі. Загальна характеристика елементів IВ групи. Фізичні і хімічні властивості простих речовин. Реакції з кислотами, киснем, галогенами. Сполуки Купруму(І) і Купруму(ІІ), їхні кислотно-основні та окисно-відновні властивості, здатність до комплексоутворення. Комплексні сполуки Купруму(ІІ) з амоніаком, амінокислотами, багатоатомними спиртами. Оксид і галогеніди Купруму(І). Комплексні сполуки Купруму(І) з хлоридами й амоніаком, природа забарвлення. Комплексний характер купрумвмісних ферментів, їх біологічна роль. Хімічні основи застосування сполук Купруму в медицині та фармації. Сполуки Арґентуму, їхні кислотно-основні та окисно-відновні властивості. Здатність до комплексоутворення, комплексні сполуки з галогенід-йонами, амоніаком, тіосульфат-іонами. Бактерицидні властивості йонів Ag+. Хімічні основи застосування сполук Арґентуму як лікарських засобів і в фармацевтичному аналізі. Аурум. Окиснення золота киснем за наявності ціанід-іонів. Відношення золота до «царської води» та селенатної кислоти. Сполуки Ауруму(І) і Ауруму(ІІІ), їх кислотно-основні та окисно-відновні характеристики, здатність до комплексоутворення. Застосування золота та сполук Ауруму у медицині й фармації. Загальна характеристика елементів ІІВ групи. Фізичні і хімічні властивості простих речовин. Цинк. Загальна характеристика. Хімічна активність простої речовини. Кислотно-основна та окисно-відновна характеристика сполук Цинку. Солі Цинку, їх розчинність і гідроліз. Комплексні сполуки Цинку з аміаком, водою та гідроксид-іонами. Цинковмісні ферменти. Хімічні основи застосування сполук Цинку в медицині та фармації. Кадмій та його сполуки в порівнянні з аналогічними сполуками Цинку. Меркурій. Загальна характеристика; властивості, відмінні від Цинку та Кадмію: хімічна активність простої речовини, ковалентність зв’язків з м’якими лігандами, утворення зв’язків між атомами Меркурію. Окиснення ртуті сіркою та нітратною кислотою, взаємодія з ферум(ІІІ) хлоридом. Нітрати меркурію. Гідроліз. Основні солі. Сполуки Меркурію(І) і Меркурію(ІІ), їхня кислотно-основна та окисно-відновна характеристика, здатність до комплексоутворення. Каломель і сулема, їх взаємодія з амоніаком, утворення амідохлориду меркурію. Хімізм токсичної дії сполук Кадмію та Меркурію. Хімічні основи застосування сполук Меркурію в медицині та фармації.
Мідь Cu, срібло Ag і золото Au кожен у своєму періоді є передостанніми d-елементами. Таким чином, в атомах елементів підгрупи міді в (n – 1) d-стані повинні знаходитися по дев’ять електронів. Однак внаслідок стійкості d10-конфігурації енергетично є більш вигідним перехід одного з s-електронів в (n –1) d-стан. Тому Cu, Ag і Au в s-стані зовнішнього стану мають по одному, а в передостанньому по 18 (s2p6d10) електронів. Тому елементи підгрупи міді проявляють не лише ступінь окиснення +1, але й +2 і +3. Для міді найбільш характерний ступінь окиснення +2, для Au +3, для Ag +1. Особлива стійкість ступеня окиснення +1 у срібла пояснюється відносно високою міцністю конфігурації 4d10, так як ця конфігурація утворюється вже в паладію, який є попередником срібла в періодичній системі. С.о. Електронна конфігурація КЧ Просторова конфігурація Приклади сполук +1 d10 2 3 4 6 Лінійна Плоска трикутна Тетраедична Октаедрична Cu2O, Ag2O, AgCH, [Ag(CH)2],-AgSCN, AuI, [Ag(9NH3)2]+ K[Cu(CN)2] CuHal, [Cu(CN)4]3-, [Ag(SCN)4]3- AgHal +2 d9 4 6 Квадратна Деформована Октаедрична CuO, CuCl2 CuCl2 2H2O, [Cu(NH3)4(OH2)2]2+ (NH4)2[CuCl4] +3 d8 4 Квадратна AauHal3, [Au(Hal)4]-, Cs[CuCl4], KCuO2
Способи добування елементів І В групи Добування міді 1) збагачення руд методом флотації (Н-д у халькопіриті міститься близько 1-2% міді, а після збагачення до12%). 2) пірометалургійний метод добування міді з сульфідних руд ґрунтується на окисленні Cu2S до CuO: Cu2S+2O2 →2CuO+SO2, який далі відновлюється до Cu2O і реагує з надлишком сульфіду міді: 2Сu2O+Cu2S → 6Cu+SO2 Добування золота 1) Вимивають з пустої породи 2) Розчиняють у ртуті 3) Ціанідний метод: для виділення самородного золота від порожньої породи застосовують промивання водою, розчинення Au в рідкій ртуті з наступним випаровуванням і розгонкою амальгами. Кращим методом виділення золота є ціанідний метод. Цей метод базується на розчиненні золота в розчині NaCN за рахунок окиснення киснем повітря і переходу в аніонний комплекс Na[Au(CN)2] з наступним виділенням його з ціаноурату (I) цинком: 4Au+8NaCN+O2+H2O → 4Na[Au(CN)2]+4NaOH 2Na[Au(CN)2]+Zn → Na2[Zn(CN)4]+2Au Добування срібла Пірометалургійна переробка руд кольорових металів
Хімічна активність міді та її аналогів невелика і зменшується із зростанням порядкового номера елемента. Метали легко реагують з галогенами (Cu при звичайній температурі, Ag і Au при нагріванні) з утворенням CuCl, CuCl2, AuCl3. З киснем безпосередньо реагує тільки мідь: при температурі червоного розжарення утворюється оксид Cu(II) CuO, а при більш високій температурі Cu (I) Cu2O; з сіркою безпосередньо взаємодіють Cu і Ag з утворенням Cu2S, Ag2S; Внаслідок окиснення мідь на повітрі покривається щільною зелено-сірою плівкою основного карбонату. При наявності в повітрі сірководню срібло покривається чорним Ag2S. З воднем мідь і її аналоги не реагують. 7) Оскільки Cu, Ag, Au розміщені в ряді напруг після водню, кислоти можуть окиснювати їх лише за рахунок аніону: Cu і Ag розчиняються в нітратній кислоті і концетрованій сульфатній кислоті, золото – в гарячій концентрованій селеновій кислоті. Кращим розчинником для золота є насичений хлором розчин соляної кислоти і царська голілка. В обидвох випадках взаємодія відбувається за рахунок окисення золота атомарним хлором і утворення аніонного комплексу: Au + HNO3 + 4HCl H[AuCl4] + NO + 2H2O Au + 3Cl + HCl = H[AuCl4] 8) У відсутності окиснювачів Cu, Ag і Au стійкі до дії лугів; 9) Мідь та її аналоги в розчинах основних ціанідів в присутності кисню, наприклад: 4Au + O2 + 8KCN + 2H2O = 4K[Au(CN)2] + 4KOH 10) Мідь, крім того, в присутності кисню розчиняється в водних розчинах аміаку: 4Cu + O2 + 8NH3 + 2H2O = 4[Cu(NH3)2]+ + 4OH-
Схеми деяких реакцій Аргентуму та Ауруму Ag AgNO3 Na[Ag(CN)2] Ag2S AgF2, AgCl, AgBr, AgI сплави AgP2, AgP3 Ag2SO4 H[AgCl2] не реагує сплави Na[Au(CN)2] не реагує H[AuCl2] не реагує AuP3 AuF3, AuCl, AuBr, AuI HNO3+HCl HNO3+HCl H2SO4, t>160º H2SO4, t>160º P, t P, t Me, t Me, t Hal2, t Hal2, t NaCN,O2 NaCN,O2 S, t S, t HNO3, t>160º HNO3, t>160º
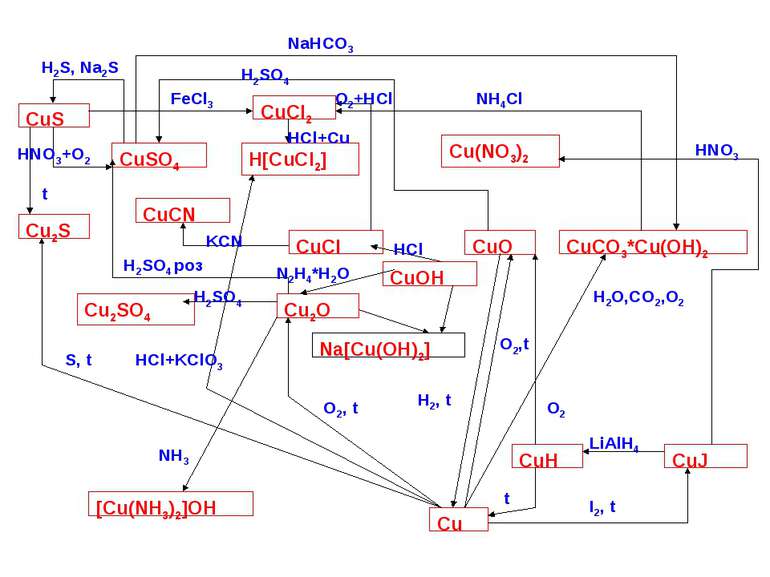
Cполуки елементів підгрупи міді із ступенями окиснення +1. (Cu(I), Ag(I), Au(I)). Міді та її аналогам в ступені окиснення +1 відповідає електронна конфігурація d10. Для міді (I) і її аналогів найбільш характерні КЧ 2, 4, а для Ag(I) – також 6. Бінарні сполуки Cu(I), Ag(I), Au(I) – тверді кристалічні солеподібні речовини, в більшості нерозчинні у воді. Похідні Ag(I) утворюються при безпосередній взаємодії простих речовин, а Cu(I) і Au(I) – при відновленні відповідних сполук Cu(II) і Au(III). З солей кисневмісних кислот і E(I) відносно більш стійкі похідні срібла (розчинні у воді AgNO3, AgClO4, AgClO3, погано розчинні Ag2SO4, Ag2CO3 та ін.). Для E(I) аквакомплекси малостійкі і кристалогідрати нехарактерні, але для Cu(I) і Ag(I) стійкі амінокомплекси типу [E(NH3)2]+. Тому більшість сполук Cu(I) і Ag(I) достатньо легко розчиняються в присутності аміаку, наприклад: CuCl(т) + 2NH3(P) = [Cu(NH3)2]Cl(P); Ag2O(T) + 4NH3(P) + H2O(P) = 2[Ag(NH3)2](OH)(P). Гідроксиди Е(ОН) є нестійкими. При спробах їх отримання за обмінними реакціями виділяються оксиди Cu2O (червоний), Ag2O (темно-коричневий), наприклад: 2AgNO3(p) + 2NaOH(p) = Ag2O(T) +2NaNO3(P) + H2O. Кислотна природа бінарних сполук Е(І) проявляється при взаємодії з основними сполуками. При цьому утворюються різноманітні купрати (І), аргенати (І) і аурати (І). Так, Е2О дещо розчинні в концентрованих розчинах лугів: Cu2O(T) + 2NaOH(P) + H2O(P) = 2Na[Cu(OH)2](P).
Нерозчинні у воді і кислотах галіди EHal достатньо значно розчиняються в концентрованих розчинах галогеноводневих кислот або основних галідів: CuCl(T) + HCl(P) = H[CuCl2](P); AgI(T) + KI(P) = K[AgI2](P). Аналогічними властивостями характеризуються нерозчинні у воді ціаніди ЕСN, сульфіди E2S та ін. Особливе значення має реакція розчинення галідів срібла в розчинах тіосульфату натрію AgBr(T) + 2Na2S2O3(P) = Na3[Ag(S2O3)2](P) + NaBr(P) Ця реакція має місце при закріпленні фотоматеріалів гіпосульфітом (тіосульфатом натрію). Більшість сполук міді (І), золота (І) легко окиснюється (навіть молекулярним киснем повітря), переходячи в стійкі похідні відповідно Cu(II) і Au(III), наприклад: 4CuCl(T) + O2(T) + 4HCl(P) = 4CuCl2(P) + 2H2O(P) Для сполук Cu(I) і Au(I) характерні також реакції диспропорціонування: 2CuCl(T) Cu(T) + CuCl2(P); 3AuCl(T) + KCl(P) = K[AuCl4](P) + 2Au(T). Більшість сполук Е(I) при незначному нагріванні і при дії світла легко розпадаються. Тому за звичай, їх зберігають в темних склянках. Значення Світлочутливість галідів срібла використовується для виготовлення світочутливих емуьсій. Важливе значення має AgNO3, з якого отримують всі інші похідні срібла. Оксид міді(I) застосовують для забарвлення скла, емалей та у техніці.
Сполуки Cu(II). Ступінь окиснення +2 характерна тільки для міді. Максимальне КЧ Cu(II) рівне шести, зустрічаються найчастіше комплексні сполуки міді з КЧ = 4 і 6. Для міді (II) характерні як катіонні, так і аніонні комплекси. Так, при розчиненні солей Cu(II) у воді або при взаємодії CuO (чорного кольору) з кислотами утворюються голубі аквакомплекси [Cu(H2O)6]2+. Таке ж забарвлення мають більшість кристалогідратів, наприклад Cu(NO3)2 6H2O. У мідному купоросі CuSO4 5H2O навколо Cu(II) координовані чотири молекули води в площині і дві SO2-4 – групи по осі. П’ята молекула води відіграє роль містка, який об’єднує водневими зв’зками молекули води в площині і SO2-4 – групу. Оксид міді (II) CuO (чорний) і гідроксид міді(II) Cu(OH)2 (голубий) – амфотерні сполуки. Гідроксид і оксид – нерозчинні сполуки. Cu(OH)2 –драглистий осад, який отримують при дії лугу на розчини солей міді (II). Він розчиняється крім кислот, ще й у концентрованих лугах, краще при нагріванні, з утворенням гідроксокупратів (I) синього кольору: Cu(OH)2 + 2NaOH = Na2[Cu(OH)4]. Відомі гідроксокупрати Sr2[Cu(OH)6], Ba2[Cu(OH)6]. Гідроліз солей Cu(II) часто супроводжується утворенням малорозчинних у воді основних солей складу Cu(NO3)2 3Cu(OH)2, CuSO4 2Cu(OH)2, CuCl2 3Cu(OH)2. Їх можна розглядати як похідні нових катіонних комплексів. Більшість з цих сполук зустрічається у вигляді мінералів.
З інших катіонних комплексів міді(III) дуже характерні комплекси з азотвміщуючими лігандами, наприклад [Cu(NH3)4(OH2)2]2+ і хелатний [Cu(en)2(OH2)2]2+. Утворенням аміакатів, зокрема, пояснюється розчинення Cu(OH)2 у водних розчинах аміаку: Cu(OH)2(T) + 4NH3(p) + 2H2O = [Cu(NH3)4(H2O)2](OH)2(p). Зміна в аквакомплексі [Cu(H2O)6]2+ молекул води на азотвмісні ліганди приводить до появи більш інтенсивного синього забарвлення: [Cu(H2O)6]2+, [Cu(NH3)4(H2O)2]2+, [Cu(en)2(H2O)2]2+ голубий синій інтенсивно синій Сполуки Cu(II) в загальному стійкіші, ніж однотипні похідні Cu(I). - Сu(OH)2 розкладається на CuO і H2O лише при нагріванні; розклад CuF2 і CuCl2 на CuHal і Hal2 починається відповідно при 950 і 5000. CuI2 розкладається вже при звичайних температурах, переходячи в CuI. Тому при спробах отримання CuI2 по обмінній реакції проходить окиснювально-відновна реакція 2Сu2+(p) + 4I-(p) = 2CuI(т) + I2(т). - Аналогічно нестійкі ціанід та тіоціанат міді(II): 2CuSO4(p) + 4KCN(p) = 2CuCN(T) + (CN)2(Г) + 2K2SO4(p). Для Cu(II) характерні також аніонні комплекси – купрати(II). Так, Cu(OH)2 при нагріванні в концентрованих розчинах лугів частково розчиняється, утворюючи сині гідроксокупрати(II) типу M2[Cu(OH)4]. Деякі з них виділені у вільному стані. В надлишку основних галідів CuHal2 утворюють галогенокупрати (II) типу M[CuHal3] і M2[CuHal4]. З похідних срібла(II) більш або менш стійкі AgF2 і деякі комплексні сполуки з органічними лігандами. Сполуки золота (II) невідомі.
Сполуки Cu(III), Ag(III), Au(III). Ступінь окиснення +3 найбільш характерна для золота. (d8) З бінарних сполук Au(III) відомі: Au2O3, AuF3, AuBr3, AuCl3, Au2S3, Au(OH)3. У розчинні лише AuCl3 і AuBr3. Одержання: 2000С. Au+Cl2 AuCl3 Галіди, оксид і гідроксид Au(III) – амфотерні сполуки з домінуванням кислотних ознак. Так, Au(OH)3 легко розчиняється в лугах, утворюючи гідроксоурати (III) : NaOH+Au(OH)3=Na[Au(OH)4]. Навіть розчинення в кислотах гідроксиду золота (III) відбувається з утв. аніонних комплексів: Au(OH)3+4HNO3= H[Au(NO3)4+3H2O. Нітрато- і ціаноурати(III) водню виділені у вільному стані. В присутності солей лужних металів утворюються нітрато-M[Au(NO3)]4, cульфато- M[Au(SO4)2], ціано- M[Au(CN)4], сульфідо- M[AuS2] та іншого типу урати(III). Кислотна природа галідів Au(III) проявляється в їх здатності утворювати галогеноурати(III) M[AuHal]. Особлива схильність Au(III) до утворення аніонних комплексів проявляється і при гідролізі його тригалідів: AuCl3 + H2O H[Au(OH)Cl3]; AuCl3 + H2O H2[AuOCl3]. Кислота, що утворилася в результаті гідролізу хлориду золота (III) H2[AuOCl3] з іонами Ag+ дає важкорозчинну сіль Ag2[AuOCl3] , а не хлорид срібла (I) AgCl. Отже, це вказує на велику стійкість аніонного комплексу [AuOCl3]2-. Для Cu(III), Ag(IIІ) відомі фторопохідні: синій K2[CuF6] і жовтий K[AgF4]. При окисненні Cu(OH)2 в лужному середовищі отримують гіроксо- і оксокупрати (ІІІ)типу KCuO2 і K[Cu(OH)4]: 2Cu(OH)2+ NaCl + 2NaOH = 2NaCuO2 + NaCl + 3H2O Ступінь окиснення +3 в міді і срібла стабілізується в комплексних йодатах (VII) і теллуратах (VI), наприклад K7[Cu(IO6)2] 7H2O, Na9[Cu(TeO6)2] (коричневого кольору) і K6H[Ag(IO6)2] 10H2O, Na6H3[Ag(TeO6)2] 20H2O (жовтого).
Характерні реакції іонів Cu2+ Водний розчин аміаку, доданий у надлишку, утворює з іонами Cu2+ комплексну сполуку інтенсивно-синього кольору: Cu2+ +4NH3 = [Cu(NH3)4]2+. Калій гексаціаноферат (II) K4[Fe(CN)6] при pH 7 утворює коричнево-червоний осад Cu2[Fe(CN)6]: 2Cu2+ + [Fe(CN)6]4– = Cu2[Fe(CN)6] . Осад розчинний у водному розчині NH3 і нерозчинний у розведених кислотах; розкладається лугами, у результаті чого утворюється блакитний осад Купрум гідроксиду. Реакції заважають іони Fe3+. Натрій тіосульфат Na2S2O3 з іонами Cu2+ у кислому середовищі при нагріванні утворює чорний осад Cu2S: 2Сu2+ + 3S2O32– + H2O = Cu2S + S4O62– + SO42– + 2H+. Реакції заважають іони Hg2+.
Характерні реакції іонів Ag+ Хлоридна кислота (фармакопейна реакція) утворює з іонами Ag+ білий осад AgCl: Ag+ + Cl– = AgCl . Аргентум хлорид під впливом світла розкладається і при цьому виділяється дрібнодисперсне металічне срібло й осад чорніє. Концентрована HCl не повністю осаджує іон Ag+, тому що утворює з ним розчинний комплексний іон [AgCl2]–: AgCl + Cl– = [AgCl2]–. Аргентум хлорид розчиняється у водному розчині аміаку і знову випадає в осад, якщо підкислювати цей розчин нітратною кислотою: AgCl + 2NH3 = [Ag(NH3)2]Cl; [Ag(NH3)2]Cl + 2HNO3 = AgCl + 2NH4NO3. За цією реакцією можна виявляти іони Аргентуму у складній суміші катіонів. Реакцію осадження Аргентум хлориду виконують у кислих розчинах при pH 7; при pH 7 утворюється Ag2O. Реакції заважають іони Hg22+, Pb2+ та ін. Калій бромід та йодид утворюють з іонами Ag+ блідо-жовтий та жовтий осад AgI: Ag+ + I– = AgI . На відміну від Аргентум хлориду, бромід частково розчиняється, а Аргентум йодид не розчиняється у водному розчині аміаку. Аргентум бромід та йодид розчиняється у KCN і Na2S2O3, оскільки комплекси [Ag(CN)2]- і [Ag(S2O3)2]3- менш дисоційовані, ніж [Ag(NH3)2]+. Калій хромат K2CrO4 утворює з іонами Ag+ осад коричнево-червоного кольору: 2Ag++CrO42-=Ag2CrO4 . Осад розчиняється в кислотах та амоній гідроксиді.
Способи добуваня елементів ІI В групи Добування цинку та кадмію Пірометалургійне добування металічного цинку та кадмію відбувається у дві стадії:спочатку випалюванням на повітрі переводять сульфіди в оксиди, які потім відновлюють вуглецем 2ZnS+3O2 →2ZnO+2SO2, ZnO+C → Zn+CO Добування ртуті Добування металічної ртуті з кіноварі відбувається в одну стадію, оскільки оксид ртуті (ІІ) при високих температурах нестійкий HgS + O2 → Hg + SO2
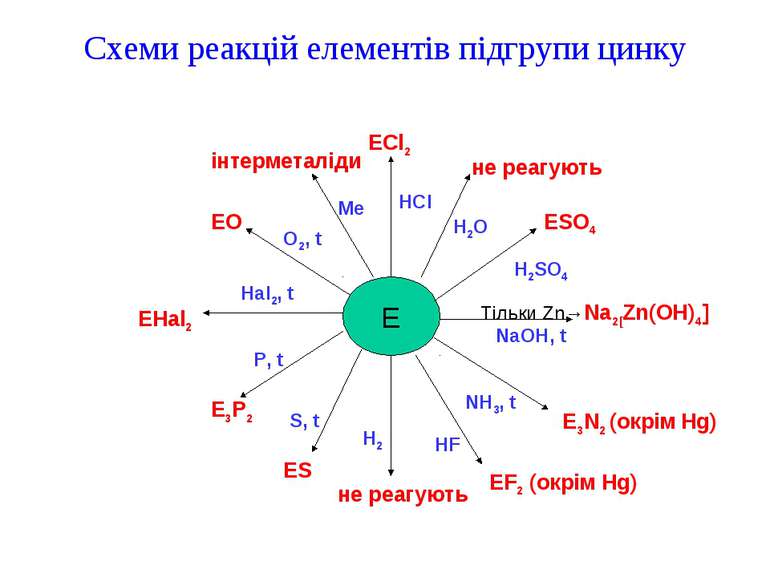
Для елементів підгрупи цинку характерною є d10-електронна конфігурація. Фізичні властивості: для елементів головної і побічної підгруп другої групи є також порівняно низькі низькі температури плавлення і відносно добра леткість. Серед металів, ртуть має найнижчу температуру плавлення. На відміну від елементів головної підгрупи другої групи метали побічної підгрупи цієї ж групи є важкими металами. Тут вони є дуже близькі до елементів побічної підгрупи. Zn, Cd і Hg – сріблясто-білі метали, у вологій атмосфері покриваються плівками оксидів і втрачають блиск. В ряду Zn – Cd – Hg хімічна активність зменшуєьться. Хімічні властивості: електрохімічна природа в ряду Zn – Cd – Hg змінюється так само, як і в ряду Cu – Ag – Au, тобто в зворотньому порядку, порівняно з головною підгрупою. В електрохімічному ряді напруг цинк і кадмій стоять лівіше водню, а ртуть правіше. За своєю природою ртуть близька до благородних металів. Хоча вона й утворює окис HgO, але він нестійкий і при легкому нагріванні розкладається з виділенням вільного металу.
Прості речовини. Цинк – активний метал, який легко розчиняється в кислотах, а при нагріванні в лугах: Zn + 2H3O+ + 2H2O = H2 + [Zn(H2O)4]2+; Zn + 2H2O + 2OH- = H2 + [Zn(OH)4]2-. Кадмій в лугах практично не розчиняється, а в кислотах – розчиняється менш енергійно, ніж цинк; ртуть розчиняється тільки в кислотах, які є окиснювачами за рахунок своїх аніонів. При цьому можуть утворюватися, як похідні Hg(II), так і похідні Hg(I). Наприклад, при дії на Hg концентрованою HNO3 утворюється нітрат ртуті(II): Hg + 4HNO3 = Hg(NO3)2 + 2NO2 + 2H2O. При дії на надлишок Hg розведеної HNO3 отримують Hg2(NO3)2: 6Hg +8HNO3 = 3Hg2(NO3)2 + 2NO + 4H2O. Цинк і кадмій по відношенню до HNO3 і концентрованої H2SO4 поводять себе значно активніше. Цинк, наприклад, дуже розведену азотну кислоту відновлює до іону амонію: 4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O. При нагріванні цинк і його аналоги достатьо енергійно взаємодіють з активними неметалами: 2Zn + O2 = 2ZnO; Zn +Cl2 = ZnCl2; Zn + S = ZnS; 3Zn + 2P = Zn3P2; Hg + S = HgS; 2Hg + O2 = 2HgO; Hg + Cl2 = HgCl2; Hg + I2 = HgI2. Ртуть з багатьма металами утворює сплави, які називаються амальгамами. Вони частіше є рідкими або тістоподібними.
Схеми реакцій елементів підгрупи цинку E ECl2 не реагують ESO4 Тільки Zn→Na2[Zn(OH)4] E3N2 (окрім Hg) EF2 (окрім Hg) не реагують ES E3P2 EHal2 EO інтерметаліди P, t Hal2, t O2, t Me HCl H2O H2SO4 NaOH, t NH3, t HF H2 S, t
Сполуки елементів підгрупи цинку із с.о. +2 Zn(II), Cd(II), Hg(II). Для Zn(II) найбільш характерне координаційне число 4, а для кадмію(II) КЧ = 6. Для ртуті (II) приблизно однаково характерні координаційні числа 2, 4, 6. Просторова конфігурація комплексів елементів підгрупи цинку Стійкість бінарних сполук в підгрупі цинку із збільшенням порядкового номера елемента зменшується. Особливо істотно стійкість сполук зменшується при переході від Cd до Hg. Наприклад, Zn(OH)2 і Cd(OH)2 стійкі, а гідроксид Hg(II) невідомий, так як розкладається при отриманні: Hg(NO3)2 + 2KOH = HgO + 2KNO3 + H2O. КЧ Просторова конфігурація Приклади сполук 4 Тетраедр K2[Zn(OH)4], [Zn(OH2)4]SO4, [Zn(NH3)4]Cl2, [Zn(NH3)2Cl2];ZnO, ZnS, CdS, HgS, ZnCl2. 6 Октаедр [Cd(NH3)6](NO3)2, CdO, [Cd(NH3)2Cl2], CdBr2, CdCl2. 2 Лінійна HgNH2Cl, HgO, Hg(CN)2
Для ртуті (II) невідомий і карбонат. Температури розкладу ZnO і CdO відповідно 1950 і 18130С, а HgO розкладається на прості речовини при 4000С; малостійкими є також Hg3N2 і HgC2, які розкладаюься з вибухом. 2HgO 2Hg + O2 Hg3N2 3Hg + N2; HgC2 Hg + 2C З сполук цинку і його аналогів у воді розчиняються галогеніди (крім ZnF2, HgBr2 HgI2), сульфати, нітрати і деякі ще. Численні сполуки розчиняються в органічних розчинниках. При розчиненні сполук E(II) у воді, а також при взаємодії EO чи E(OH)2 з кислотами утворюються стійкі аквакомплекси типу [E(OH2)4]2+ і [E(OH2)6]2+. Тому для Zn(II), Cd(II) і Hg(II) характерні кристалогідрати, наприклад Zn(NO3)2 6H2O, ZnSO4 7H2O, Zn(BrO3)2 6H2O, Cd(NO3)2 4H2O, Hg(NO3)2 2H2O, Hg(ClO4)2 6H2O. З інших катіонних комплексів найбільш стійкі амінокомплекси типу [E(NH3)4]2+ і [E(NH3)6]2+, які дуже легко утворюються при дії аміаку на розчини солей: ZnSO4 + 4NH3 = [Zn(NH3)4]SO4. Утворенням аміакатів пояснюється легка розчинність E(OH)2 в присутності аміаку: Cd(OH)2 + 6NH3 = [Cd(NH3)6](OH)2. Аміакати ртуті (II), наприклад [Hg(NH3)4](NO3)2 утворюються лише при великому надлишку аміаку і в присутності солей амонію. Взаємодія HgCl2 з аміаком в концентрованому розчині хлориду амонію приводить до випадання осаду [Hg(NH3)2Cl2]: HgCl2 + 2NH3 = [Hg(NH3)2Cl2] . білий плавкий преципітат
У розведених розчинах утворюється нерозчинна у воді сполука – амідне похідне HgNH2Cl2: HgCl2 + 2NH3 = HgNH2Cl + NH4Cl; неплавкий білий преципітат 6HgNH2Cl N2 + 4NH3 + 3Hg2Cl2 (з вибухом) Цинк і його аналоги утворюють різного типу цинкати, кадмати і гідраргірати. Так, Zn(OH)2, легко розчиняється в лугах за рахунок утворення розчинних гідроксоцинкатів: Zn(OH)2 + 2KOH = K2[Zn(OH)4]. Амфотерну природу Zn(OH)2 і його поведінку в кислих і лужних розчинах можна зобразити схемою: [Zn(OH2)4]2+ Zn(OH)2 [Zn(OH)4]2- Аналогічно поводиться в рідкому аміаку амід (дигідронітрид) цинку Zn(NH2)2. Як гідроксид цинку не розчиняється у воді, так і амід не розчиняється в аміаку, але легко розчиняєьтся в присутності аммонокислот і аммонооснов: [Zn(NH3)4]2+ Zn(NH2)2 [Zn(NH2)4]2- При надлишку іонів амонію утворюються аміакати, при надлишку іонів NH2- – дигідридонітридоцинкати (аміноцинкати). Гідроксид кадмію амфотерні властивості проявляє істотно менше, ніж гідроксид цинку. При довгому кип’ятінні завису Cd(OH)2 в концентрованих лугах утворюються гідроксокадмати: K4[Cd(OH)6], Ba2[Cd(OH)6]. У воді вони легко руйнуються і стійкі лише в концентрованих лугах. Гідроксогідраргірати відносно стійкі не виділені.
Найбільш міцні комплекси з -акцепторними лігандами CN- - типу [E(CN)4]2-. Ці комплексні сполуки легко утворюються при дії на розчини солей Е(ІІ) основного ціаніду. Осади, що утворюються спочатку Е(CN)2, розчиняються в надлишку основного ціаніду: 2KCN + E(CN)2 = K2[E(CN)4]. Таким чином, якщо комплексні галогеніди Zn(II) по стійкості належать до подвійних солей, то комплекси Hg(II) дуже стійкі і утворюються в розчинах: 2KI + Hg(NO3)2 = HgI2 + 2KNO3; 2KI + HgI2 = K2[HgI4] Таким самим способом можна пояснити схильність сульфіду ртуті розчинятися в розчинах основних сульфідів: K2S + HgS = K2[HgS2]. Відомі численні похідні аніонних комплексів типу M2[E(SCN)4], M2[E(SO3)2], M2[E(NO3)4], які за стійкістю належать до подвійних солей, а також їх кристалогідрати, наприклад M2[E(SO4)2] 6H2O. Солі Zn (II), Hg(II) і Cd(II) у водних розчинах гідролізовані. Для цинку навіть виділені гідроксосолі в твердому стані Zn(OH)Cl, ZnCl2 4Zn(OH)2, ZnBr2 4Zn(OH)2, Zn(NO3)2(OH2)2 4Zn(OH)2. Для Zn і Cd ступ інь окиснення +2 дуже стійка. На відміну їм Hg(II) проявляє окиснювальні властивості: 2Hg2+ + 2e = Hg22+ , E 298 = 0,920 B; Hg2+ + 2e = Hg, E 298 = 0,854 B; наприклад, Hg(NO3)2 + Hg Hg2(NO3)2; HgCl2 + SO2 + 2H2O = Hg + H2SO4 + 2HCl.
Сполуки Hg(І). Для ртуті (І) відомі чорний оксид Hg2O, галіди Hg2Hal2, деякі солі. Більшість похідних ртуті(І) безколірні і важко розчинні у воді. Добре розчиняються Hg2(NO3)2 2H2O, який є вихідною речовиною для отримання інших похідних Hg(I). Сполукам Hg(I) властива окиснювально-відновна двоїстість: Hg2Cl2 + Cl2 = 2HgCl2; Hg2Cl2 + SnCl2 = 2Hg + SnCl4. Сполукам Hg (І) властива схильність до диспропорціонування з виділенням вільної ртуті і утворенням відповідних сполук Hg (ІІ): Hg22+ = Hg + Hg2+ , E 298 = -0,131 B. В окремих випадках розпад відбувається настільки швидко, що похідні Hg2+ не вдається отримати. Наприклад, за обмінними реакціями Hg2S і Hg2(CN)2 не утворюються, так як зразу ж розпадаються на вільну ртуть, нерозчинний HgS і малодисоційований ціанід Hg(CN)2. Більш стійкі Hg2Cl2 і Hg2SO4, які теж можуть розкладатися при невеликому нагріванні або освітленні. При дії на солі ртуті(I) гідроксидів випадає металічна ртуть і оксид ртуті(II): Hg2(NO3)2 + 2KOH = 2KNO3 + HgO + Hg + H2O. Із солей Hg мають значення каломель Hg2Cl2 і сулема HgCl2. Hg2Cl2 + 2NH3 = HgNH2Cl + NH2Cl + Hg ; HgCl2 + 2NH3 = HgNH2Cl + NH4Cl. Похідні ртуті та сам метал – надзвичайно отруйні.
Біологічна роль та використання в медицині сполук міді, срібла, золота, цинку, кадмію та ртуті Мідь належить до життєво необхідних мікроелементів та відіграє важливу біологічну роль в усіх процесах, які протікають в організмі в організмі людини. Загальна масова частка міді в органах та тканинах людини складає 1 10-4 . Як правило, в жіночому організмі міді більше, ніж у чоловічому. У дитячому організмі міді міститься в три рази більше, ніж у дорослому, що визначається більшою інтенсивністю процесу метаболізму. Найбільший вміст міді зосереджений у жовчному міхурі та печінці. Мідь специфічно діє на синтез гемоглобіну та утворення еритроцитів. Солі міді позитивно впливають на ріст та розвиток оганізму, приймаючи участь в білковому обміні. Добова потреба міді – 2 мг, вона з надлишком перекривається, якщо в раціоні харчування людини є теляча печінка, хліб грубого помолу, насіння стручкових рослин. Велика кількість міді міститься в дріжджах. В організмі людини мідь утворює комплексні сполуки з біологічно активними субстратами – амінокислотами та білками, сприяючи процесам кровотворення, хребетоутворення, розумовому та фізичному розвитку. Комплекси міді з багатьма лікарськими препаратами підвищують їх фармаологічну активність. Ундециленат міді – мазь “Ундецин” (бактерицидна дія). CuSO4 – 0,25 р-н в очній та урологічній практиці (антисептичний, в’яжучий або припікаючий засіб).
Біологічна роль срібла мало вивчена. Залежно від концентрації срібло здійснює в’жучу, припікальну, протизапальну та бактерицидну дію. AgNO3 –1-2 р-н при захворюваннях очей, шкіри (антисептичний зовнішній засіб). Коларгол (колоїдне срібло) і протаргол (комплекс білка з Ag) використовують для промивання сечовивідних шляхів, в очній практиці та дерматології, як в’яжучі та антисептичні засоби. Ag+ - знезараження питної води. Існує розділ медицини, який вивчає методи лікування препаратами золота – хризотерапія. Золото виявляє цілющі властивості при лікуванні прокази. Пізніше було встановлено, що ціаніди золота зменшують ріст туберкульозних паличок та інших патогенних організмів. У зв’язку з тим, що сполуки Au(III) є сильними окисниками, їх не використовують у сучасній хризотерапії. Похідні Au(I) нестійкі у водних розчинах. Для їх стабілізації використовують комплекси, які містять сірковмісні та фосфоровмісні ліганди. Так, препарат кризаніл (Au – S – CH2 – CH –CH2SO3)2 OH Cd застосовують для лікування кісткового туберкульозу (в/м). Фосфоровмісні препарати Au менш токсичні, ніж тіолові комплекси золота(I). Вони виявилися активними протиартритними засобами. Препарати Au накопичуються в нирках і печінці, тому хризотерапія протипоказана при наявності функціональних захворювань цих органів.
Цинк належить до незамінних мікроелементів в організмі людини. Його Wзаг.cкладає 1 10-3 . Добова потреба цинку 10-15 мг. В організм людини сполуки цинку потрапляють як з рослинною, так із тваринною їжею. Біологічна роль цинку пов’зана з діяльністю залоз внутрішньої секреції. Як складова частина деяких ферментів цинк впливає на процеси розмноження, жирового та вуглецевого обмінів. При недостачі цинку в організмі виявляються досить серйозні ураження – цироз печінки та ураження шкіри і очей. Zn входить до складу ферменту, що забезпечує процеси дихання та газообміну, а також до складу гормона інсуліну, який регулює вміст цукру в крові. ZnSO4 – 0,25 , 0,3 -очні краплі. ZnO, ундециленат цинку – мазі дерматологічні (“Цинкундан”). Ртуть і її сполуки застосовуються в медичній практиці ще з XVI сторіччя. Її сполуки виявляють антисептичну, протипаразитарну, сечогінну і послаблюючу дію. HgO – в офтальмології, дерматології (мазі); HgSO4, Hg3(PO4)2; ртутно- кварцеві лампи; HgCl2 (сулема) – для дезинфекції. Hg2Cl2 (каломель) – застосовувалась як сечогінний та послаблюючий заіб. Ртуть та її сполуки (органічні солі ртуті) дуже токсичні.
Схожі презентації
Категорії







![Схеми деяких реакцій Аргентуму та Ауруму Ag AgNO3 Na[Ag(CN)2] Ag2S AgF2, AgCl... Схеми деяких реакцій Аргентуму та Ауруму Ag AgNO3 Na[Ag(CN)2] Ag2S AgF2, AgCl...](https://svitppt.com.ua/images/6/5508/770/img6.jpg)
















![Найбільш міцні комплекси з -акцепторними лігандами CN- - типу [E(CN)4]2-. Ці ... Найбільш міцні комплекси з -акцепторними лігандами CN- - типу [E(CN)4]2-. Ці ...](https://svitppt.com.ua/images/6/5508/770/img25.jpg)










![Схеми деяких реакцій Аргентуму та Ауруму Ag AgNO3 Na[Ag(CN)2] Ag2S AgF2, AgCl... Схеми деяких реакцій Аргентуму та Ауруму Ag AgNO3 Na[Ag(CN)2] Ag2S AgF2, AgCl...](https://svitppt.com.ua/images/6/5508/210/img6.jpg)
















![Найбільш міцні комплекси з -акцепторними лігандами CN- - типу [E(CN)4]2-. Ці ... Найбільш міцні комплекси з -акцепторними лігандами CN- - типу [E(CN)4]2-. Ці ...](https://svitppt.com.ua/images/6/5508/210/img25.jpg)


























