Презентація на тему:
Загальні відомості про біогенні елементи. Комплексоутворення в біологічних системах.
Завантажити презентацію
Загальні відомості про біогенні елементи. Комплексоутворення в біологічних системах.
Завантажити презентаціюПрезентація по слайдам:
Загальні відомості про біогенні елементи. Комплексоутворення в біологічних системах. Лекція 2 доц. Є.Б. Дмухальська
В тілі людини і вищих тварин виявлено біля 70 хімічних елементів, що надходять в організм разом з водою і їжею, з них 47 елементи є постійно, тому вини називаються біогенними. Шість елементів: карбон, гідроген, оксиген, нітроген, фосфор, сульфур; входять в склад амінокислот, основних компонентів білка, і називаються органогенними. 94 % усіх живих тканин містять тільки 4 елементи: карбон, гідроген, оксиген, нітроген.
Залежно від кількісного вмісту всі біоелементи В.І. Вернацький розділив на макро-, мікро- і ультрамікроелементами. До макроелементів відносять елементи, вміст яких в організмі становить 0,01 % і більше маси тіла. Це натрій, калій, кальцій, фосфор, хлор, сульфур, магній. До мікроелементів – 10-3–10-5 %. Це йод, бром, фтор, залізо, купрум, алюміній, манган, кобальт, цинк, стронцій, літій, селен, молібден. Ультрамікроелементи –
Натрій Якісна реакція: іони натрію забарвлюють полум'я в жовтий колір. З цинкуранілацетатом утворює сполуку натрій цинкуранілацетатом жовтого кольору: NaCl + Zn(UO2)3(CH3COO)8 + CH3COOH + 9H2O = HCl + NaZn(UO2)3(CH3COO)9. 9H2O Солі натрію в організмі знаходяться переважно в розчинному стані в плазмі крові, в лімфі, в лікворі, в травних соках. В клітинах натрію значно менше, тому він зосереджується в позаклітинних зонах. Натрій відіграє важливу роль у затриманні води в організмі. Підраховано, що 1 г натрію може затримати до 25 г води. У зв'язку з тим, що іони натрію в рідинах і міжклітинних зонах найбільше, йому належить важлива роль у перерозподілі води між клітинами i рідинами організму, а також в регуляції обміну води в цілому. Натрій хлорид є основним матеріалом, з якого утворюється соляна кислота. Ця соль відіграє найбільшу роль в осмотичних процесах. Іони натрію також необхідні для нормальної збудливості м'язів.
Калій Якісні реакції: іони калію забарвлюють полум'я в фіолетовий колір, який швидко зникає. З натрію свинцю гексанітрокупрат утворює сполуку калій свинцю гексанітрокупрат чорного кольору: KCl + Na2Pb[Cu(NO2)6] = NaCl + K2Pb[Cu(NO2)6] Солі калію, як і натрію, добре розчинні у воді, вони є у всіх тканинах організму. На відміну від натрію, калій в більших кількостях міститься в клітинах, тому натрій звичайно звуть екстрацелюлярним, а калій iнтpaцелюлярним елементом. Так, наприклад, з 8 — 9 г калію, що є в крові, 95 — 96 % знаходиться в еритроцитах i лише 3 — 5 % у плазмі. Багато калію в травних соках. Іони калію посилюють функції парасимпатичної нервової системи i зменшують збуджуючий вплив натрію на м'язи. Калій посилює дію ацетилхоліну на нервові закінчення в м'язах.
Кальцій Якісна реакція: з оксалатом амонію утворює білий кристалічний осад оксалат кальцію: СаCl2 + NH4C2O4 = СаC2O4 +NH4Cl Основна маса кальцію міститься в кістках у вигляді солей фосфорної кислоти - оксіапатитів [Са10(РО4і6(ОНі2], на якому сорбуються карбонат (6%), цитрат (1%), натрій (0,7%), магній (0,7%), а також у невеликих кількостях фтор.
Оксіапатити в невеликих кількостях також міститься в складі плазми крові. У великій кількості є кальцій в тканинах зубів, особливо в емалі. Невеликі кількості кальцію (10 — 11 мкмоль є в крові у вигляді розчинних солей (СаСl2). Кальцій необхідний для коагуляції крові та функції м'язів. Кальцій заспокоює нервову систему i зменшує проникніст і спазм судин. Кальцієві солі входять до складу фосфоропротеїду — казеїногену молока. Обмін кальцію в організмі в значній мірі пов’язаний з вітамінами групи D, з функцією паращитовидних залоз та обміном вуглеводів
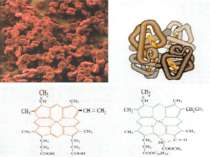
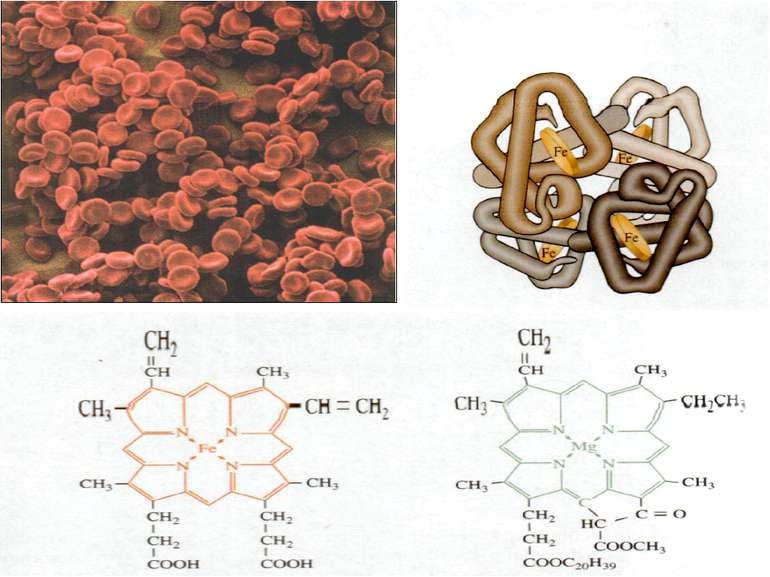
Залізо Якісна реакція: на двохвалентний ферум 3FeSO4 + 2K3[Fe(CN)6] = + Fe3[Fe(CN)6]2 + 3K2SO4 на трьохвалентний ферум 4FeСl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl 4FeСl3+ 3KSCN = Fe(SCN)3 + 3KCl Біологічна роль заліза обумовлена головним чином тим, що воно входить до складу гемоглобіну, міоглобіну та великої групи ферментів тканинного дихання. В організмі людини міститься 3 — 5 г заліза, з яких близько 73 % знаходиться в гемоглобіні, 3 — 5 %- — у міоглобіні, 15 — 16% зв'язано у вигляді залізо-6ілкових комплексів – феритину, що е запасною формою заліза; 0,1% міститься в плазми у вигляді залізовмісного білка сидерофіліну та близько 0,1% входить до складу ферментів.
Магній. У дорослої людини добова потреба в магнію становить 10 мг на 1 кг ваги тіла. У вигляді фосфорної солі магній входить до складу кісткової тканини (близько 1,5 - 1,8% всіх солей). Магній необхідний для дії деяких ферментів: аденозинтрифосфотази м'язів (розщеплює АТФ), ацетилхолінестерази (розщеплює ацетилхолін). Іони магнію необхідні для нормального функціонування великого комплексу ферментів, які каталізують процеси біосинтезу білків. Магній входить до складу системи пропердину, яка складається з білка пропердину, комплементу та солей магнію. Ця система бере участь у захисті організму від різних інфекційних хвороб. Магній сприяє затримці фосфору в організмі. Солі магнію використовуються як засіб гальмування нервової системи, у великих дозах ними можна навіть викликати наркоз. Солі магнію застосовуються також при гіпертонічній хворобі, епілепсії, атеросклерозі, а також як проносной засіб.
Хлор Якісна реакція: з іонами аргентуму утворює білий осад: NaCl + AgNO3 = AgCl +NaNO3 Хлор міститься у вигляді аніону солей натрію, калію, кальцію, магнію та марганцю у всіх рідинах організму людини та тварин. Аніони хлору разом з іонами натрію та калію відіграють основну роль у підтриманні сталості осмотичного тиску плазми крові, лімфи та інших рідин. Більша частина (65 — 70%) всього осмотичного тиску плазми крові забезпечується хлоридами, Вони відіграють важливу роль у підтриманні іонної рівноваги, а отже, i регуляції концентрації водневих іонів. Іонам хлору та хлоридам взагалі належить також важлива роль в утворенні соляної кислоти шлункового соку.
Cірка Сірка в організмі міститься у вигляді органічних i неорганічних сполук. Вона є складовим елементом абсолютної більшості білків, особливо білків покривних тканин (епетелій, нігті, волосся тощо). Вона входить до складу гормонів (інсулін, деякі гормони гіпофіза), ферментів (особливо ферментів тканинного дихання), глютатіону, жовчних кислот (таурин) та ін. Сірка також входить до складу метіоніну, який відіграє велику роль не тільки в обміні білків, але й ліпідів. Сірка бере участь (у вигляді сірчаної кислоти) в знешкодженні різних токсичних продуктів шляхом утворення в печінці парних сполук.
Фосфор Фосфорна кислота утворює в організмі ряд органічних i неорганічних сполук. Вона входить до складу нуклеопротеїдів, фосфопротеїдів, фосфоліпідів. Фосфорна кислота необхідна для обміну вуглеводів (моносахариди окислюються тільки у вигляді фосфорних ефірів), а також в значній мірі білків i ліпідів. Фосфорна кислота є у складі АТФ – найбільш універсальної сполуки, в, якій кумулюється енергія. Солі фосфорної кислоти є основою будови скелета. Значна участь фосфатів i в буферних системах організму. Фосфати натрію та калію є постійними складовими частинами сироватки крові
Йод В організмі людини міститься близько 25 мг йоду, з яких 15 — у щитовидні й залозі. Йод входить до складу гормону щитовидної залози — тироксину. Крім того, в невеликій кількості він завжди е в крові, що необхідно для нормальної функції щитовидної залози. Добова потреба в йоді дорівнює приблизно 100 мікрограмам, або найменше 1 мікрограму на і кг ваги тіла. При недостатності йоду у воді i їжі послаблюється функція щитовидної залози i замість залозистої тканини розростається сполучна тканина, утворюючи досить значні нарости на передній поверхні шиї. В зв'язку з цим i захворювання має назву зобної хвороби.
Мідь Мідь необхідна для процесу утворення крові при нестачі в організмі людини або тварини міді послаблюється утворення гемоглобіну i розвивається анемія. мідь підсилює дію інсуліну i гормонів гіпофіза, які стимулюють розвиток i функцію статевих залоз. Мідь виявлено в еритроцитах та печінці — у вигляді білка гемокупреїну. Крім того, вона утворює комплекси з білками плазми. Мідь входить до складу ферментів: альдолази, каталази. Малі дози міді гальмують розпад глікогену i тим самим сприяють збереженню його в організмі. Солі міді застосовуються в очній, дерматологічній, уролопчній та гінеколопчній клініці.
Цинк Цинк входить до складу інсуліну i подібно марганцю підсилює дію його. Цинк також входить до складу гіпофіза i статевих залоз. Він є складовою частиною ферменту карбоангідрази, що каталізує розщеплення вуглекислоти на Н2О та СО2.
Фтор Фтор у вигляді органічних i неорганічних сполук міститься в багатьох органах нашого тіла. Кальцієва сіль фтору входить до складу кісток (близько 0,3 всіх солей кісткової тканини). Фтор є важлива складова частина зуба. Він також входить у незначних кількостях до сперматозоїдів та інших біологічно важливих клітин. Присутність солей фтору (фтори дів) в кістках значно зменшує розчинність оксіапатитів. Надлишок фторидів теж негативно впливає на організм i може спричинити навіть деформацію скелета та флюороз.
Комплексні сполуки А) Будова CuSO4 + 4 NH3 = [Cu (NH3)4] SO4 [Cu (NH3)4] SO4 комплексна сполука Cu2+ - комплексоутворювач (центральний атом) NH3 – ліганд (адденд) [Cu (NH3)4]2+ - комплексний іон (внутрішня координаційна сфера) SO42- - аніон (зовнішня координаційна сфера)
Комплексоутворювачі: Іони металів: Ag+, Cu2+, Cu+, Co3+, Al3+, Ni2+, Pb2+, Pt4+, Cr3+, Au3+, Fe2+, Fe3+ ... Атоми неметалів з позитивним ступенем окиснення: S+4, S+6, P+3 Ліганди: Іони: C2O42-, Cl-, I-, Br-, SO32-, CN- Нейтральні молекули: NH3, H2O, H2N – NH2 (гідразин) та інш.
Заряд Координаційне число Приклади центрального атома +1 2 Ag+, Cu+ +2 4, 6 Cu2+, Zn2+, Pd2+, Pt2+ +3 6, 4 Pt4+, Cr3+, Co3+, Fe3+ +4 8 Координаційна теорія Вернера
1. ОДНОЯДЕРНІ (містять один центральний атом) Аміакати [Cu(NH3)4]SO4 Аквакомплекси [Al(H2O)6]Cl3 Ацидокомплекси K2[PtCl4] Змішанолігандні K[Pt(NH3)Cl3] Циклічні (хелатні) ПОЛІЯДЕРНІ Місткові [Cr(NH3)5 – OH – (NH3)Cr]Cl3 Кластери (CO)5Mn – Mn(Co)5 Основні типи комплексних сполук
Називають електронегативні ліганди з закінченням на „о”: Cl- Називають катіон зовнішньої сфери. – хлоро, CN- – ціано, NО3- – нітро і т.д. позначаючи їх грецькими числівниками: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта, 8 – окта. 3. Якщо в сполуці присутні ліганди – нейтральні молекули, позначають і їх (NH3 – амін, H2O – акво). 4. Центральному атому дають латинську назву елемента з закінченням „ат” (якщо елемент має змінну ступінь окислення, її вказують в дужках римськими цифрами перед назвою елемента). К4[Fe(CN)6] – калій гексаціаноферат(ІІ) K3[Fe(CN)6] – калій гексаціаноферат (ІІІ) Na2[Zn(OH)4] – натрій тетрааквоцинкат Номенклатура комплексних сполук: Сполуки, що містять комплексний аніон
Називають аніон, що утворює зовнішню координаційну сферу (сульфат, нітрат). Дають назву комплексному катіону: називають електронегативні ліганди із закінченням на „о” називають молекулярні ліганди із закінченням на „о” (якщо вони є) Вказують кількість лігандів грецькими числівниками. Називають центральний атом відповідно до української назви еле- мента в родовому відмінку. [Ag(NH3)2]Cl – діамінсрібла (І) хлорид [Cr(H2O)6]Cl – гексааквохрому (ІІІ) хлорид Сполуки, що містять комплексний катіон
Схожі презентації
Категорії








![Залізо Якісна реакція: на двохвалентний ферум 3FeSO4 + 2K3[Fe(CN)6] = + Fe3[F... Залізо Якісна реакція: на двохвалентний ферум 3FeSO4 + 2K3[Fe(CN)6] = + Fe3[F...](https://svitppt.com.ua/images/4/3423/770/img7.jpg)








![Комплексні сполуки А) Будова CuSO4 + 4 NH3 = [Cu (NH3)4] SO4 [Cu (NH3)4] SO4 ... Комплексні сполуки А) Будова CuSO4 + 4 NH3 = [Cu (NH3)4] SO4 [Cu (NH3)4] SO4 ...](https://svitppt.com.ua/images/4/3423/770/img16.jpg)


![1. ОДНОЯДЕРНІ (містять один центральний атом) Аміакати [Cu(NH3)4]SO4 Аквакомп... 1. ОДНОЯДЕРНІ (містять один центральний атом) Аміакати [Cu(NH3)4]SO4 Аквакомп...](https://svitppt.com.ua/images/4/3423/770/img19.jpg)










![Залізо Якісна реакція: на двохвалентний ферум 3FeSO4 + 2K3[Fe(CN)6] = + Fe3[F... Залізо Якісна реакція: на двохвалентний ферум 3FeSO4 + 2K3[Fe(CN)6] = + Fe3[F...](https://svitppt.com.ua/images/4/3423/210/img7.jpg)








![Комплексні сполуки А) Будова CuSO4 + 4 NH3 = [Cu (NH3)4] SO4 [Cu (NH3)4] SO4 ... Комплексні сполуки А) Будова CuSO4 + 4 NH3 = [Cu (NH3)4] SO4 [Cu (NH3)4] SO4 ...](https://svitppt.com.ua/images/4/3423/210/img16.jpg)


![1. ОДНОЯДЕРНІ (містять один центральний атом) Аміакати [Cu(NH3)4]SO4 Аквакомп... 1. ОДНОЯДЕРНІ (містять один центральний атом) Аміакати [Cu(NH3)4]SO4 Аквакомп...](https://svitppt.com.ua/images/4/3423/210/img19.jpg)