Презентація на тему:
d-елементи ІІІВ – VВ груп ПСЕ. Титан, Ванадій. Лантаноїди. d-Елементи VІВ групи. Підгрупа Хрому. d-Елементи VІІВ групи. Підгрупа Мангану
Завантажити презентацію
d-елементи ІІІВ – VВ груп ПСЕ. Титан, Ванадій. Лантаноїди. d-Елементи VІВ групи. Підгрупа Хрому. d-Елементи VІІВ групи. Підгрупа Мангану
Завантажити презентаціюПрезентація по слайдам:
d-елементи ІІІВ – VВ груп ПСЕ. Титан, Ванадій. Лантаноїди. d-Елементи VІВ групи. Підгрупа Хрому. d-Елементи VІІВ групи. Підгрупа Мангану d-Елементи ІІІВ групи (підгрупа Скандію). Загальна характеристика, подібність та відмінність від елементів ІІА групи. Біологічна роль Скандію, його хімічні властивості. f-елементи як аналоги d-елементів ІІІВ групи, подібність та відмінність на прикладі Церію. Хімічні основи застосування сполук Церію(ІV) в аналітичній хімії. d-елементи ІVВ і VВ груп. Загальна характеристика. Хімічні основи застосування простих речовин та сполук Титану, Ніобію, Танталу та Ванадію у медицині і фармації. Загальна характеристика підгрупи. Хром, природні сполуки. Проста речовина та її хімічна активність. Карбоніл хрому. Сполуки Хрому (ІІ), кислотно-основна та окисно-відновна характеристика. Сполуки Хрому (ІІІ), кислотно-основна та окисно-відновна характеристика, здатність до комплексоутворення. Якісна реакція на катіон Cr3+. Сполуки Хрому (VI) – оксид та дихроматна кислота, хромати та дихромати, кислотно-основна, окисно-відновна характеристика. Оксидайційні властивості хроматів та дихроматів у залежності від рН середовища, окиснення органічних сполук. Пероксосполуки Хрому(VI). Молібден та Вольфрам, загальна характеристика, здатність до утворення ізополі- та гетерополікислот; окисно-відновні властивості сполук. Біологічна роль Хрому та Молібдену. Хімічні основи застосування сполук Хрому, Молібдену та Вольфраму у фармацевтичному аналізі та медицині. Загальна характеристика елементів підгрупи Мангану. Манган. Хімічна активність простої речовини. Здатність до комплексоутворення (утворення карбонілів). Сполуки Манган(ІІ) та Мангану(ІІІ): кислотно-основна та окисно-відновна характеристика, здатність до комплексоутворення. Якісна реакція на катіон Mn2+. Манган(ІV) оксид, кислотно-основні та окисно-відновні властивості, вплив рН середовища на окисно-відновні властивості. Сполуки Мангану(VІ): манганати, їх утворення, термічна стійкість, диспропорціювання в розчині та умови стабілізації. Сполуки Мангану(VІІ): оксид, перманганатна кислота, її солі, окисно-відновні властивості, продукти відновлення перманганатів за різних значенннів рН, окиснення органічних сполук, термічне розкладання. Біологічна роль Мангану. Хімічні основи застосування калію перманганату та його розчинів як антисептичного засобу та у фармацевтичному аналізі.
Загальна характеристика d – елементів VI групи. Хром, молібден і вольфрам – d – елементи VI групи – утворюють підгрупу хрому. Як видно з приведених даних, в ряду Cr – Mo – W збільшується енергія іонізації, тобто ущільнюються електронні оболонки атоів, зокрема дуже відчутно при переході від Mo до W. Останній внаслідок лантаноїдного стиснення має атомний й іонний радіуси, близькі до таких у Мо. Тому молібден і вольфрам за властивостями ближчі один до другого, ніж до хрому. Характерні ступені окиснення хрому +3 і меншою мірою +6 у молібдену і вольфраму, як і в інших 4d – i 5d – елементів, найбільш характерною є вища ступінь окиснення, тобто +6. Можливі також сполуки, де хром і його аналоги проявляють ступені окиснення 0, +1, +2, +4, +5. Для Cr, Mo, W найбільш типові КЧ = 6,4. Як і для інших d – елементів, для Cr, Mo і W при низьких ступенях окиснення більш характерні катіонні комплекси, а при високих – аніонні комплекси.
Способи добуваня елементів V I В групи Добування хрому Хромистий залізняк усумішші з содою нагрівають у спеціальних печах при наявності повітря. При цьому Хром (ІІІ) окиснюється до хромату: 4Fe(CrO2)2+8Na2CO3+7O2 →2Fe2O3+8Na2CrO4+8CO2↑ Далі хромат натрію відмивають водою від погано розчинного залишку, тпідкислюють сірчаною кислотою і переводять у дихромат Na2Cr2O7, який викристалізовують з розчину і відновлюють вугіллям: Na2Cr2O7+2C → Cr2O3+Na2CO3+CO Для добування хрому з оксиду використовують алюмотермічний метод, тобто нагрівають оксид з алюмінієм у спеціальних печах: Cr2O3+2Al →Al2O3+2Cr Добування молібдену Молібден добувають з молібденіту, випалюванням у спеціальних печах: 2MoS+7O2 → 2MoO3+4SO2 Після випалювання руду обробляють розчином аміаку, внаслідок чого у розчині утворюється сіль (NH4)2MoO4, яку відфільтровують від нерозчинних речовин. При підкисленні розчину сульфатної кислотиутворюється кислота H2MoO4, яку відновлюють воднем у трубчастих печах при температурі 950°С: H2MoO4+3H2 → 4H2O+Mo Добування вольфраму Вольфраміт спікають з содою при наявності повітря у спеціальних печах: 4FeWO4*MnWO4+3O2+2Na2CO3 → 2Fe2O3+4MnO2+8Na2WO4+8CO2↑ Na2WO4+2HCl →H2WO4+2NaCl H2WO4 →WO3+H2O WO3+3H3 →W+3H2O або WO3+3C → W+3CO↑
Прості речовини. Cr, Mo, W – сірувато-білі метали.W – найбільш тугоплавкий з металів. В ряду Cr-Mo-W спостерігається підвищення температури плавлення і теплоти атомізації, що пояснюється посиленням в металічному кристалі ковалентного зв’язку, який виникає за рахунок d-електронів. З ростом порядкового номера елемента в ряду Cr-Mo-W хімічна активність помітно знижується. Так, хром витісняє водень з розв. HCl і H2SO4, тоді як вольфрам розчиняється лише в гарячій суміші плавикової і азотної кислот: W + 8HF + 2HNO3 H2[WF8] + 2NO + 4H2O За рахунок утворення аніонних комплесів молібден і вольфрам взаємодіють також при сплавлянні з лугами в присутності окиснювачів: E + 3NaNO3 + 2NaOH = Na2EO4 + 3NaNO2 + H2O !Концентрована H2SO4 і HNO3 пасивують хром. При нагріванні в порошкоподібному стані Cr, Mo і W достатньо легко окиснюються багатьма неметалами, наприклад, згоряють в кисні: 4Cr + 3O2 = 2Cr2O3 ; 2Mo +3O2 = 2MoO3 ; 2W + 3O2 = 2WO3
Сполуки елементів підгрупи хрому. Сполуки Cr(O), Mo(O), W(O). Нульовий ступінь окиснення у d-елементів проявляється в сполуках з -донорними і -акцепторними лігандами, наприклад, з молекулами CO. Для хрому і його аналогів гексакарбоніли Е(СО)6. Карбоніли легко (150 – 170оС = tпл) піддаються возгонці. Їхні молекули діамагнітні, мають форму октаедра з атомом d- елемента в центрі. Карбоніли Cr(CO)6, Mo(CO)6, W(CO)6 – безколірні, токсичні, термічно розкладаються: Cr(CO)6 = Cr + 6CO Cполуки Cr(II), Mo(II), W(II) Для хрому в ступені окиснення +2 характерне КЧ = 6. Сполуки хрому (II) – сильні відновники. Для хрому(II) відоме невелике число бінарних сполук, зокрема дигаліди CrHal2, гідроксид Cr(OH)2, CrO. Бінарні сполуки хрому(II), а також Cr(OH)2 проявляють практично лише основні властивості. Наприклад, Cr(OH)2 взаємодіє лише з кислотами: Cr(OH)2 + 2H3O+ + 2H2O = [Cr(H2O)6]2+ Аквакомплекси [Cr(H2O)6]2+ синього кольору; такого ж кольору є кристалогідрати, наприклад Cr(ClO4)2 6H2O, CrSO4 5H2O, CrCl2 4H2O, CrBr2 6H2O. Дигаліди легко поглинають газоподібний аміак, утворюючи аміакати, наприклад [Cr(NH3)6]Cl2, CrCl2 6NH3 (темно-голубий), CrCl2 5NH3 (фіолетовий), CrCl2 3NH3 (світло-голубий), CrCl2 2NH3 (світло-зелений), CrCl2 NH3 (світло-зелений).
Сполуки елементів підгрупи хрому. Будучи сильними відновниками Cr3++ e = Cr2+, E0 = -0,407 B солі Cr (II) в розчинах легко окиснюються киснем повітря: 4[Cr(H2O)6]2+ + O2 + 4H+ = 4[Cr(OH2)6]3+ + 2H2O, а в присутності окиснювача навіть відновлюють воду, поступово розкладаючи її з виділенням водню: 2CrCl2 + 2H2O = 2Cr(OH)Cl2 + H2. Сполуки Cr(II) отримують відновленням сполук Cr(III), наприклад воднем в розчині в момент виділення, або нагріванням в атмосфері H2. Cr + 2HCl(г) = CrCl2 + H2; CrCl3 + 1/2H2 = CrCl2 + HCl Дигаліди можна отримати також взаємодією металу з газоподібними Hhal (при 600 – 700oC). Похідні Mo(II) і W(II) малочисленні. З їх бінарних сполук в основному вивчені дигаліди ЕHal2. Для d-елементів характерні сполуки, в яких містяться угрупування з двох і більшого числа безпосередньо-зв’заних один з одним атомів d-елементів. Такі угрупування називають кластерами.Відомі кластери сьогодні поділяють на два великих класи: 1) нижчі галіди і оксиди; 2) багатоядерні карбоніли. Наприклад, за даними рентгеноструктурного аналізу дихлорид молібдену має формулу [Mo6Cl8]Cl4. Характерне угрупування [Mo6Cl8]4+ стійке і може без змін переходити в інші сполуки. Так, при дії на MoCl2 лугів утворюється основа: [Mo6Cl8]Cl4 + 4NaOH = [Mo6Cl8](OH)4 + 4NaCl. Будова MoBr2, WCl2, WBr2 аналогічна будові MoCl2.
Сполуки елементів підгрупи хрому. Сполуки Cr(III), Mo(III), W(III). У хрому ступінь окислення +3 є найбільш стійкою. Координаційне число Cr(III) рівне 6, тому його комплекси (структурні одиниці) мають форму октаедра. Оксид хрому (III) Cr2O3 – темно-зелениий порошок, а в кристалічному стані – чорний з металевим блиском. Оксид хрому (III) – тугоплавкий (tпл = 22650С), хімічно інертний. У воді, кислотах і лугах не розчиняється. Використовується для отримання олійних і акварельних фарб. Отримують його найчастіше з хроматів або біхроматів: K2Cr2O7 + S = Cr2O3 + K2SO3; (NH4)2Cr2O7 N2 + Cr2O3 + 4H2O; K2Cr2O7 + 2NH4Cl N2 + Cr2O3 + 2KCl + 4H2O. Амфотерна природа оксиду хрому (III) проявляється при сплавленні з відповідними сполуками. Так, при сплавленні оксиду хрому (III) з дисульфатом калію утворюється сульфат хрому (III): 3K2S2O7 = 3K2SO4 + 3SO3 Cr2O3 + 3SO3 = Cr2(SO4)3 3K2S2O7 + Cr2O7 = Cr2(SO4)3 + 3K2SO4 А при сплавленні з лугами та відповідними основними оксидами утворюються оксохромати (III), які називають хромітами: 2KOH + Cr2O3 = 2KCrO2 + H2O. N2CO3 + Cr2O3 = 2NaCrO2 + CO2 Оксохромати (III) d-елементів типу M(CrO2)2 є координаційними полімерами, тобто змішаними оксидами (типу шпінелі).
Сполуки елементів підгрупи хрому. Хлорид хрому (III) CrCl3 отримують у безводному стані при пропусканні сухого хлору над нагрітим до червоного металічним хромом або над розжареною сумішшю оксиду хрому (III) і вугілля. Хлорид CrCl3 можна отримати також нагріванням Cr2O3 з чотирихлористим вуглецем або дитіохлоридом: t0 2Cr + 3Cl2 = 2CrCl3; Cr2O3 + 3C + 3Cl2 = 2CrCl3 + 3CO; Cr2O3 + 3CCl4 = 2CrCl3 + 3COCl2. Безводний хлорид хрому (III) утворює червоно-фіолетові блискучі листочки. При нагріванні до червоного в струмені хлору хлорид хрому (III) сублімується. Якщо ж його нагрівати у відсутності хлору, то відбувається частковий розпад на хлорид хрому (II) і хлор: 2CrCl3 = 2CrCl2 + Cl2. При розжарюванні на повітрі хлорид хрому (III) легко переходить в зелений оксид хрому (III): 4CrCl3 + 3O2 = 2Cr2O3 + 6Cl2. При дії відповідних водневих сполук хор в хлориді хрому (III) легко заміщується сіркою, азотом або фосфором: 2CrCl3 + 3H2S = Cr2S3 + 6HCl; CrCl3 + NH3 = CrN + 3HCl; CrCl3 + PH3 = CrP +3HCl. У воді і в спирті на холоді безводний хлорид хрому (III) не розчиняється; навіть при кип’ятінні розчинення є дуже повільним.Але якщо ввести дуже незначну кількість хлориду хрому (II), то відбувається швидке розчинення при інтенсивному виділенні тепла. Аналогічну дію виявляє введення речовин, які здатні легко відновити частину хлориду хрому (III) до хлориду хрому (II). Цим способом отримують темно-зелений розчин хлориду хрому (III).
Сполуки елементів підгрупи хрому. Якщо на розчинні у воді солі хрому (III) діяти гідроксидом амонію, то виділяється сіро-синій малорозчинний у воді гідроксид хрому (III): Сr3+ + 3OH- = Cr(OH)3 , сіро-синій який має змінний склад Cr2O3 nH2O. Склад і структура гідроксиду залежить від умов отримання. При стоянні, а особливо при нагріванні, Cr2O3 nH2O внаслідок заміни зв’зків Cr – OH – Cr на зв’зки Cr – O – Cr втрачає хімічну активність. Свіжовиготовлений Cr(OH)3 добре розчиняється в присутності кислот і лугів, які викликають розрив зв’зків: Cr(OH)3 + 3H3O+ = [Cr(H2O)6]3+; Сr(OH)3 + 3OH- = [Cr(OH)6]3-. Отримання гідроксиду хрому (III) і його перехід в катіонні й аніонні комплекси можна виразити наступним рівнянням: [Cr(H2O)6]3+ Cr(OH)3 [Cr(OH)6]3-. Аквакомплекс [Cr(H2O)6]3+ синьо-фіолетового кольору, входить до складу кристалогідратів Cr(III), наприклад у фіолетові CrCl3 6H2O, CrBr3 6H2O, MCr(SO4)2 12H2O (квасці). В залежності від умов (t0, концентрація, pH) склад катіонних аквакомплексів змінюється, що супроводжується зміною їх забарвлення від фіолетового до зеленого:(гідратна ізомерія) [Cr(H2O)6]3+ [Cr(H2O)4Cl2]+ [Cr(H2O)3Cl3] cиньо-фіолетовий темно-зелений світло-зелений
Сполуки елементів підгрупи хрому. Спроби отримати обмінними реакціями Cr2S3 чи Сr2(CO3)3 не приводять до успіху, оскільки внаслідок гідролізу утворюється гідроксид: 2Cr3+ + 3CO2-3 + H2O = 2Cr(OH)3 + 3CO2 . Крім аквакомплексів для Cr (III) відомі катіонні амінокомплекси [Cr(NH3)6]3+ (фіолетового кольору). Ці амінокомплекси є стійкими в твердому стані, а у водних розчинах розкладаються: [Cr(NH3)6]Cl3 + 3H2O Cr(OH)3 + 3NH4Cl + 3NH3. Похідні аніонніх комплексів хрому (III) – хромати (III) – дуже різноманітні. Нижче приведені рівняння реакцій їх отримання: 3KOH + Cr(OH)3 = K3[Cr(OH)6]; зелений 3KCl + CrCl3 = K3[CrCl6]; рожево-червоний 3H2SO4 + Cr2(SO4)3 = 2H3[Cr(SO4)3] жовтий Гідроксохромати (III) стійкі в твердому стані, а в розчинах – лише при великому надлишку лугу. В чистій воді вони руйнуються. В окснювально-відновних реакціях солі хрому (III) можуть виступати як відновники. Ця їхня здатність краще виявляється в лужному середовищі.
Сполуки елементів підгрупи хрому. Сполуки Cr(VI), Mo(VI) і W(VI). Ступінь окислення +6 хрому, молібдену і вольфраму проявляється в галідах, оксогалідах, оксидах і відповідних аніонних комплексах. Для хрому (VI) характерне КЧ = 4, що відповідає тетраедричній будові його аніонних комплексів і структурних одиниць. Координаційні числа Mo(VI) і W(VI) різноманітніші, а відносно стійкіші КЧ = 4 і 6. В ряді однотипних похідних Cr(VI) – Mo(VI) – W(VI) стійкість помітно зростає. Для Mo(VI) і W(VI) відомі численні похідні полімерних оксоаніонів дуже складної будови і складу. Схильність до полімеризаціії іону CrO2-4 виражена відносно менше, але відомі дихромат K2Cr4O7, трихромат K2Cr3O10, тетрахромат K2Cr4O13. Всі вони містять аніони, утворені тетраедрами CrO4, що споучені в ланцюг. Будова іону Cr2O2-7: O O \ / \ Cr Cr- O / \ / \ O O O O Поліхромати утворюються при дії кислот на хромати. Так, якщо на насичений розчин хромату калію подіяти кислотою, то його забарвлення спочатку стане червоно-оранжевим, а потім зміниться до більш темного за рахунок утворення дихроматів, потім трихроматів і т. д. 2CrO2-4 + 2H+ = Cr2O2-7 + H2O; 3Cr2O2-7 + 2H+ = 2Cr3O2-10 + H2O.
Сполуки елементів підгрупи хрому. В результаті наступного підкиснення розчину концентрованою сірчаною кислотою при охолодженні виділяються темно-червоні кристали триоксиду: K2CrO4 + H2SO4 = CrO3 + K2SO4 + H2O. Якщо ж подіяти на розчини поліхроматів лугом, то процес йде в зворотньому напрямку і в кінцевому результаті знову утворюється хромат. Взаємні переходи хромату і дихромату можна зобразити рівнянням оборотньої реакції: 2CrO2-4 + 2H+ Cr2O2-7 + H2O. Менш розчинними є хромати BaCrO4, PbCrO4, Ag2CrO4, а більш розчинними є їхні біхромати. Хромати Na+, K+ отримують сплавленням на повітрі при 1000 – 1300 0С хромистого залізняку з содою чи поташем: 4Fe(CrO2)2 + 8Na2CO3 + 7O2 = 8Na2CrO4 + 2Fe2O3 + 8CO2 . Сполуки Cr(VI) – сильні окиснювачі, переходять в окиснювально-відновних реакціях в похідні Cr(III). В нейтральному середовищі утворюється Cr(OH)3: Cr2O2-7 + 3(NH4)2S + H2O = 2Cr(OH)3 + 3S + 6NH3 + 2OH-; в кислому – похідні катіонного комплексу [Cr(OH2)6]3+: Cr2O2-7 + 3SO2-3 + 8H+ = 2Cr3+ + 3SO2-4 + 4H2O; в лужному – похідні аніонного комплексу [Cr(OH)6]3-: 2CrO2-4 + 3(NH4)2S + 2OH- + 2H2O = 2[Cr(OH)6]3- + 3S + 6NH3. Найбільша окиснювальна активність оксохроматів (VI) спостерігається в кислому середовищі: Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O, E0 = 1.33B. Окиснювальні власивості сполук Cr(VI) використовуються в хімічному аналізі і синтезі.
Сполуки елементів підгрупи хрому. Оксидам MoO3 і WO3 відповідають кислоти H2MoO4 молібденова і H2WO4 вольфрамова. Вільна молібденова кислота – безбарвний порошок, а вольфрамова кислота – порошок жовтого кольору. Їх, як погано розчинні у воді, добувають розкладанням відповідних солей сильними кислотами. У ряду Cr-Mo-W сила кислот зменшується H2CrO4 - H2MoO4 - H2WO4 сер.сили слабкі Для елементів підгрупи хрому відомі ізополікислоти загального складу nEO3 mH2O (n m), наприклад, H2E2O7, H2E3O10, H2E4O13. Крім того, молібденова і вольфрамова кислоти виявляють велику здатність до утворення гетерополікислот, наприклад, H3[P(Mo3O10)4].
Біологічна роль хрому та молібдену. Застосування їх сполук у фарманалізі. Ефективне засвоєння азоту рослинами можливе лише при наявності слідів молібдену в грунті. Тому розчинні молібдати – це мікродобрива. Усі сполуки хрому(VI) – токсичні. У фармацевтичному аналізі застосовують: - хромова суміш (K2Cr2O7 + H2SO4 конц.); - біхромат калію, як первинний стандарт в методі окиснювально-відновного титрування; - молібдати і вольфрамати у фотометричних методах аналізу, як для визначення фосфору, так і для визначення біологічно-активних речовин природного походження. Біологічне значення елементів VI В групи. Хром відіграє важливу роль в організмі людини. Він позитивно впливає на процеси кровотворення, а також на ферментативні системи. У складі ферменту трипсину хром приймає участь у процесі травлення. Вченими встановлено, що вилучення хрому з харчового раціону тварин приводить до підвищення у крові та сечі глюкози. Додавання хрому до їжі хворим на цукровий діабет нормалізує вуглеводний обмін. Хром в організм людини потрапляє з такими продуктами харчування як соя, кукурудзяна та вівсяна крупа. Добова потреба організму в хромі складає 5-10 мг на добу. У більших дозах сполуки хрому досить отруйні. Масова частка молібдену в організмі людини складає 1 10-5%. Добова потреба в молібдені втричі менша, ніж у хромі. Молібден міститься в деяких ферментних системах організму людини. Він цілюще впливає на синтез гемоглобіну. Надмірний вміст молібдену сприяє накопиченню в організмі сечової кислоти, яка спричиняє розвиток подагри – хвороби, що приводить до змін в суглобах, кістках, хрящах. Вольфрам також міститься в організмах людини і тварини, але його біологічна роль не вивчена.
Характерні реакції іонів Cr3+ Хром (ІІІ) у лужному середовищі окиснюється до CrO42-, а в кислому – до Cr2O72-. Іони Cr3+ до Cr2O72- окиснюються лише сильними окисниками (H2O2, Na2O2, KMnO4, Cl2, Br2, (NH4)2S2O8 та ін.). Хром (ІІІ) у лужному середовищі окиснюється найчастіше, взаємодіючи з H2O2, хлорною або бромною водою. У лужному середовищі хром (ІІІ) є у вигляді іона тетрагідроксохроміту (ІІІ). Таку реакцію можна описати рівнянням: 2[Cr(OH)4]- + 3Br2 + 8OH- = 2CrO42- + 6Br- + 8H2O Хром (ІІІ) у кислому середовищі окиснюють за допомогою KMnO4, (NH4)2S2O8 та багатьох інших сильних окисників: 2Cr3+ + 2MnO4- + 5H2O = Cr2O72- + 2MnO(OH)2 + 6H+. Реакція відбувається у випадку нагрівання і супроводжується утворенням бурого осаду MnO(OH)2. 2Cr3+ + 3S2O82- + 7H2O = Cr2O72- + 6SO42- + 14H+. Реакція прискорюється в присутності солей Аргентуму (І), як каталізатора. Утворення пероксихроматної кислоти. У процесі дії H2O2 на підкислений розчин хромату або біхромату утворюється пероксихроматна кислота H2CrO6, у результаті чого розчин забарвлюється в насичений синій колір: Cr2O72- + 4H2O2 + 2H+ = 2H2CrO6 + 3H2O. У водному розчині пероксихроматна кислота дуже нестійка (вона розкладається з утворенням Cr3+), тому до розчину додають органічний розчинник (аміловий спирт або диетиловий ефір), який екстрагує H2CrO6.
Способи добування елементів VІІ В групи Добування мангану Манган добувають у вигляді його сплаву з залізом – феромарганцю, який містить 60-90% мангану. Феромарганець добувають відновленням суміші оксидів металів коксом у доменних печах: MnO2+Fe2O3+5C →Mn+2Fe+5CO↑ Металічний манган без домішок заліза далі добувають методом алюмометрії: 3MnO2*xH2O → Mn3O4+O2+xH2O 3Mn3O4+8Al →4Al2O3+9Mn Магнан високого ступеня чистоти добувають електролізом водних розчинів MnSO4. Реній добувають з пилу залишкових газів, які утворюються при прожарюванні молібденіту MoS2.
Загальна характеристика підгрупи. В побічну підгрупу VII групи входять елементи Mn – марганець, Tc – технецій і Re – реній. Головним представником побічної підгрупи VII групи є марганець. Його аналог з порядковим номером 43 (Tc) нестійкий і зустрічається в природі в дуже невеликих кількостях. Але штучно може бути отриманий відносно легко. Так, як цей елемент вперше був отриманий штучно (Сере), то і названо його технецієм. Аналог марганцю з порядковим номером 75 – реній (1925р., Ноддак і Такке) хоча і стабільний, але належить до числа рідкісних елементів. За хімічними властивостями обидва аналоги марганцю більш близькі до своїх сусідів по ряду (Mo і Ru або W і Os) і тільки за валентними станами нагадують марганець. Марганець, технецій і реній – повні електронні аналоги з конфігурацією валентних електронів (n-1)d5ns2. Вони об’єднуються в підгрупу марганцю. Для марганцю характерні СТО +2, +4, +7; вони відповідають стійким незв’зуючим електронним конфігураціям d5, d3 і d0. Існують сполуки марганцю, в яких він проявляє ступені окислення 0, +3, +5 і +6. Для технецію і ренію стійкий вищий ступінь окислення +7. Для Mn найбільш типові КЧ 6, 4; для Tc і Re, крім того, 7, 8, а також 9.
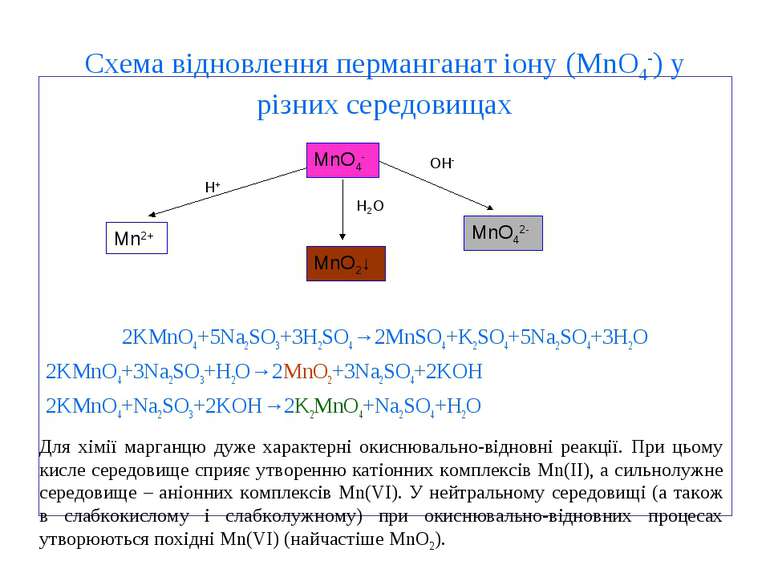
Схема відновлення перманганат іону (MnO4-) у різних середовищах 2KMnO4+5Na2SO3+3H2SO4→2MnSO4+K2SO4+5Na2SO4+3H2O 2KMnO4+3Na2SO3+H2O→2MnO2+3Na2SO4+2KOH 2KMnO4+Na2SO3+2KOH→2K2MnO4+Na2SO4+H2O MnO4- MnO2↓ Mn2+ MnO42- OH- H2O H+ Для хімії марганцю дуже характерні окиснювально-відновні реакції. При цьому кисле середовище сприяє утворенню катіонних комплексів Mn(II), а сильнолужне середовище – аніонних комплексів Mn(VI). У нейтральному середовищі (а також в слабкокислому і слабколужному) при окиснювально-відновних процесах утворюються похідні Mn(VI) (найчастіше MnO2).
У марганцю із зростанням позитивного заряду атома зменшується основна природа гідроксиду і посилюється кислотна. Майже всі сполуки марганцю забарвлені: двовалентний – в блідо-рожевий, інші в більшості випадків є яскравих відтінків, декотрі – дуже інтенсивно забарвлені (перманганати). Зростання температур плавлення і кипіння в ряду Mn-Tc-Re пояснюється посиленням частки ковалентного зв’язку, утвореного за рахунок (n-1)d-орбіталей. Хімічна активність простих речовин в ряду Mn-Tc-Re знижується. Так, в ряду напруг Mn розміщується до водню, а Tc і Re – після нього. Марганець достатньо активно взаємодіє з розведеною HCl і H2SO4, а технецій і реній лише з HNO3. У відповідності із стійкими ступенями окиснення взаємодія марганцю з розведеними кислотами приводить до утворення катіонного аквакомплексу: Mn + 2H3O+ + 4H2O = [Mn(H2O)6]2+ + H2 , а взаємодія технецію і ренію з нітратною кислотою – до утворення аніонного оксокомплексу [EO4]-: 3Tc + 7HNO3 = 3HТcO4 + 7NO +2H2O Внаслідок достатньо високої хімічної активності марганець легко окиснюється, особливо в порошкоподібному стані, при нагріванні киснем, сіркою, галогенами: Mn + Cl2 = MnCl2 ; Mn + S = MnS ; Mn + 2P = Mn3P2 ; 3Mn + N2 = Mn2N2 ; 2Mn + Si = Mn2Si . Компактний метал на повітрі стійкий, так як покривається оксидною плівкою, яка запобігає подальшому окисненню металу. Ще більш стійка плівка утворюється при дії на Mn холодної нітратної кислоти. Технецій і реній вступають в хімічну взаємодію з неметалами при достатньо сильному нагріванні. Так, при 400оС вони згоряють в атмосфері кисню, утворюючи E2O7.
Сполуки елементів підгрупи Mn та їхні властивості. Сполуки Mn(O), Tc(O), Re(O). Нульовий СТО у d-елементів проявдяється в сполуках з -донорними і -акцепторними лігандами.Так, для марганцю і його аналогів відомі карбоніли складу Е2(СО)10. Карбоніли Mn2(CO)10 (жовтий), Tc2(CO)10 і Re(CO)10 – безбарвні – це тверді речовини, які легко сублімуються. Карбоніли металів схильні до реакцій заміщення і окиснення-відновлення, наприклад: [Mn(CO)5]2 + 2Na = 2Na[Mn(CO)5]; [Mn(CO)5]2 + Br2 = 2Mn(CO)5Br. Для Mn (II) характерне КЧ = 6, що відповідає октаедричному розміщенню зв’зків. Більшість солей Mn (II) добре розчинні к воді. Малорозчинні MnO, MnS, MnF2, Mn(OH)2, MnCO3, Mn3(PO4)2. При розчиненні у воді солі Mn (II) дисоціюють, утворюючи аквакомплекси [Mn(H2O)6]2+, які надають розчинам рожевого забарвлення. Такого ж кольору є кристалогідрати Mn (II), наприклад Mn(NO3)2 6H2O, Mn(ClO4)2 6H2O. За хімічними властивостями бінарні сполуки Mn(II) амфотерні (переважають ознаки основних сполук). В реакціях без зміни ступеня окиснення для них найбільш характерний перехід в катіооні комплекси. Так, оксид MnO, як і гідроксид Mn(OH)2, легко взаємодіють з кислотами: MnO + 2H3O+ + 3H2O = [Mn(H2O)6]2+. З лугами ж вони реагують тільки при достатньо сильному і довгому нагріванні: Mn(OH)2 + 4OH- = [Mn(OH)6]4-.
Оксид MnO – порошок сіро – зеленого кольору, який має змінний склад (MnO – MnO1,5) і володіє напівпровідниковими властивостями. Його отримують нагріванням піролюзиту в атмосфері водню або CO при t = 700 - 900 С: MnO2 + H2 = MnO + H2O Або розкладом MnCO3, MnC2O4, Mn(NO3)2 в атмосфері водню при 300 С. Оскільки MnO з водою не реагує, то гідроксид Mn(OH)2 (білого кольору) отримують непрямим шляхом – діє лугів на розчин солі Mn(II): MnSO4+2KOH = Mn(OH)2 + K2SO4. Гідроксид Mn(II) з кислотами легко утворює солі; на повітрі гідроксид Mn(II) легко окиснюється до Mn(OH)4: 2Mn(OH)2 + O2 + 2H2O = 2Mn(OH)4 Солі Mn(II) утворюються при взаємодії MnO2 з кислотами за рівнянням: 2MnO2 + 2H2SO4 = 2MnSO4 + O2 + 2H2O Кислотні властивості сполуки Mn(II) проявляють при взаємодії з однотипними похідними лужних металів. Так, нерозчинний у воді Mn(CN)2 (білого кольору) за рахунок комплексоутворення розчиняється в присутності KCN: 4KCN+ Mn(CN)2 = K4[Mn(CN)6]. Аналогічно відбувається реакції: MnF2+ 4KF=K4[MnF6] 2KCl+MnCl2=K2[MnCl4]. Більшість манганатів (ІІ) (крім комплексних ціанідів) в розведених розчинах руйнується. При дії окиснювачів похідні Mn(II) проявляють відновні властивості. Так, в лужному середовищі Mn(OH)2 легко окиснюється навіть молекулярним киснем повітря, тому осад Mn(OH)2, який отримують обмінною реакцією, швидко темніє (Mn(OH)4 – бурий) або: 6Mn(OH)2 + O2 = 2Mn2MnO4 + 6H2O. В сильнолужному середовищі окиснення супроводжується утворенням оксоманганатів(VI) – похідних комплексу MnO42-: 3MnSO4+2KClO3+12KOH=3K2MnO4+2KCl+3K2SO4+6H2O. Сильні окиснювачі, такі, як PbO2 (окиснює в кислому середовищі), переводять сполуки Mn(II) в оксоманганати(VII) – похідні комплексу MnO4-(якісна реакція): 2MnSO4 + 5PbO2 + 6HNO3 = 2HMnO4 + 3Pb(NO3)2 + 2PbSO4 + 2H2O. Сполуки Te(II) і Re(II) не характерні.
Оксид Mn(III) Mn2O3 зустрічається в природі у вигляді мінералу брауніту. В лабораторії утворюється при обережному нагріванні MnO2 при температурі 530 – 940 С: 4MnO2 = 2Mn2O3 + O2 . Основний оксид Mn2O3 – тверда речовина чорного кольору, погано розчинна у воді і кислотах. При взаємодії Mn2O3 з концентрованою сульфатною кислотою утворюється зелена сіль Mn2(SO4)3 або коричнювата Mn2(SO4)3 H2SO4 6H2O. Гідроксид Mn(OH)3 погано розчинний у воді, виявляє слабкі основні властивості. Солі Mn(III), як правило, нестійкі. Сполуки Mn(IV), Tc(IV), Re(IV). Для E(IV) найбільш характерне КЧ = 6. Серед стійких сполук Mn(IV) є: диоксид MnO2, тетрафторид MnF4, гексагалогеноманганат(IV) – комплекси типу MnF62-, MnCl62-. Диоксид MnO2 – чорно – бура тверда речовина, частіше всього змінного складу. Це – найстійкіша сполука марганцю, вона широко розповсюджена в земній корі (піролюзит). При звичайних умовах MnO2 у воді не розчиняється і є досить інертним – без нагрівання стійкий до більшості кислот. За хімічною природою MnO2 амфотерний. Так, зокрема відома чорного кольору сіль Mn(SO4)2, яку отримують окисненням MnSO4. У водних розчинах ця сполука гідролізує повністю. При ставленні з лугами або основними оксидами, наприклад: MnO2 + CaO = CaMnO3. Утворюються оксоманганати (манганіти) дуже різної і складної будови: MMnO3, M4MnO4.
Сполуки Mn(IV) – сильні окиснювачі: MnO2 + 4H+ + 2e = Mn2+ + 2H2O, E = 1.23B. Принагріванні з кислотами MnO2 не утворює аквакомплекси Mn4+, а проявляє окиснювальні властивості, наприклад, окиснює концентровану хлоридну кислоту: MnO2 + 4HCl = MnCl2 + Cl + 2H2O Диоксид марганцю не реагує з холодною H2SO4(конц.); а при нагріванні спочатку утворює сульфат марганцю(ІІІ) і виділяється кисень ( 110 С); при вищій температурі сульфат марганцю(ІІІ) переходить в сульфат марганцю(ІІ) і також виділяється кисень. З нітратною кислотою також виділяється кисень: 2MnO2 + 4HNO3 = 2Mn(NO3)2 + 2H2O + O2. При взаємодії сполук Mn(IV) з найбільш сильними окиснювачами утворюються похідні Mn(VI) i Mn(VII), наприклад: 3MnO2 + KClO3 + 6KOH 3K2MnO4 + KCl + 3H2O; 2MnO2 + 3PbO2 + 6HNO3 = 2HMnO4 + 3Pb(NO3)2 + 2H2O. Манганат калію K2MnO4 самочинно розкладається на перманганат калію і диоксид марганцю: 3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH.
Сполуки Mn(VI), Te(VI), Re(VI). Сполуки, в яких ступінь окиснення марганцю і його аналогів +6, нечисленні. З них найбільш стійкі сполуки ренію і технецію, для яких відомі фториди і хлориди, ряд оксогалідів і оксиди, наприклад:ReF6 – блідо – жовтий, ReOF4 – синій,ReO3 – червоний. Галіди, оксогаліди і оксиди Te(VI) i Re(VI) – кислотні сполукию їм відповідають аніонні комплекси. Ступінь окиснення +6 марганцю дещо стабілізується в аніоні MnO42-, який називається манганатом. Похідні MnO42-, TeO42-, ReO42- (темно – зеленого кольору). У водних розчинах існують лише при великому надлишку лугу, в іншому випадку диспропорціонують за схемою: 3EO42- + 2H2O = 2EO4- + EO2 + 4OH-. Особливо легкий цей процес відбувається в кислому середовищі, тому похідні водню типу Н2ЕО4 не утворюються. Диспропорціонуванням супроводжується також гідроліз галідів і оксогалідів Te(W) i Re(VI), який проходить енергійно з утворенням НЕО4, ЕО2, ННаl. При взаємодії оксидів, оксогалідів і галідів з лугами утворюються відповідні солі і ЕО2, наприклад: 3EHal6 + 20KOH = 2KEO4 + EO2 + 18KCl + 10H2O. Cполуки Mn(VI) – сильні відновники, особливо в кислому середовищі: MnO42- + 4H+ + 2e = MnO2 + 2H2O, E= 2.36B Однак, при дії більш сильних окиснювачів вони перетворюються в оксоманганати(VII): 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl. Похідні Tc(VI) i Re(VI), навпаки, легко окиснюються навіть молекулярним киснем повітря: 4K2EO4 + O2 + 2H2O = 4KEO4 + 4KOH При нагріванні вище 500 0С манганат (VI) калію розпадається на манганат (IV) (так званий манганат калію) і кисень, який правда, внаслідок утворення твердих розчинів виділяється не повністю: K2MnO4 = K2MnO3 + 1/2O2. В чистому стані відомі манганати тільки лужних металів. Манганат (VI) барію використовують в якості фарби (касселева зелена). Зокрема у фресковому живописі нею користуються.
Сполуки Mn(VII), Tc(VII) і Re(VII). Cтійкість сполук в ряду Mn(VII), Tc(VII), і Re(VII) зростає. Так, для Mn(VII) відомі лише оксид Mn2O7 і оксофторид MnO3F, а для Re(VII) отримано всю гаму сполук: ReF7 – ReOF5 – ReO2F3 – ReO3F – Re2O7. Марганцеві(VII), технецію(VII), і ренію(VII) відповідають стійкі аніонні тетраедричні комплекси типу EO4. Максимальне координаційне число ренію проявляється в сполуках K2[ReF9] і K2[ReH9]. Оксид марганцю Mn2O7 - нестійка зеленкувато-чорна масляниста рідина. Її отримують дією концентрованої H2SO4 на манганати (VII): 2KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O Якщо не приймати спеціальних заходів, оксид марганцю(VII) розкладаєься з вибухом: 2Mn2O7 = 4MnO2 + 3O2 . Оксид технецію (VII) Tc2O7 і оксид ренію (VII) Re2O7 – стійкі кристалічні речовини жовтого кольору. Їх можна отримати безпосереднім окисненням простих речовин. В звичайних умовах MnO3F – рідина. Молекула триоксофториду марганцю (VII) має форму спотвореного тетраедра з атомом марганцю в центрі. Аналогічно побудовані молекули ReO3Hal і TcO3Hal. Галіди, оксогаліди і оксиди E(VII) –типові кислотні сполуки. Вони енергійно взаємодіють з водою з утворенням кислот: E2O7 + H2O = 2HEO4; EO3F + H2O = HEO4 + HF.
Тетраоксоманганат (VII) водню HMnO4 у вільному стані не отриманий, а максимально можлива концентрація його у водних розчинах 20 . Тетраоксотехнат (VII) водню HTcO4 – червона кристалічна речовина, тетраоксоренат (VII) водню HReO4 не виділено. У водних розчинах HEO4 є сильними кислотами, які називаються марганцевою, технецієвою і ренієвою кислотами. В ряду: HMnO4 – HTcO4 – HReO4 сила кислот дещо зменшується. Більшість похідних MnO-4, TcO-4, ReO-4 (називаються ще перманганатами, пертехнатами і перренатами) добре розчинні у воді. Порівняно важко розчинні солі K+, Rb+ і Cs+. Іон MnO-4 – яскравого червоно-фіолетового забарвлення; TcO-4 - рожевий; ReO-4 – безколірний. Сполуки Mn(VII) –сильні окиснювачі. Наприклад, при зіткненні з Mn2O7 ефір і спирт самозаймаються. Тетраоксоманганати (VII) в якості сильних окиснювачів широко застосовуються в лабораторній практиці. Можливі наступні напрямки відновлення іону MnO-4: В кислому середовищі утворюються катіонні комплекси типу [Mn(OH2)6]2+ , в сильнолужному середовищі – аніони MnO2-4, в нейтральному і лужному – похідні Mn(IV), частіше MnO2. При нагріванні оксоманганати (VII) розпадаються: 2KMnO4 = K2MnO4 + MnO2 + O2. Ця реакція використовується в лабораторії для отримання кисню.
Із сполук елементів підгрупи марганцю найбільше призначення має MnO2. Це вихідний продукт для отримання всіх інших похідних марганцю. Диоксид застосовують також в якості каталізатора, дешевого окиснювача, деполяризатора в гальванічних елементах. Раніше перманганат калію отримували окисненням або діоксиду марганцю, або манганату калію. Диоксид марганцю окиснювали селітрою при сплавленні з лугом: MnO2 + KNO3 + 2KOH = K2MnO4 + KNO2 + H2O. Манганат калію, який утворився в розчині, самовільно розпадається на перманганат калію і диоксид марганцю: 3K2MnO4+2H2O=2KMnO4+MnO2+4KOH. За другим способом манганат калію окиснювали хлором: 2K2MnO4 + Cl2 = 2KMnO4 +2KCl. Зараз перманганат калію отримують електролітичним окисненням манганату: MnO2-4 – e = MnO-4. Перманганат калію використовується в лабораторії для отримання хлору і кисню: 2KMnO4 + 16HCl = 2KCl + 2MnCl2 +5Cl2 + 8H2O; 2KMnO4 = K2MnO4 +MnO2 + O2 . Перманганат калію є найбільш вживаним окиснювачем в препаративній органічній хімії. Він служить також для очищення речовин від органічних домішок, наприклад для очистки від домішок оцтової кислоти. В аналітичній хімії перманганат калію застосовують для кількісного визначення речовин, які володіють відновними властивостями (Fe2+, Sn2+, AsO3-3, H2O2, щавлева і мурашина кислоти азотиста кислота і т.д.) – титриметричний метод окиснювально-відновного титрування – перманганатометрія
Реакції виявлення Mn2+ Реакції окиснення Мангану (II) у вищі ступені мають велике значення для виявлення і відокремлення Мангану від інших елементів, а також для його кількісного визначення. Іони Mn2+ можна окиснити дією різних окисників у кислому і лужному середовищі. Розглянемо найважливіші реакції окиснення іонів Mn2+. Амоній персульфат (NH4)2S2O8 за наявності каталізатора (іони Ag+) окиснює іони Mn2+ у MnO4–. Розчин при цьому забарвлюється у малиново-фіолетовий колір: 2Mn2+ + 5S2O82– + 8H2O = 2MnO4– + 10SO42– + 16H+. Натрій бісмутат у розчині нітратної кислоти окиснює іони Mn2+ до MnO4– за рівнянням: 2Mn2+ + 5BiO3– + 14H+ = 2MnO4– + 5Bi3+ + 7H2O. Бромна або хлорна вода, Гідроген пероксид в лужному середовищі окиснюють іони Mn2+ у MnO(OH)2 (або MnO2 2H2O) – осад чорного кольору: Mn2+ + Br2 + 4OH– = MnO(OH)2 + 2Br– + H2O.
Біологічна роль Mn і використання в медицині його сполук. Марганець є важливим елементом для життєдіяльності усіх живих організмів. Загальна масова частка марганцю в організмі людини складає 1 10-5 . Добова потреба людини у марганці 5 – 7 мг. Він потрапляє в організм, головним чином, з рослинними харчовими продуктами. Найбільша його кількість міститься у вівсяній, пшеничній крупі та рисі. Багато марганцю знаходиться в мигдальних горіхах, молочному шоколаді. Біологічна дія марганцю обумовлена його здатністю до комплексоутворення з кисне- та азотовмісними лігандами ферментів, гормонів, вітамінів. Завдяки цьому він впливає на жировий, білковий та вуглеводневий обмін. Нестача марганцю приводить до відкладення жиру в організмі, викликаючи патологічне ожиріння. Марганець впливає на мінеральний обмін: солі марганцю сприяють засвоєнню фосфору і кальцію, приймають участь в засвоєнні йоду та синтезі гормонів щитовидної залози. У комбінації з солями міді марганець стимулює процеси кровотворення. Солі марганцю входять до складу багатьох полівітамінів з мікроелементами. Широке застосування у медичній практиці має перманганат калію. Розчини KMnO4 з масовою часткою 0,01 – 0,1 використовують в урології та гінекології для полоскань і спринцювань, для промивання шлунку при отруєннях. Розчини більш високих концентрацій (0,1 – 0,5 ) – для промивання ран. При опіках першого ступеня рекомендують обробляти поверхню розчином KMnO4 з масовою часткою 2,5 - 4 .Внутрішньовенне вливання сульфату марганцю дозволяє врятувати тих, кого покусав каркут – найотруйніший павук в країнах Середньої Азії.
Схожі презентації
Категорії