Презентація на тему:
Біохімічні дослідження при захворюваннях ендокринної системи
Завантажити презентацію
Біохімічні дослідження при захворюваннях ендокринної системи
Завантажити презентаціюПрезентація по слайдам:
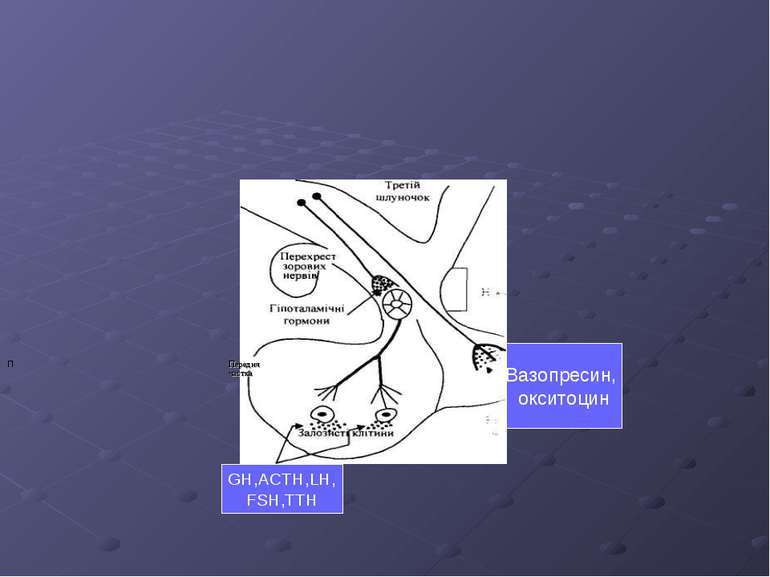
Гіпофіз і гіпоталамус є анатомічними утворами, що функціонально тісно пов'язані між собою. Гіпоталамус контролює функції передньої частки гіпофіза посередництвом чинників (гормонів), які виділяються клітинами гіпоталамуса у кров ворітних вен гіпофіза і, при участі останніх, доносяться до передньої частки гіпофіза. Гормони, що виділяються задньою часткою гіпофіза, є нейропептидами. В цій частці гіпофіза знаходяться аксони нейронів супраоптичного і паравентиркулярного ядер гіпоталамуса. Синтезовані в гіпоталамусі нейрогормони по аксонах цих клітин транспортуються у задню частку гіпофіза, звідки виводяться у кров. До нейрогормонів гіпоталамуса належать вазопресин (антидіуретичний гормон, ADH) окситоцин. Виділення ADH регулюється осмоляльністю плазми крові через осморецептори гіпоталамуса, а також об'ємом циркулюючої крові через барорецептори, локалізовані у клубочках шийної вени та дуги аорти. Окситоцин збільшує виділення молока під час лактації і викликає скорочення матки в часі пологів.
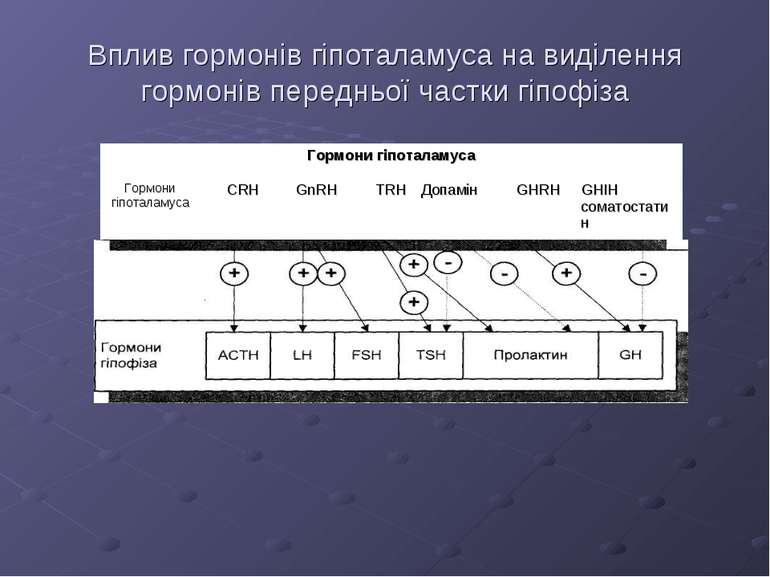
Передня частка гіпофіза виділяє наступні гормони: тиротропін (TSH), соматотропін (GH), адренокортикотропін (АСТН), лютеотропін (LH), фолікулотропін (FSH), пролактин. Тут також виділяється меланотропін (MSH), який у людини, очевидно, не грає суттєвої ролі. Під час синтезу АСТН утворюється короткий пептид - β-ліпотропін, що служить попередником ендорфінів, роль якого не встановлена. Утворення гормонів передньої частки гіпофіза регулюється гормонами гіпоталамуса. Клітини передньої частки гіпофіза є ефекторами для гормонів гіпоталамуса, і реагують на дію релізинг гормонів шляхом збільшення або зменшення секреції відповідних тропних гормонів. Тиротропін-релізинг гормон (TRH) активує виділення TSH і пролактину, гонадотропін-релізинг гормон (GnRH) активує секрецію LH і FSH, кортикотропін-релізинг гормон (CRH) стимулює виділення АСТН, а відкритий відносно недавно соматотропін-релізинг гормон (GH-RH) стимулює виділення соматотропіну (GH). Існує також соматостатин - гормон гіпотамуса, що гальмує виділення GH. Допамін, у свою чергу, гальмує виділення пролактину і TSH.
Вплив гормонів гіпоталамуса на виділення гормонів передньої частки гіпофіза Гормони гіпоталамуса Гормони гіпоталамуса CRH GnRH TRH Допамін GHRH GHIH соматостатин 1 І\ V \
Відомі три основних функціональних осі в системі гіпоталамус-гіпофіз-периферійний ендокринний орган: Гіпоталамо-гіпофізарно-наднирникова вісь (CRH-ACTH-кортизол). Гіпоталамо-гіпофізарно-тироїдна вісь (TRH-TSH-трийодтиронін/тироксин). Гіпоталамо-гіпофізарно-гонадна вісь (GnRH-LH/FSH-естроген/прогестерон у жінок, тестостерон у чоловіків). Функціональна взаєморегуляція відповідних гормональних ланок ґрунтується на системі зворотних зв'язків між гіпоталамусом, гіпофізом і периферійним ендокринним органом. Секреція гормонів з периферійних ендокринних залоз стимулюється тропними гормонами гіпофіза. У свою чергу, гормони периферійних ендокринних органів на основі механізму зворотного зв'язку гальмують секрецію тропних гормонів на рівні гіпофіза або гіпоталамуса
Порушення функції гіпоталамуса та гіпофіза зумовлюють гіпер- або гіпофункцію відповідної периферійної ендокринної залози. У процесі діагностики ендокринних порушень необхідно не тільки виявити гіпер- чи гіпофункцію, але й встановити, що є причиною цієї патології - порушення функції периферійної ендокринної залози, гіпофіза чи вищих центрів регуляції.
Діагностика гіперфункції Визначення основного рівня гормону в крові При гіперфункції ендокринної залози концентрація гормонів, як правило, підвищується. Однак, в окремих випадках, гіперфункція може супроводжуватися і нормальними показниками гормонального рівня. Особливі труднощі викликає розпізнання гіперфункції наднирників лише на основі визначення базової концентрації кортизолу в крові. Визначення добового ритму секреції гормону Гіперфункція ендокринної залози як правило супроводжується відсутністю добового ритму виділення гормону. Характерний добовий ритм виділення кортизолу зникає при синдромі Кушинга. Для дослідження ритму виділення гормону кров для аналізу слід забирати вранці (7.00-9.00) та опівночі. Тести, що пригнічують секрецію У цих тестах використовують речовини, які у нормальних дорослих людей викликають пригнічення виділення досліджуваного гормону. У осіб з гіперфункцією певної ендокринної залози введення "фізіологічних" доз інгібіторів на загал не викликає зменшення секреції. Наприклад, при аденомі гіпофіза не вдається досягти пригнічення виділення гормону росту шляхом навантаження глюкозою. Тест пригнічення секреції кортизолу і АСТН після введення дексаметазону (синтетичного стероїда, який не дає нашарування при визначенні кортизолу) служить для розпізнавання синдрому Кушинга і одночасно встановлення його причини. У пацієнтів із синдромом Кушинга, викликаним аденомою гіпофіза, зазвичай вдається загальмувати секрецію АСТН і кортизолу після введення високих доз дексаметазону, однак такого ефекту не можна досягти у більшості пацієнтів з ектопією продукції АСТН.
Тести, що стимулюють секрецію Ці тести використовуються для виявлення можливої відсутності відповіді на дію стимулятора. Ступінь гормональної регуляції виділення пролактину можна оцінити за допомогою тесту з TRH або метоклопрамідом. Виявлення недостатнього підвищення рівня гормону на фоні підвищеного базового рівня пролактину в сироватці крові свідчить про аденому. Пухлина гіпофіза може виділяти надмір одного з тропних гормонів (наприклад, гормону росту або пролактину) і одночасно зумовлювати зниження або пригнічення секреції інших гормонів, що продукуються клітинами, сусідніми з розростаючою пухлиною. Тому часто необхідно перевірити, чи насправді порушення видільних функцій гіпофіза мають свій клінічний прояв. Для цього служать функціональні тести. Великі пухлини гіпофіза можуть перетискати очні нерви і викликати сліпоту, інші пухлини позаендокринного походження, такі як краніофарингома, можуть також викликати порушення функцій гіпофіза і гіпоталамуса. Окрім того, слід пам'ятати, що гіперфункція периферійних ендокринних залоз може бути спричинена їх аденомою або раком, а не порушенням функції гіпоталамуса чи гіпофіза. Візуалізуючі дослідження ендокринних залоз (як рентгенографія, сцинтиграфія, ультрасонографія, комп'ютерна томографія) так само суттєві, як і біохімічні дослідження. Вибір методу дослідження залежить від залози, яку досліджують.
Діагностика гіпофункції Практичне визначення концентрації гормонів в крові Проведення цих досліджень в реальних умовах може складати певні труднощі з огляду на низьку концентрацію гормону. Часто дуже важко також відрізнити патологічно низьку концентрацію гормону від нижніх границь його норми. Тести, що стимулюють секрецію Ці тести часто використовуються для оцінки функції ендокринних залоз. Секреторна функція кори наднирників може бути досліджена з допомогою тесту з Синактеном. Він полягає у внутрівенному введенні АСТН (фрагмент 1-24), що безпосередньо стимулює кору наднирників
Гіпоталамо-гіпофізарно-наднирникова вісь Кортикотропін-релізинг гормон (CRH) стимулює виділення гіпофізом АСТН. Інші гормони гіпоталамуса, такі як вазопресин, також мають стимулюючий вплив на видільну активність цієї осі. Секреція АСТН має виражений добовий ритм; найнижча його концентрація у крові спостерігається вночі. АСТН стимулює наднирники головним чином до продукції кортизолу. Добовий ритм виділення кортизолу є віддзеркаленням ритму секреції АСТН. Кортизол за принципом зворотнього зв'язку гальмує виділення CRH гіпоталамусом і АСТН гіпофізом. Гіпоталамо-гіпофізарно-тироїдна вісь Тиротропін-релізинг гормон (TRH) гіпоталамуса стимулює виділення тиротропного гормону (TSH) з передньої частки гіпофіза. TSH, у свою чергу, стимулює виділення тироксину, який за принципом оберненого зв'язку гальмує секрецію TSH. Гіпоталамо-гіпофізарно-гонадна вісь Гіпоталамус продукує гонадотропін-релізинг гормон (GnRH), який контролює секрецію гіпофізом фолікулотропного (FSH) та лютеїнізуючого (LH) гормонів. FSH та LH разом впливають на перебіг менструального циклу у жінок. Лютеїнізуючий гормон у жінок зумовлює овуляцію і виникнення жовтого тіла, у чоловіків він стимулює продукцію тестостерону інтерстиційними клітинами яєчка. Фолікулотропний гормон зумовлює дозрівання фолікулів і продукцію естрогенів яєчниками. Естрогени за принципом оберненого зв'язку гальмують виділення GnRH гіпоталамусом і LH/FSH гіпофізом. Окрім того, секреція FSH додатково контролюється пептидним гормоном інгібіном.
Тести, що оцінюють функцію гіпофіза Більшість гормонів гіпофіза виділяється у кров пульсаційно і деякі з них мають добовий ритм секреції. Відомо також, що при вираженій клінічній недостатності гіпофіз може продукувати біологічно неактивні тропні гормони, які зберігають здатність до реакції з антитілами. Такі неактивні пептиди можна виявляти радіоімунологічними або імуноензимними методами. У зв'язку із вищевказаними причинами, діагностику гіпофункції гіпофіза слід проводити з використанням функціональних стимуляційних проб. Можливість використання синтетичних релізинг-гормонів гіпоталамуса або їхніх аналогів дозволила впровадити в діагностичну практику ряд тестів, що стимулюють гіпофіз для визначення в крові концентрації відповідного тропного гормону. Тест з TRH добре оцінює здатність гіпофіза до виділення TSH. При цьому довенно вводять 200 μг TRH, кров для визначення концентрації TSH забирають перед ін'єкцією, через 30 і 60 хв. Найвищий рівень TSH виникає у проміжку між 20 і 30 хв тесту, приріст концентрації гормону при цьому повинен перевищувати 2,0 мОд/л. У випадку патології гіпоталамуса пік підйому концентрації TSH запізнюється. Часто відсутність відповіді на стимулюючу дію TRH має вигляд плоскої кривої приросту концентрації TSH після введення TRH і спостері гається при пошкодженнях передньої частки гіпофіза; подібний результат тестування можна отримати також при гіперфункції щитовидної залози. У стимуляційній пробі виділення гонатропіну після довенної ін'єкції GnRH у дозі 100 μг визна чають концентрацію LH і FSH; при цьому концентрація LH повинна перевищити 15 Од/л, FSH - 2,0 Од/л. Тепер доступними є також інші засоби стимуляції передньої частки гіпофіза. CRH можна використовувати в тесті стимуляції продукції АСТН, соматотропін-релізинг гормон (GH-RH) - стимуляції секреції GH. Ці тести, однак, ще не набули широкого застосування у клінічній практиці. Стрес викликає збільшення секреції гіпофізом деяких гормонів, що впливають на активність гіпоталамуса. Це явище використовують функціональному тесті оцінки відповіді гіпоталамуса і гіпофіза на стрес, викликаний внутрішньовенним введенням інсуліну. У цьому тесті викликана інсуліном гіпоглікемія служить стимулятором секреції гіпофіза.
У гіпоглікемічному тесті інсулін вводять довенно переважно в дозі 0,15 Од/кг маси тіла; забір крові для аналізу здійснюють перед ін'єкцієкцією через 30, 45, 60, 90 і 120 хв. з метою визначенню концентрації глюкози, кортизолу і гормону росту. Дозу інсуліну слід зменшити при підозрі на підвищену чутливість до цього гормону, наприклад, при недостатності гіпофіза; у пацієнтів зі зниженою чутливістю до інсуліну, наприклад, при акромегалії та синдромі Кушинга дозування слід збільшити. Проведення інсулінового тесту вимагає постійної присутності лікаря. Після закінчення дослідження пацієнта слід наситити вуглеводами. Протипоказами до проведення цього тесту є хвороби серця та епілепсія. Пацієнтам, у яких розвинулась надмірна гіпоглікемія, слід зробити ін'єкцію глюкози довенно, не припиняючи при цьому проведення тесту, тобто продовжуючи забір проб крові для аналізу: оскільки викликаний гіпоглікемічний стрес був достатнім секреторним стимулом, немає потреби наражати пацієнта на незручності, пов'язані з повторним дослідженням. У процесі виконання інсулінового тесту, як і поєднаної проби на активність передньої частки гіпофіза, потрібно переконати ся, що досягнуто достатнього рівня гіпоглікемії (концентрація глюкози повинна впасти нижче 2.2 ммоль/л). У противному випадку результати дослідження слід визнати некоректними. Гіпофіз відповідає на гіпоглікемію підвищенням секреції АСТН і GH. У рутинних лабораторних дослідженнях, замість визначення концентрації АСТН, визначають рівень кортизону. В нормі приріст концентрації кортизолу при проведенні тесту повинен перевищити 200 нмль/л з піком понад 500 нмоль/л. Концентрація GH у будь-якому з часових відрізків повинна перевищувати 20 мОд/л. Поєднаний тест стимуляції активності передньої частки гіпофіза полягає в одночасному довенному введенні інсуліну, TRH і GnRH. Цей ест виконують у пацієнтів з підозрою на недостатність гіпофіза або після нейрохірургічного лікування пухлин гіпофіза з метою оцінки секреторної активності залишків паренхіми цього органа. Загалом у хворих після хірургічного лікування мають місце порушення секреторної функції гіпофіза різного ступеня вираженості; ці ускладення доволі часто зустрічаються навіть у високоспеціалізованих клінічних центрах.
Гормон росту (GH) Надмірне виділення гормону росту, що найчастіше зустрічається при пухлинах гіпофіза, зумовлює розвиток клінічної картини акромегалії у дорослих або гігантизму у дітей і підлітків. Виявлення акромегалії ґрунтується на визначенні концентрації гормону росту в сироватці крові. У фізіологічних умовах секреція GH здійснюється пульсаційно з інтервалом у кілька десятків хвилин. Рівень гормону між викидами може бути нижчим рівня чутливості методу. Виділення GH має також свій добовий ритм; пік секреції припадає на перші дві години сну. Значна кількість зовнішніх факторів - як фізичне перенавантаження, емоційний і больовий стрес (зумовлений, зокрема, невмілим забором крові), тривале голодування, споживання збагаченої білком (аргініном) їжі стимулюють виділення гормону росту. З огляду на вищесказане, одноразове визначення концентрації GH може бути недостатнім для повновартісної діагностики. Як правило, необхідні повторні аналізи протягом дня з метою виявлення існуючої патології. Визначення змін концентрації GH крові після навантаження глюкозою є найрепрезентативнішим діагностичним тестом акромегалії. Ознакою патології служить аномальна крива росту концентрації глюкози, яка нагадує відповідний графік при цукровому діабеті, однак вирізняється браком пригнічення секреції GH. У здорових осіб тестування супроводжується падінням концентрації цього гормону нижче 3 мОд/л. У хворих на акромегалію навантаження глюкозою часто супроводжується парадоксальним ростом концентрації GH. Понад 50% випадків акромегалії супроводжуються посиленням викиду GH після введення TRH; подібний ефект стимуляції GnRH має місце у 20-30% випадків.
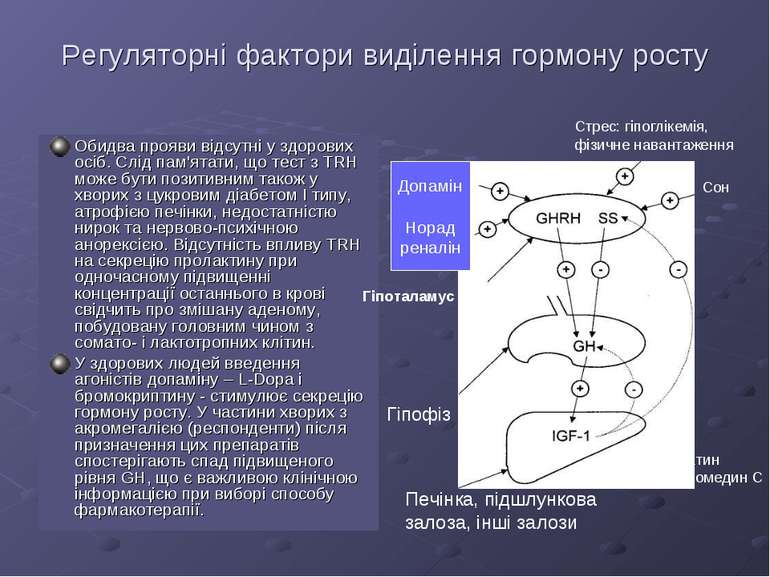
Регуляторні фактори виділення гормону росту Обидва прояви відсутні у здорових осіб. Слід пам'ятати, що тест з TRH може бути позитивним також у хворих з цукровим діабетом І типу, атрофією печінки, недостатністю нирок та нервово-психічною анорексією. Відсутність впливу TRH на секрецію пролактину при одночасному підвищенні концентрації останнього в крові свідчить про змішану аденому, побудовану головним чином з сомато- і лактотропних клітин. У здорових людей введення агоністів допаміну – L-Dopa і бромокриптину - стимулює секрецію гормону росту. У частини хворих з акромегалією (респонденти) після призначення цих препаратів спостерігають спад підвищеного рівня GH, що є важливою клінічною інформацією при виборі способу фармакотерапії. Допамін Норад реналін Гіпоталамус Гіпофіз Печінка, підшлункова залоза, інші залози Стрес: гіпоглікемія, фізичне навантаження Сон SS-соматостатин IGF-1 – соматомедин С
При доступності методики визначення IGF-1 (соматомедину С), це дослідження може бути дуже цінним клінічно. Оскільки продукцію соматомедину С печінкою та іншими органами стимулює GH, концентрація IGF-1 у крові хворих на акромегалію буде підвищеною. Постулюється можливість використання IGF-1 для скринінгу, а також контролю ефективності лікування акромегалії. Недостатність GH у дітей веде до гальмування росту. У дорослих клінічні прояви недостатності соматотропної функції виявити важко, хоча сучасні дані свідчать про вплив GH на добре самопочуття і підтримання м'язової маси тіла. У довільно взятих для аналізу пробах крові концентрація GH може бути нижчою рівня чутливості методу навіть у здорових дітей. У цих випадках діагностика недостатності цього гормону вимагає використання стимуляційних тестів. Як видно із вищесказаного, на секрецію GH впливає значна кількість внутрішніх чинників. На цій основі запропоновано багато тестів, придатних для клінічного використання. Найменш інвазивним і найуживанішим діагностичним тестом недостаності гормону росту у дітей є тест фізичного навантаження, який звичайно проводять із використанням велоергометра. Слід, однак, зазначити, що за результатами цього тесту нормальні показники визначаються лише у 70 % практично здорових дітей. Клінічно використовуються також тести з аргініном, клонідином, L-Dopa, бромокриптином, і, нарешті, з GH-RH. У важких діагностичних випадках необхідно визначити, чи існує пік викиду гормону росту в перші години сну. Таке дослідження, однак, доступне лише у високоспеціалізованих центрах. Підтвердити недостатність GH у дітей можна щонайменше за результатами двох стимуляційних тестів, оскільки ґрунтуючись на результатах лише одного тесту можна дійти помилкових висновків.
Пролактин Підвищена концентрація пролактину в крові гальмує пульсаційне виділення GnRH, що, у свою чергу, знижує секрецію гонадотропінів і у кінцевому результаті призводить до падіння рівня гормонів гонад. Висока концентрація пролактину блокує також продукцію LH і FSH на рівні яєчників і яєчок. Обидва цих механізми при гіперпролактинемії призводять до неплідності, імпотенції, порушень менструального циклу, інколи у супроводі спонтанної лактації. Найчастіше гіперпролактинемію зумовлює аденома гіпофіза. З цього огляду всі пацієнти з підвищенням концентрації пролактину в крові потребують докладного обстеження. У фізіологічних умовах виділення пролактину здійснюється пульсаційно з півторагодинним інтервалом і, у відповідності з добовим ритмом, головним чином вночі. Багато внутрішніх факторів, таких як стрес, фізичне перенавантаження, перегрів організму, подразнення сосків молочних залоз, стимулює секрецію гормону. Подібно до цього, ряд медикаментів, гальмуючи на основі різних механізмів продукцію допаміну, збільшує рівень пролактину. Пошкодження гіпоталамуса, патологічний процес над турецьким сідлом з перетисканням гіпофізарної ніжки, також можуть спричинювати гіперпролактинемію.
Діагноз пролактин-продукуючої аденоми гіпофіза не повинен ставитися на основі визначення лише одного показника - підвищеної концентрації пролактину в крові, хоча деякі автори вважають, що значне підвищення рівня пролактину (> 2 500 мОд/л) вже при першому виявленні може свідчити про наявність пухлини. Ми рекомендуємо кількаразове визначення концентрації пролактину протягом 24 год, що дозволяє дослідити добовий ритм виділення цього гормону. Клінічно для дифиренційної діагностики гіперпролактинемій вживаються стимуляційні тести з використанням TRH, хлорпромазину чи метохлопраміду, антагоністів допаміну. Інтерпретація цих тестів полягає в оцінці росту секреції пролактину у відповідь на стимуляцію. Відсутність реакції-відповіді у поєднанні із значним підвищенням основного рівня пролактину свідчить на користь аденоми гіпофіза з автономним виділенням гормону. Підвищений викид пролактину (при нормальній або підвищеній його концентрації) після введення TRH або метоклопраміду свідчить про гіпоталамічне походження періодичної або постійної гіперпролактинемії. Гальмівні тести не мають жодного значення в діагностиці гіперпролактинемії. Введення L-Dopa чи бромокриптину зменшує підвищену концентрацію пролактину незалежно від причини цього підвищення. Слід пам'ятати, що підвищена концентрація гормону спостерігається у частини пацієнтів з недостатністю щитовидної залози, наднирників чи з захворюваннями нирок. Збільшення секреції пролактину можна виявити у вагітних жінок (починаючи з 6 тижня вагітності), а також при вживанні естрогенів.
Вазопресин (ADH) Порушення синтезу ADH у гіпоталамусі зумовлює клінічні симптоми нецукрового діабету центрального походження. Порушення дії ADH на рівні дистальних ниркових канальців обумовлює розвиток нецукрового нефрогенного діабету. Більш ніж у 70% випадків етіологія набутого нецукрового діабету залишається невизначеною. У решті випадків причиною служать пошкодження голови, нейрохірургічні втручання, первинні і вторинні внутрішньочерепні пухлини, запальні процеси оболонок основи мозку, а також деякі системні захворювання. Причиною виникнення нецукрового нефрогенного діабету служать відсутність або пошкодження рецепторів ADH в дистальних канальцях нефронів. Недостатність ADH зумовлює підвищене виведення води з сечею (поліурія), що призводить до зростання осмольності тканинної рідини і гіпернатріємії. Це, у свою чергу, компенсаторно викликає хворобливе відчуття спраги (полідипсія), що запобігає подальшому обезводненню. При нецукровому діабеті осмольність сечі постійно залишається зниженою. Діагностика нецукрового діабету грунтується на незводнювально-вазопресиновому тесті. Після сніданку і споживання звичного об'єму рідини пацієнта зважуюють і беруть кров для аналізу осмольності і концентрації натрію в плазмі. З цього моменту досліджуваний не приймає рідини. Фіксують час, об'єм і осмольність кожної порції виділеної сечі. Цей тест може бути небезпечним, тому пацієнт повинен бути під постійним наглядом, слід також контролювати масу тіла, тиск крові і роботу серця. Тестування слід перервати коли втрата ваги складе більш як 3% вихідної маси тіла або виникнуть клінічні прояви значного обезводнення. Найчастіше при наявності нецукрового діабету час тестування не перевищує 8 год. У здорових осіб осмольність сечі повинна зрости понад 600 мосмоль/кг, а у міжклітинній рідині не перевицущувати 300 мосмоль/кг. У хворих з нецукровим діабетом осмольність сечі залишається низькою (> 270 мосмоль/кг), а у міжклітинній рідині зростає понад 300 мосмоль/кг. Для завершення тестування пацієнтові призначають DDAVP - синтетичний аналог вазопресину. Згущення сечі після введення DDAVP свідчить про нецукровий діабет центрального походження, відсутність відповіді - про нецукровий нефрогенний діабет.
Концентрацію ADH можна визначати безпосередньо в крові, однак ця методика є важкою до відтворення, працеємною і дотепер не знайшла широкого застосування. Слід пам'ятати, що секрецію ADH гальмує введення адреналіну, атропіну, амфетаміну і етанолу. Надмірне виділення ADH має назву синдрому аномального виділення вазопресину (syndrome of inappropriate vasopressin secretion; SIADH) або синдрому Шварца-Бартера. Причиною цього синдрому найчастіше служать ектопічна продукція ADH зумовлена неоплазією, головним чином дрібноклітинним раком бронхів, раком острівців підшлункової залози чи тимуса. Іншою причиною цього синдрому може бути запалення легеневої тканини, яка навіть у фізіологічних умовах продукує певну кількість ADH. Синдром гіперпродукції вазопресину спостерігають також при запаленні мозку і його оболонок, пухлинах нервової системи або, як перехідне явище, після великих хірургічних втручань. Надмір ADH зумовлює надмірне всмоктування води у нирках, що веде до зменшення діурезу, міжклітинного набряку і водної інтоксикації. SIADH супроводжується падінням концентрації натрію в крові і осмоль-ності тканинної рідини у поєднанні з підвищеною осмольністю сечі. Вищеописаний синдром слід диференціювати від інших захворювань, що супроводжуються гіпонатріємією, спричиненою втратою об'єму циркулюючої крові. У цих випадках спостерігають клінічні прояви позаклітинного незводнення, підвищення концентрації сечовини в сироватці крові. Вважають, що синдром Шварца-Бартера не може бути діагностований без виявлення зменшеної концентрації сечовини і креатиніну в крові. Зниження концентрації натрію виявляють у людей з надмірним споживанням води або пива, при хворобах нирок, порушеннях циркуляції чи атрофії печінки, а також хворобі Аддісона. Слід також пам'ятати про псевдонатріємію у важких випадках гіперліпопротеїнемії або екстремальній гіпер-протеїнемії (плазмоцитома).
Оцінка функції кори наднирника Кора наднирника людини виділяє велику кількість різноманітних стероїдних гормонів, але лише два з них - кортизол і альдостерон - є життєвонеобхідними. Кортизол є основним глюкокортикоїдом, тоді як альдостерон - основний мінералокортикоїд. Кожен із згаданих гормонів синтезується в окремих частинах кори наднирника - як з огляду на гістологічну будову, так і специфічний ензимохімічний склад. Зовнішня частина кори наднирника має назву клубочкового шару; вона єдина проявляє активність С-18 оксидази, що є ключовим ензимом синтезу альдостерону. Середня і внутрішня частини кори наднирника мають назву пучкового і сітчастого шарів, відповідно; у обох цих шарах здійснюється процес ензиматичного вмонтовування гідроксильних груп у 17 позицію стероїдного кільця. У пучковому та сітчастому шарах кори наднирника продукується переважно кортизол, а також, у меншій мірі, решта гормонів наднирника: глюкокортикоїди, мінералокортикоїди, а також менш активні андрогени і естрогени. Секреція кортизолу стимулюється через адренокортикотропін (АСТН) - поліпептидний гормон, продукований середньою часткою гіпофіза. Виділення АСТН, у свою чергу, активується іншим пептидом, що продукується гіпоталамусом – кортикотропін-релізінг фактором. Виділення альдостерону знаходиться під контролемренін-ангіотензинової системи, яка активується при скороченні припливу крові до нирок і зменшення міжклітинного простору.
Недостатність кори наднирника Зменшення рівня кортизолу в крові проявляється як первинна або вторинна недостатність кори наднирника. При первинній недостатності, коли під впливом пошкоджувального фактора руйнується кора обох наднирників, виявляють нестачу глюкокортикоїдів, мінералокортикоїдів і андрогенів наднирників. У хворих з недостатністю кори наднирника нестача всіх трьох груп гормонів може проявлятися значно підвищеною потребою солі, ослабленням сили м'язів, втомлюваністю, головокружінням при вставанні, зниженням артеріального тиску (може розвиватись навіть ортостатичний колапс), затримкою менструації у жінок, а також втратою волосся на голові та лобку. У лабораторних дослідженнях знаходять гіперкаліємію, гіпонатріємію, підвищену концентрацію сечовини і креатиніну, ацидоз та гіпоглікемію натще. Прояви водноелектролітних порушень зумовлені втратою здатності де підтримання натрієвого гомеостазу організму з усіма наслідками, що з цього витікають. Падіння концентрації кортизолу в плазмі крові за механізмом зворотного зв'язку зумовлюють розблокування виділення АСТН; клінічним проявом цього служить підвищена пігментація шкіри. Первинна недостатність кори наднирника (хвороба Аддісона) раніше була наслідком перенесеного туберкульозу, тепер вона звичайно розвивається на основі автоімунних порушень або спричиняється ятрогенними факторами, як, наприклад, тривалим лікуванням глюкокортикоїдами чи хірургічним видаленням кори наднирника. Існують численні автоімунні захворювання, у результаті яких може розвиватися недостатність кори наднирників Цю патологію можуть також викликати грибкові інфекції. СНІД, медикаменти, кровотеча з рубцюванням кори наднирника, амілоїдоз, злоякісні новоутвори тощо. При первинній недостатності кори наднирників концентрація кортизолу у плазмі крові зменшена, добовий ритм секреції цього гормону слабо виражений або відсутній, відповідь на стимуляцію АСТН або його синтетичними аналогами ослаблена. При діагностиці первинної недостатності кори наднирників, окрім визначення в плазмі крові рівня кортизолу і, інколи, АСТН, слід також вимірювати концентрацію сечовини, креатиніну, електролітів, глюкози натще. Станом, що вимагає гострого втручання, є гостра недостатність кори наднирників. Для діагностики цієї патології істотним є визначення концентрації кортизолу і АСТН в плазмі крові, однак якщо наявні клінічні прояви гострої недостатності кори наднирників, з початком лікування не слід зволікати до отримання результатів тестування. Для початку лікування достатнім є визначення кислотно-лужної рівноваги, концентрації електролітів, креатиніну і сечовини.
Вторинна недостатність кори наднирників При цій формі патології в плазмі крові зменшена концентрація кортизолу і АСТН, а концентрація альдостерону, з огляду на відсутність пошкодження кори наднирників, знаходиться в межах норми. Можливе вибіркове падіння концентрації АСТН, зумовлене пошкодженням гіпоталамуса або гіпофіза, однак така патологія зустрічається дуже рідко. Методом диференційної діагностики є тест стимуляції АСТН або Синактеном, при якому кора наднирників зберігає здатність до підвищеної секреції кортизолу.
Вроджена гіперплазія наднирників (наднирково-генітальний синдром) Синтез глюкокортикоїдів і інших стероїдів полягає у ензиматичній перебудові кільця циклопентанопергідрофенантрену. Включення до цього кільця функціональних груп гідроксилу у позиціях С-17, С-21, С-11 і С-18 зумовлено відповідною концентрацією і активністю специфічних ензимів. Дефект або недостатність одного з ензимних білків може привести до зниження концентрації кортизолу в плазмі крові; це зумовлює зростання секреції АСТН, що у кінцевому результаті веде до гіпертрофії кори наднирників і зростання в плазмі крові концентрації проміжних метаболітів синтезу глюкокортикоїдів. Деякі з цих речовин нагромаджуються у значній кількості і імітують активність мінералокортикоїдів чи андрогенів; проявом цього є виникнення гіпертензії, вірилізму або гірсутизму. Найчастіше у населення Европи та США зустрічається недостатність 21-гідроксилази. Вона виявляється з частотою від 1:5000 до 1:15000 новонароджених. Викликана ензимною недостатністю концентрація кортизолу в плазмі крові є надто низькою для гальмування секреції АСТН, що у кінцевому результаті веде до нагромадження попередників стероїдогенезу, які беруть участь у атипових метаболічних циклах. Наслідком цих порушень є надвишок рівня андрогенів з відповідними клінічними проявами. У деяких випадках при недостатності 21-гідроксилази, окрім падіння концентрації кортизолу, в плазмі крові виявляється також знижена концентрація альдостерону.
Гіперфункція кори наднирників При підозрі на гіперфункцію кори наднирників слід чекати підвищення концентрації кортизолу в плазмі крові. Кожне порушення, що супроводжується надлишком глюкокортикоїдів, зумовлює прояви так званого синдрому Кушинга. У випадках аденоми чи раку кори наднирників підвищення рівня кортизолу в плазмі крові супроводжується падінням рівня АСТН. Ріст концентрації АСТН і спричинений цим підйом рівня кортизолу супроводжує патологію гіпоталамуса і гіпофіза, а також ектопію продукції АСТН. Надмір концентрації кортизолу, як наслідок підвищеної секреції АСТН гіпофізом, визначається як хвороба Кушинга. У дорослих підвищений рівень кортизолу у 68% випадків зумовлений хворобою Кушинга, у 15% - ектопією продукції АСТН, у 15% - пухлинами наднирників і в 1% - двосторонньою гіперплазією наднирників без підвищення концентрації АСТН. У дітей етіологіюпідвищеної концентрації кортизолу складають: хвороба Кушинга - 50-70%, пухлини наднирників - 30-50%, пухлини з ектопією продукції АСТН - 20% і гіперплазія наднирників без надпродукції АСТН - 1%. Хвороба Кушинга у 90% випадків є наслідком аденоми гіпофіза, решту 10% зумовлює гіперплазія гіпофіза. Стрес і травми можуть суттєво змінювати функціонування осі гіпоталамус-гіпофіз-наднирники і з цього огляду ускладнювати діагностику порушень продукції кортизолу. Більшість тканин містить рецептори глюкокортикоїдів і у ситуаціях, що супроводжуються підвищеною секрецією цього гормону, можуть реагувати на його дію по-різному. Це є однією з причин різноманіття клінічних проявів синдрому Кушинга. Можливість помилкової діагностики синдрому Кушинга на основі наслідків біохімічних і радіологічних досліджень складає близько третини усіх випадків.
При діагностиці синдрому Кушинга необхідно враховувати: Виявлення підвищеної секреції кортизолу (підвищена концентрація кортизолу у плазмі крові і зміна добового ритму його виділення, надмірне виділення кортизолу з сечею, тощо) Встановлення зв'язку гіперкортизолемії з підвищенням концентрації АСТН в плазмі крові (ріст концентрації АСТН свідчить про гіпоталамічно-гіпофізарне походження гіперфункції кори наднирника) У ситуаціях, що супроводжуються підвищенням концентрації АСТН в плазмі крові, необхідна диференційна діагностика хвороби Кушинга і ектопії виділення АСТН.
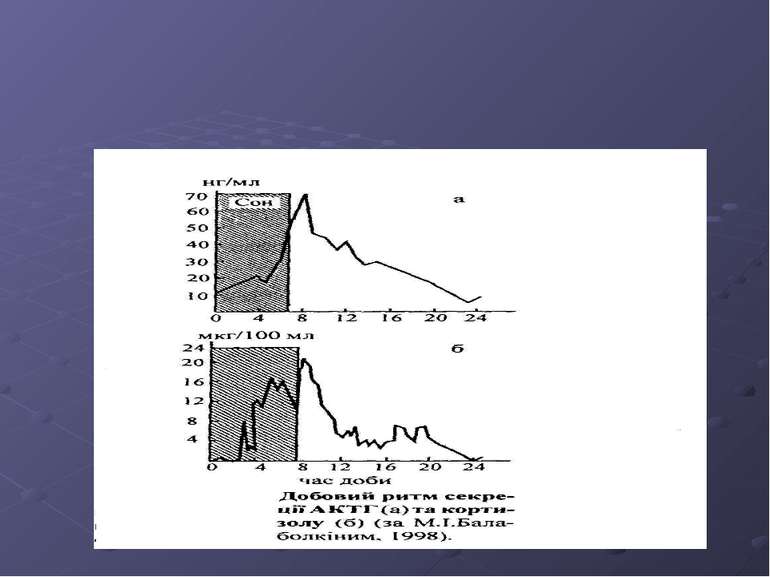
Лабораторна діагностика недостатності кори наднирника 1. Концентрація кортизолу в плазмі крові Визначення концентрації кортизолу в плазмі крові є вузловим моментом в оцінці осі гіпоталамус-гіпофіз-наднирники; цей показник, однак, має незначну діагностичну цінність при визначенні лише основного рівня кортизолу. Секреція кортизолу має добовий ритм: найвищий рівень цього гормону в плазмі (190-700 нмоль/л) виявляється вранці, між 16.00 і 17.00 год його концентрація падає вдвічі, близько півночі рівень стає найнижчим. Для виявлення недостатності кори наднирників кров для аналізу повинна бути забрана між 8.00 і 9.00; наслідком пізнішого забору крові може бути штучне заниження значень досліджуваного показника. На основі визначення лише показників основної концентрації кортизолу не можна оцінити реакцію осі гіпоталамус-гіпофіз-наднирник на стрес. Уваги потребує кожен конкретний випадок виявлення низького основного рівня кортизолу в плазмі крові. Зараз у лабораторній практиці методи радіо-імунологічного визначення концентрації кортизолу все більше замінюються імунофлюориметричними методами. У багатьох випадках використання глюкокортикоїдів (преднізону і преднізолону) для медикаментозної терапії спричиняє перехресні реакції, що часто ускладнює інтерпретацію отриманих результатів.
2. Концентрація АСТН в плазмі крові Визначення концентрації АСТН (кортикотропіну) в плазмі крові є важливим тестом для підтвердження виявленої первинної недостатності кори наднирників (хвороби Аддісона) Концентрацію АСТН визначають імунологічними методами (immunoassay або immuno-metric assay). Специфічність тесту можна підвищити, якщо перед виконанням дослідження здійснити хроматографію на колонці, однак ця процедура потребує багато часу. Нормальна концентрація АСТН в плазмі кров коливається в межах 20-100 нг/л. При первинній недостатності кори наднирників рівень АСТН в плазмі крові значно підвищується (> 200 нг/л при одночасному зменшенні рівня кортизолу. При визначенні концентрації АСТН в плазмі пробу крові слід помістити у пластикову (або скляну силіконовану) пробірку з ЕДТА в якості антикоагулянта охолодити на льоді і відокремити плазму при 4° С. Пробу слід зберігати замороженою при температурі -20°С аж до моменту виконання вимірювання.
3. Стимуляція виділення кортизолу АСТН Здатність кори наднирників до виділення кортизолу оцінюється тестуванням з Синактеном. Синактен є синтетичним аналогом АСТН, що складається з 24 початкових амінокислот цього гормону. Для проведення тестування дом'язово або підшкірно вводять 250 мг Синакте-ну. Пробу крові для аналізу беруть безпосередньо перед та через 30 і 60 хв після введення Синактену. Щоб отримати додаткову інформацію про основний рівень кортизолу, тестування проводять вранці. Критерієм адекватної відповіді кори наднирників на дію АСТН найчастіше служить підйом концентрації кортизолу при виконанні цього тесту на 250 нмоль/л, з перевищенням основного рівня 500 нмоль/л. Ріст концентрації кортизолу у відповідь на повторне дом'язове введення АСТН може бути дещо слабшим. Описаний вище скорочений тест стимуляції Синактеном дозволяє оцінити відповідь кори наднирників на дію стимулюючого агента, але він не дає уявлення про реакцію гіпоталамуса і гіпофіза на стрес чи гіпоглікемію. Тому при використанні скороченого тест}' з Синактеном для дослідження осі гіпоталамус-гіпофіз-наднирнників, значна частина порушень на рівні гіпоталамуса чи гіпофіза може залишитись недіагностованими. Хворим з виявленими порушеннями відповіді наднирників на дію стимулятора у скороченому тесті з Синактеном, можна призначити тестування у подовженій формі. Подовжене тестування з Синактеном дозволяє диференціювати первинну і вторинну недостатність кори наднирників. Для проведення цього тестування протягом трьох днів дом'язово вводять Синактен; зранку четвертого дня забирають кров для визначення концентрації кортизолу. Для пацієнтів з первинною недостатністю кори наднирників характерна відсутність підйому рівня кортизолу в плазмі крові у відповідь на стимуляцію (концентрація кортизолу < 200 нмоль/л); у пацієнтів з вторинною недостатністю кори наднирників рівень кортизолу зростає понад 200 нмоль/л відносно основної концентрації, однак реакція на дію стимулятора розвивається із запізненням порівняно із здоровими особами.
4. Проба з Метирапоном (метопіроном) Метирапон є інгібітором останнього етапу синтезу кортизолу, оскільки він блокує активність 11-гідроксилази - ензиму, що каталізує перетворення 11-дезоксикортизолу у кор-тизол. У здорових осіб введення Метирапону супроводжується зменшенням концентрації кортизолу в плазмі крові, що у кінцевому результаті розблоковує секрецію АСТН; наслідком зрослого впливу АСТН на кору наднирників є активація метаболічного шляху синтезу кортизолу до етапу ензимного блоку, тобто до етапу нагромадження 11-дезоксикортизолу. У відповідності із стандартною процедурою, запропонованою Liddle у 1959 році, Метирапон приймають ентерально кожні 4 год у дозі 750 мг на добу; для визначення виділення з сечею 17-кортикостероїдів після ведення Метирапону, протягом трьох послідовних діб, починаючи з доби, що передує тестуванню, проводять збір добової сечі. Свідченням надмірної секреції АСТН, викликаної недостатністю рівня кортизолу, є надмір виділення з сечею 17-гідроксикортикостероїдів. Спрощена процедура проби з Метирапоном запропонована Jubiz і співавт. При цьому, одноразову дозу Метирапону в кількості 3 г або 30 мг/кг маси тіла хворий приймає опівночі з незначною кількістю їжі. Пробу крові забирають вранці наступного дня між 8.00 і 9.00 з метою визначення концентрації в плазмі 11-дезоксикортизолу і/або АСТН. Результат тестування вважають нормальним, якщо рівень 11-дезоксикортизолу перевищує 200 нмоль/л. Для підтвердження гальмування синтезу кортизолу Метирапоном, додатково визначають концентрацію цього гормону в плазмі крові. Такий спосіб тестування з Метирапоном є найзручнішим і найчастіше застосовується у клінічній практиці при підозрі на недостатність кори наднирників. На відміну від скороченого тесту з Синактеном, при якому досліджується лише функція кори наднирників, проба з Метирапоном дозволяє оцінити функцію цілої осі гіпоталамус-гіпофіз-наднирники. Результати тестування з Синактеном можуть бути нормальними у пацієнтів, котрі приймають стероїди або у пацієнтів після попередньої гіпофізектомії; лише дослідження функціонування осі гіпоталамус-гіпофіз-наднирники при проведенні тесту з Метирапоном дозволяє розпізнати існування цих порушень. Значення і діагностична цінність тесту з Метирапоном подібні до цих показників тесту післяінсулінової гіпоглікемії, однак тест з Метирапоном зручніший як для пацієнта, так і для медичного персоналу. Описані окремі випадки розвитку кризу наднирників як наслідок тестування з Метирапоном протягом 24 год, однак подібні ускладнення не виникають при одноразовому тестуванні з Метирапоном. З огляду на безпеку пацієнта і зручність для медичного персоналу, до широкого клінічного використання рекомендований тест з Метирапоном, що грунтується на одноразовому оральному введенні цього препарату (Kirby і співавт., 1992).
5. Тест стимуляції гіпоглікемією Цей тест - подібно до тесту з Метирапоном -використовують для дослідження резервів гіпофіза щодо продукції АСТН. Він може бути використаний також для дослідження резервів продукції гормону росту (GH). Протипоказа-ми до виконання цього тесту є епілепсія або ішемічна хвороба серця. Тестування слід проводити під постійним медичним контролем. Дослідження виконують вранці натще; потрібно взяти кров для визначення основних концентрацій кортизолу і глюкози, після чого довенно ввести інсулін в дозі 0,05-0,3 Од/кг маси тіла. Доза інсуліну залежить від очікуваної резистентності до його дії. При проведенні дослідження необхідно передбачити можливість введення гідрокортизону і декстрози у випадку розвитку надмірної гіпоглікемії. Проби крові забирають кожні 30 хв протягом 2 годинного періоду. Для достатньої стимуляції осі гіпоталамус-гіпофіз-наднирники необхідно викликати клінічні прояви гіпоглікемії (пітливість, тахікардія), а також отримати біохімічне підтвердження гіпоглікемії (концентрація глюкози < 2 ммоль/л). Якщо у процесі тестування виникає необхідність введення декстрози, забір проб крові для аналізу не переривають з метою подальшого визначення рівня кортизолу; загальновизнано, що гіпоглікемічний тест є достатнім стимулом для активації досліджуваної гормональної осі. Результати тестування гіпоглікемією вважають нормальними, якщо рівень кортизолу в плазмі крові, визначений у довільному часовому відрізку, зростає більш як на 200 нмоль л відносно вихідного рівня і перевищує величину 500 нмоль/л. Як вже було зазначено вище, інтерпретація результатів тестування подібна до інтерпретації результатів стимуляції при одноразовому оральному прийомі Метирапону. Гіпоглікемічний тест є більш клопітким для пацієнта, оскільки вимагає амбулаторної підготовки. Пацієнтам, у яких виявлено навіть незначне зменшення резерву продукції АСТН у відповідь на гіпоглікемію або введення Метирапону, слід призначати синтетичні аналоги глюкокортикостероїдів у ситуаціях, коли вони можуть бути необхідими: оперативне лікуавння, травма, хвороба.
Лабораторна діагностика гіперфункції наднирників Концентрація кортизолу в плазмі крові При визначенні концентрації кортизолу в ранкових пробах крові приблизно в третині випадків синдрому Кушинга виявляються нормальні показники рівня цього гормону. Частіше синдром Кушинга супроводжується зникненням добового ритму виділення кортизолу; тому для підтвердження гіперкортизолемії важливим є дослідження секреції кортизолу протягом доби, грунтуючись на визначенені його основної концентрації в плазмі крові між 17.00-18.00 та 23.00-24.00. З огляду на можливість короткотривалої гіперкортизолемії, визначення лише основної концентрації кортизолу не повинно використовуватися для скринінгу синдрому Кушинга.
Виділення вільного кортизолу з сечею Усе частіше при діагностиці синдрому Кушинга відмовляються від визначення екскреції з сечею 17 ОН-кортикостероїдів, визначаючи взамін виділення вільного кортизолу. Визначення концентрації вільного кортизолу в сечі віддзеркалює концентрацію цього гормону в плазмі крові в момент забору сечі. Цей показник дозволяє виявити порушення виділення кортизолу протягом доби, що неможливо при одноразовому визначенні концентрації кортизолу в плазмі крові. Окрім того, синдром Кушинга супроводжується порушенням зв'язування кортизолу з відповідним білком (CBG) плазми крові, що зумовлює підвищення концентрації вільного кортизолу в плазмі і збільшен-ння його екскреції з сечею. Концентрацію вільного кортизолу в сечі найкраще визначати за допомогою кортизол-зв'язуючих антитіл. Залежно від їхньої специфічності, щоб запобігти виникненню перехресних реакцій з іншими глюкокортикостероїдами або їх метаболітами, інколи рекомендують провести екстракцію вільного кортизолу з сечі за допомогою органічного розчинника. У клінічній практиці найбільше клопотів створює збір добової сечі. У здорових осіб за добу з сечею виділяється 20-120 мг вільного кортизолу.
Концентрація АСТН в плазмі крові Визначення концентрації АСТН в плазмі крові має обмежене значення для діагностики синдрому Кушинга. Концентрацію цього гормону визначають з використанням специфічних антитіл. Нормальна концентрація АСТН в плазмі крові складає 20-100 нг/л. У пацієнтів з пухлинами кори наднирників надмірна секреція кортизолу зумовлює пригнічення секреції АСТН гіпофізом і, як наслідок, падіння рівня цього гормону в крові. При синдромі Кушинга, спричиненому вторинною недостатністю кори наднирників (наприклад, при аденомі гіпофіза), рівень АСТН в крові помірно або значно підвищений. У частини пацієнтів з ектопією виділення АСТН концентрація цього гормону в плазмі значно підвищена і наближається до значень цього показника у пацієнтів з вторинною гіперфункцією кори наднирників. Ектопічно продукований АСТН часто має змінену будову і вищу молекулярну масу, порівнюючи з нативним гормоном. Нерідко такий структурно змінений гормон не вдається виявити за допомогою стандартних антитіл. Важливими в аспекті диференційної діагностики і встановлення етіології синдрому Кушинга є функціональні тести (наприклад, тест з Метирапоном.
Тест пригнічення дексаметазоном Стандартний тест пригнічення малою дозою дексаметазону вперше з діагностичною метою використав Liddle. При класичній формі тестування дексаметазон приймають кожні 6 год протягом 2 днів, після чого визначають концентрацію кортизолу в плазмі крові. Відсутність падіння рівня кортизолу нижче 50 нмоль/л вказує на синдром Кушинга. Ймовірність отримання помилково-позитивних результатів на основі такого тестування складає 3-8% усіх випадків. Значно зручнішим є метод одноразового прийому дексаметазону. При цьому пацієнт опівночі приймає 1 мг дексаметазону, між 8.00 і 9.00 наступного ранку у нього беруть кров для визначення концентрації кортизолу. Результати цього тестування близькі до результатів, отриманих після прийому поділених доз дексаметазону протягом двох діб. У здорових осіб секреція кортизолу значно пригнічується; якщо за точку відліку приймати 200 нмоль/л, чутливість тесту з одноразовим прийомом дексаметазону досягає 100%, при специфічності 93%. Тест з використанням високих доз дексаметазону є суттєвим при диференційній діагностиці синдрому Кушинга. У цьому варіанті тесту, дексаметазон приймають орально в дозі 2 мг кожні 6 год протягом двох діб. У пацієнтів з гіперфункцією наднирників гіпофізарної етіології зменшення рівня кортизолу в плазмі крові повинно складати не менш як 50% основного вихідного рівня. Падіння концентрації відсутнє у пацієнтів з пухлинами наднирників і ектопією продукції АСТН. Слід відзначити, що близько 20% випадків синдрому Кушинга, спричиненого гіперфункцією гіпофіза, не супроводжується падінням концентрації кортизолу в тесті з дексаметазоном; у свою чергу, значне зменшення рівня кортизолу після дексаметазонової проби супроводжує близько 10% випадків ектопії виділення АСТН. Помилково-позитивні результати тестування з дексаметазоном можна отримати в пацієнтів у стані гострого стресу, в часі інфекційного захворювання, підвищення температури чи глибокої психічної депресії. Помилково-позитивні результати може також спровокувати застосування медикаментів, що прискорюють обмін дексаметазону шляхом індукції мікросомальних ензимів печінки, наприклад, фенітоїну, фенобарбіталу чи ріфампіцину. Вимірювання в дексаметазоновому тесті концентрації не лише кортизолу, але й дексаметазону, дозволяє оцінити адекватність використаного дозування для гальмування секреції АСТН і кортизолу.
Тест з Метирапоном Обгрунтування тесту з Метирапоном зроблено вище. З метою диференційної діагностики синдрому Кушинга Метирапон вводять орально в дозі 750 мг через 4 год протягом доби. Оцінку функції осі гіпоталамус-гіпофіз-наднирники здійснюють на основі визначення добової екскреції 17 ОН-кортикостероїдів з сечею протягом трьох діб, починаючи з доби, що передує прийому Метирапону. У здорових осіб екскреція 17 ОН-кортикостероїдів з сечею в день прийому Метирапону або на наступний день зростає щонойменше вдвічі. Тестування з Метирапоном можна інтерпретувати також на основі визначення концентрації АСТН або 11-дезоксикортизолу в плазмі. Інтенсивність відповіді осі гіпоталамус-гіпофіз-наднирників у тесті з Метирапоном, визначена на основі вимірювання концентрації АСТН в плазмі крові або екскреції з сечею 17 ОН-кетостероїдів, є нормальною або збільшеною при синдромі Кушинга гіпофізарної етіології; для пухлин наднирника характерні значне ослаблення або відсутність відповіді внаслідок тривалого пригнічення секреції АСТН. Слід, однак, пам'ятати, що у 50% випадків ектопічної продукції АСТН, тестування з Метирапоном виявляє підвищенний рівень цього гормону в плазмі крові. При проведенні тестування можна також визначати рівень 11-дезоксикортизолу в плазмі крові; при хворобах гіпофіза, що супроводжуються гіперфункцією кори наднирників, виявляється аномальне підвищення цього показника, тоді як при ектопії продукції АСТН підйом рівня 11-дезоксикортизолу значно порушується. Важко інтерпретувати результати визначення 11-дезоксикортизолу в тесті з Метирапоном у пацієнтів з пухлинами наднирників; основний рівень 11-дезоксикортизолу в плазмі крові при цій патології може бути підвищеним незважаючи на зменшення рівня АСТН; подальший ріст цього показника відбувається по мірі поглиблення ензимного блоку, викликаного введенням Метирапону. При синдромі Кушинга результаті описаного вище скороченого тесту з одноразовим введенням Метирапону близькі до вислідів стандартно проведеного тестування Разом з тим, у діагностиці синдрому Кушинга одноразовий Метирапоний тест до цього часу не знайшов широкого використання.
Постінсулінова гіпоглікемія У діагностиці синдрому Кушинга використовується також тест з постінсуліновою гіпоглікемією. Без встановлення етіології порушень, висліди цього тесту у 80% пацієнтів суттєво різняться від нормальних показників. Концентрація калію в плазмі крові Зменшення концентрації калію у поєднанні з метаболічним алкалозом дуже часто супроводжує ектопію продукції АСТН. Гіпокаліємія присутня у 70-100% випадків ектопії виділення АСТН. Разом з тим, специфічність цього показника невисока. Часто у пацієнтів з синдромом Кушинга гіпокаліємія може провокуватись прийомом діуретиків, уживаних для лікування гіпертензії. Слід також пам'ятати, що навіть незначний гемоліз або надто довге зберігання крові перед проведенням аналізу, може призводити до значного підвищення рівня калію у досліджуваній пробі. Тест з кортикотропін-релізинг фактором (CRH) Встановлення в останні роки структури CRH з його наступним синтезом уможливило використання цього гормону в тестах диференційної діагностики синдрому Кушинга. Кров для визначення концентрації кортизолу і АСТН забирають безпосередньо перед довенним уведенням CRH в дозі 100-200 μг, а також через 15, 30, 45, 60, 90 і 120 хв після ін'єкції. Нормальними результатами тестування вважають збільшення рівня кортизолу до 430-820 нмоль/л і АСТН до 28-320 нг/л. У пацієнтів із синдромом Кушинга гіпофізарної етіології продукція обох гормонів звичайно патологічно підвищена, тоді як брак або невираженість росту свідчить про ектопію продукції АСТН чи пухлину наднирників. На відміну від тесту з малою дозою дексаметазону, коли у пацієнтів з глибокою ендогенною депресією можуть бути отримані псевдопозитивні результати, висліди тесту з CRH у пацієнтів з депресією є нормальними. Придатність тесту з CRH для диференційної діагностики синдрому Кушинга, спричиненого патологією гіпофіза чи ектопією продукції АСТН, не перевищує інформативність інших тестів функціональної оцінки осі гіпоталамус-гіпофіз-наднирників. Тест з CRH придатний також для встановлення локалізації ектопії виділення АСТН.
Визначення внутрішньовенної концентрації АСТН в різних частинах тіла Визначення внутрішньовенної концентрації АСТН у різних частинах тіла проводять з використанням катетеру в ситуаціях, коли іншим шляхом однозначно встановити локалізацію ектопії продукції АСТН неможливо. Кров для визначення АСТН, при можливості, забирають з нижнього скелястого синуса, аби визначити секрецію цього гормону гіпофізом, а також з інших місць: вен шиї, середостіння, печінки та наднирників. Для порівняння слід одночасно визначити концентрацію АСТН в плазмі периферійної крові. Виявлення найвищої концентрації гормону у венозній крові нижнього скелястого синуса з певністю свідчить про його гіпофізарне походження. Градієнт концентрації АСТН між нижнім скелястим синусом і периферійною кров'ю додатково зростає після довенної ін'єкції CRH. Відсутність градієнту концентрацій вказує на позагіпофізарне джерело гіперпродукції АСТН. Дуже часто місцем ектопії виділення цього гормону служать легені; разом з тим, вірогідність виявлення такої ектопії на основі визначення АСТН у венозній крові легень менша, аніж при виявленні гіперпродукції цього гормону гіпофізом.
Захворювання щитовидної залози є доволі поширеною формою патології. Так. у країнах Заходу близько 2,5 % населення уражено різними формами гіпертирозу, хоча значний відсоток популяції страждає також від гіпофункції щитовидної залози. Вроджена тироїдна недостатність з однакового частотою уражає дітей обох статей і при відсутності належного лікування веде до розумової відсталості. У дорослих найчастіше причиною тироїдної патології при адекватному надходженні в організм йоду є автоімунні захворювання. При цьому частіше уражаються жінки. Хвороби гіпофіза, що супроводжуються порушеннями його тиротропної функції, зустрічаються значно рідше, хоча така патологія протікає набагато важче. Принципово нові проблеми виникають при поєднанні зменшеного виділення гіпофізом тиротропного гормону (ТSН) і адренокортикотропного гормону (АСТН), внаслідок чого виникає небезпека розвитку кортизолової недостатності наднир-ників, що вимагає швидкого розпізнавання. Діагностика захворювань щитовидної залози грунтується головним чином на результатах біохімічних досліджень. Клінічні прояви часто неспецифічні і не відповідають книжковим описам, особливо у осіб старшого віку. Клінічною симптоматикою не слід, однак, легковажити, оскільки правильний діагноз сприяє швидкому і ефективному лікуванню. Результати сучасних діагностичних тестів у більшості випадків дозволяють розпізнавати конкретні форми тироїдної патології. Лише окремі випадки вимагають застосування комплексних діагностичних методів (зокрема, визначення поглинання йоду тощо).
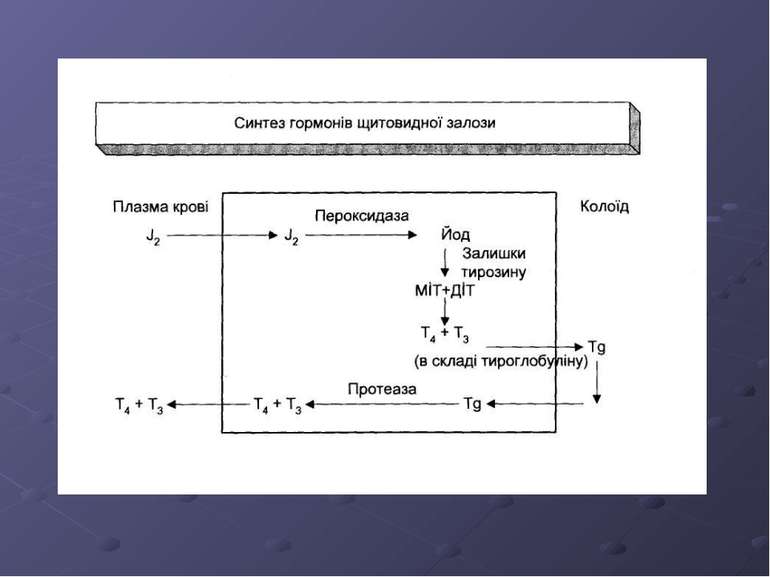
Фізіологічне обгрунтування Щитовидна залоза виділяє три гормони: тироксин (Т4) і трийодтиронін (Т3), що є йодованими похідними тирозину, а також кальцитонін, продукований парафолікулярними (С) клітинами. У цьому розділі кальцитонін розглянуто не буде. Йодиди накопичуються фолікулярними клітинами щитовидної залози шляхом активного транспорту (рис.2). Транспортні механізми блокують сполуки перхлорану та тіоціаніну. Пероксидаза фолікулярних клітин окислює йодиди до атомарного йоду, який зв'язується з амінокислотними залишками тирозину пептидного ланцюга тироглобуліну. При цьому утворюються монойодтирозин (М.ІТ) та дийод-тирозин (О.ІТ). Вказаний цикл може блокуватися тіосечовиною та карбімазолом. В результаті димеризації йодованих залишків тирозину утворюються Т^ або Т,. Йодований тиро-глобулін накопичується в просвіті фолікулів у складі колоїду. Недостатність ензимів, що каталізують описані біохімічні перетворення, є однією з причин гіпофункції щитовидної залози новонароджених. Тироксин і трийодтиронін вивільняються з тироглобуліну внаслідок дії протеолітичних ензимів лізосом фолікулярних клітин і надходять у кровообіг. Одночасно вивільняється також незначна кількість тироглобуліну, який можна виявити у крові чутливими діагностичними методами. Головним продуктом щитовидної залози є Т4, але одночасно виділяється також незначна кількість Т,. При нестачі йоду кількість продукованого щитовидною залозою Т3 зростає. У нормі 80% циркулюючого Т. утворюється у тканинах з Т+ під дісю ензиму дейодинази. Дейодиназа гіпофіза реагує на рівень тироїдних гормонів в організмі. Клітини гіпофіза містять рецептори для тироїдних гормонів, за участю яких вони реєструють підвищення рівня продукованого в результаті ензимохімічної реакції Т, І регулюють відповідний рівень виділення ТЗН. Біологічна активність Т3 є значно вищою, аніж Т4. Доведено, що 50 % активності тироїдних гормонів крові складає Т3, не зважаючи на його низьку концентрацію. Т3 зв'язується зі специфічними рецепторами, які за будовою належать до рецепторів стероїдних гормонів. Після зв'язування з рецептором, Т3 змінює активність генів клітинного ядра. Тироїдні гормони необхідні для нормального росту і розвитку дитячого організму, особливо для розвитку нервової системи. Вони також впливають на метаболізм дорослого організму.
Виділення тироїдних гормонів контролюється пептидними гормонами гіпоталамо-гіпофізарної системи. Тиротропін-вивільнюючий гормон (тироліберин, TLH) є трипептидом, що синтезується у гіпоталамусі. TLH доноситься кров'ю до гіпофіза, де стимулює виділення тиротропного гормону (TSH). TSH у свою чергу стимулює ензим реакції синтезу тироглобуліну і вивільнення з нього Т4 та Т3. TSH є глікопро-теїном, що побудований з двох пептидних ланцюгів, серед яких ланцюг а є типовим для інших глікопептидних гормонів (FSH, LH, HCG), тоді як ланцюг Р специфічний лише для TSH. Виділення TSH регулюється за принципом негативного зворотнього зв'язку між щитовидною залозою - гіпоталамусом - гіпофізом. Підвищення концентрації тироїдних гормонів внаслідок гіперфункції щитовидної залози (рис.4) зумовлює компенсаторне пригнічення продукції TSH, що веде до нормалізації рівня тироїдних гормонів. Зниження рівня тироксину нижче норми, напроти, стимулює виділення TSH.
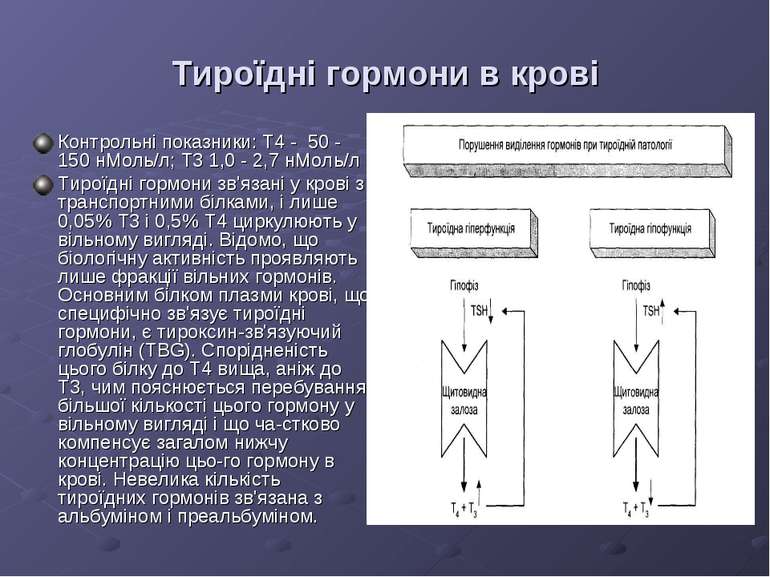
Тироїдні гормони в крові Контрольні показники: Т4 - 50 - 150 нМоль/л; Т3 1,0 - 2,7 нМоль/л Тироїдні гормони зв'язані у крові з транспортними білками, і лише 0,05% Т3 і 0,5% Т4 циркулюють у вільному вигляді. Відомо, що біологічну активність проявляють лише фракції вільних гормонів. Основним білком плазми крові, що специфічно зв'язує тироїдні гормони, є тироксин-зв'язуючий глобулін (TBG). Спорідненість цього білку до Т4 вища, аніж до Т3, чим пояснюється перебування більшої кількості цього гормону у вільному вигляді і що ча стково компенсує загалом нижчу концентрацію цьо го гормону в крові. Невелика кількість тироїдних гормонів зв'язана з альбуміном і преальбуміном.
Тести функціональної оцінки щитовидної залози Основним тестом для оцінки тироїдної функції є визначення концентрації Т4 і TSH. Визначення Т4 вказує на функціональний стан щитовид ної залози, тоді як показником порушень тироїдної функції є рівень TSH, оскільки він над звичайно чутливий до змін концентрації тироїдних гормонів. Результати визначення загального рівня Т4 і Т3 залежать від вмісту тироксин-зв'язуючих білків крові, переважно TBG. У випадках, коли підозрюють порушення гормонально-білкового зв'язування, важливим є визначення показника вільних гормонів. Раніше з цією метою визначали рівень гормон-зв’яуючих білків крові. Сучасні діагностичні методи дозволяють безпосередньо визначати рівень вільних Т4 і Т3. Результати першої групи тестів значною мірою залежать від низки вторинних факторів, таких як концентрація тироксин-зв'язуючих білків, вплив жирних кислот, і патологічних білків, що загалом зумовлює значні розбіжності між результатами обстежень. Сучасні методики значно специфічніші і альтернативно використовуються у багатьох лабораторіях. Визначення TSH можна використовувати для скринінгу тироїдної патології, однак при цьому у всіх випадках відхилень від норми необхідно визначати концентрацію зв'язаного або вільного Т4, оскільки зміна рівня TSH сама по собі не є суто специфічною ознакою тироїдної патології. Підвищення рівня TSH слід очікувати при тироїдній гіпофункції, тоді як зниження рівня TSH може вказувати на тиротоксикоз. Визначення Т3 має обмежене застосування. У багатьох випадках тироїдна гіпофункція супроводжується зниженим або нормальним рівнем Т3. Переважна більшість випадків тиротоксикозу може бути виявлена шляхом визначення Т4. Дослідження Т3 є необхідним при клінічних проявах тиротоксикозу на фоні нормальної концентрації Т4, оскільки приблизно у 5% випадків підвищення рівня Т3 є єдиним проявом гормональних порушень (тиротоксикоз-Т3). Деякі лікарські препарати, зокрема, аміодарон, блокують перехід Т4 у Т3 і тому визначення Т3 може допомогти у встановленні причини незначного збільшення рівня Т4 у цих пацієнтів.
Тести для встановлення причини захворювання При хворобі Грейвса-Базедова та інших автоімунних захворюваннях щитовидної залози часто можна виявити тироглобулін і автоантитіла до мікросом. Відомо, що антигеном мікросом щитовидної залози служить тиропероксидаза, яку можна ідентифікувати за допомогою специфічних антипероксидазних тестів. Не відомо, однак, чи це дослідження має переваги над раніше описаними методами. У пацієнтів з підвищеним рівнем TSH при відсутності клінічних проявів чи змін з боку Т4, продукція автоантитіл часто зумовлює розвиток тироїдної гіпофункції.
Лабораторні тести в дослідженні зобу Пацієнти з клінічно діагностованим зобом можуть виявляти ознаки тироїдної гіпер-, гіпофункції або нормального функціонування щитовидної залози. Результати біохімічних обстежень можуть допомогти у встановленні причини зобу та призначенні адекватного лікування. Розрізняють зоб ендемічний, вроджений, викликаний автоімунними захворюваннями або медикаментозною терапією. Інколи встановити причини виникнення зобу не вдається.
Найчастіше причиною гіперфункції щитовидної залози є хвороба Грейвса-Базедова. її ви никнення пов'язане з продукцією автоантитіл, що мають властивість зв'язуватися з рецепторами TSH і активувати функцію тироцитів. Рідше причиною виникнення гіпертироїдизму служать як ізольовані, так і множинні аденоми щитовидної залози. Клінічні прояви тироїдної гіперфункції різноманітні. Слід пам'ятати, що у осіб старшого віку клінічні прояви гіпертироїдизму можуть бути ослаблені, а також про необхідність обстеження на гіпертироїдизм усіх терапевтичних хворих з миготінням передсердь чи серцевою аритмією. Найкращим тестом для скринінгу первинного гіпертироїдизму є дослідження рівня TSH, рівень якого повинен бути нижчим чутливості метода (не повинен визначатися). Рідшим є вторинний гіпертироїдизм, при якому продукований гіпофізом TSH стимулює виділення Т4. На жаль, виявлення низького рівня TSH не є суто специфічною ознакою тироїдної патології. Інші фактори, такі як медикаментозна терапія допаміном і стероїдами, психічні хвороби, можуть пригнічувати виділення TSH. Часто низь кий рівень TSH виявляється у здорових осіб похилого віку, що не завжди є ознакою тироїдної гіперфункції Тироїдна гіперфункція
Щоб остаточно підтвердити порушення функції щитовидної залози необхідно визначити показники секреції тироїдних гормонів, зокрема, вільний Т4. Якщо рівень цього гормону при виразних клінічних проявах тиротоксикозу знаходиться в межах норми, необхідно визначити концентрацію Т3. Для встановлення причин тиротоксикозу слід використати наступну техніку: сканування із застосуванням ізотопу технецію (99m Тс Pertechnate), визначення тироґлобуліну і мікросомальних автоанитіл. Ці тести дозволяють провести диференційну діагностику з хворобою Грейвса-Базедова, при якій дифузне збільшення щитовидної залози поєднується з присутністю автоантитіл,одно- або багатовузловим зобом.
Тироїдна гіпофункція Пацієнти з тироїдною гіпофункцією переважно скаржаться на втому, нетолерантність до холоду, надмірну масу тіла тощо. Гіпофункція щитовидної залози носить переважно первинний характер, випадки вторинної недостатності, пов'язані з пошкодженнями гіпоталамуса або гіпофіза, рідко дають характерні ознаки гіпотироїдизму. Тестом вибору для підтвердження тироїдної недостатності є визначення TSH. Переважна більшість пацієнтів з клінічними проявами гіпотироїдизму має також знижений рівень Т4, але оскільки лише 25% із них виявляє також зниження Т3, визначення останнього у цьому випадку не має суттєвого діагностичного значення. Визначення TSH вважають найперспективнішим тестом скринінгу гіпотироїдизму, однак деякі пацієнти мають підвищений рівень TSH при нормальному рівні вільного і зв'язаного Т4. Вважають, що у цих хворих гіпофіз має здатність компенсувати гіпофункції щитовидної залози, тому інколи описують так звану "субклінічну", або "скомпенсовану", форму гіпотироїдизму. Пацієнтів з гіпофункцією щитовидної залози лікують тироїдними гормонами, головним чином Т4. Оскільки період напіввиведення Т4 триває тиждень, цей гормон рекомендують приймати один раз денно, а контрольні лабораторні дослідження проводити через 6 тижнів після чергової зміни дози. Кров для аналізу необхідно забирати безпосередньо після прийому денної дози тироксину.
Запалення щитовидної залози Хворобу Гашімото (автоімунний тироїдит) вважають найпоширенішою причиною тироїдної недостатності. Для неї характерний щільний зоб, інфільтрований лімфоцитами і плазмоцитами. Переважна більшість, хоч і не всі хворі, мають клінічні прояви тироїдної недостатності, а в умовах гострі прогресуючої деструкції щитовидної залози можуть також розвиватися ознаки гіпертироїдизму. При атрофічному запаленні щитовидної залози пошкодження настільки значні, що залоза пальаторно не визначається. Вірусні запалення щитовидної залози (підгостре запалення де Кервена) викликають переважно віруси паротиту, грипу, коксакі або аденовіруси. У хворого в анамнезі встановлюють перенесену вірусну інфекцію, а пальпаторно виявляють збільшену, болючу щитовидну залозу. Такі пацієнти можуть мати клінічні про-ви тироїдної гіперфункції. Гіпертироїдна фаза може тривати кілька тижнів і переходити у гіпотироїдну фазу з наступною нормалізацією. Поглинання радіойоду щитовидною залозою в стадії активного запалення може бути пригніченим у його першій фазі. Хвороба Ріделя протікає як фіброзний тироїдит. Причина цього захворювання невідома, а його проявом є збільшена залоза без порушеної функції.
Рак щитовидної залози Біохімічні дослідження є малоінформативними в діагностиці раку щитовидної залози. Пацієнти рідко виявляють порушення тироїдної функції, а визнечення рівня тироглобуліну є надто неспецифічним, аби мати діагностичну вартість. Лише серцевинний рак (похідний С-клітин) може бути виявлено на основі визначення рівня кальцитоніну сироватки крові. Концентрація тироглобуліну має значення при контролі ефективності лікування. Пацієнти переважно отримують високі дози J131, що цілковито руйнують щитовидну залозу. Після цього, для профілактики рецидиву, призначають підтримуючі дози тироїдних гормонів, що забезпечує низький рівень TSH (нижче чутливості методу). Концентрація тироглобуліну повинна утримуватися нижче 5 мкг/л (нижче порогу визначення), а кожний підйом його концентрації вище вказаного рівня може бути першою ознакою рецидиву. Вважають, що постійний контроль рівня тироглобуліну має таку саму цінність, як і ультразвукова діагностика.
Схожі презентації
Категорії