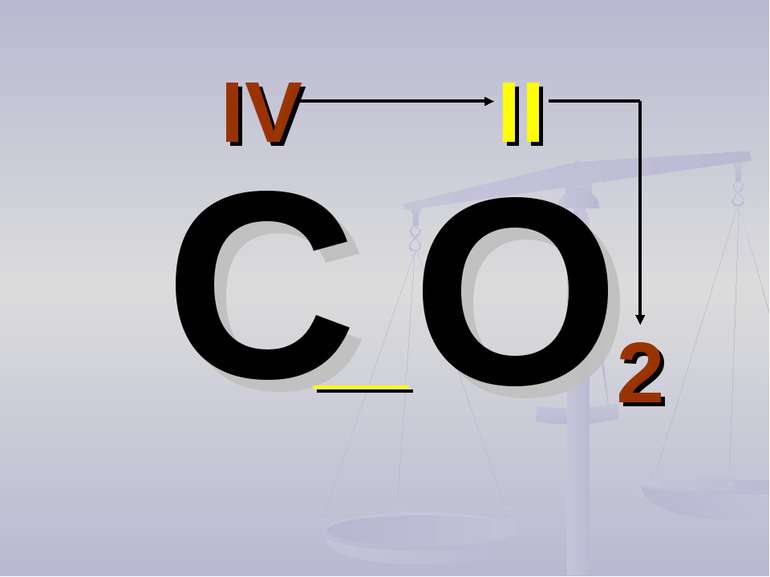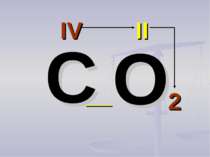Презентація на тему:
Валентність хімічних елементів. Визначення валентності за формулами бінарних сполук
Завантажити презентацію
Валентність хімічних елементів. Визначення валентності за формулами бінарних сполук
Завантажити презентаціюПрезентація по слайдам:
Чи є у Вас бажання навчитись вільно писати формули речовин? З'ясувати, що таке валентність елемента; Прогнозувати можливі значення валентності елемента за його положенням у Періодичній системі; Вивчити алгоритм складання хімічних формул бінарних сполук; Навчитись складати хімічні формули бінарних сполук.
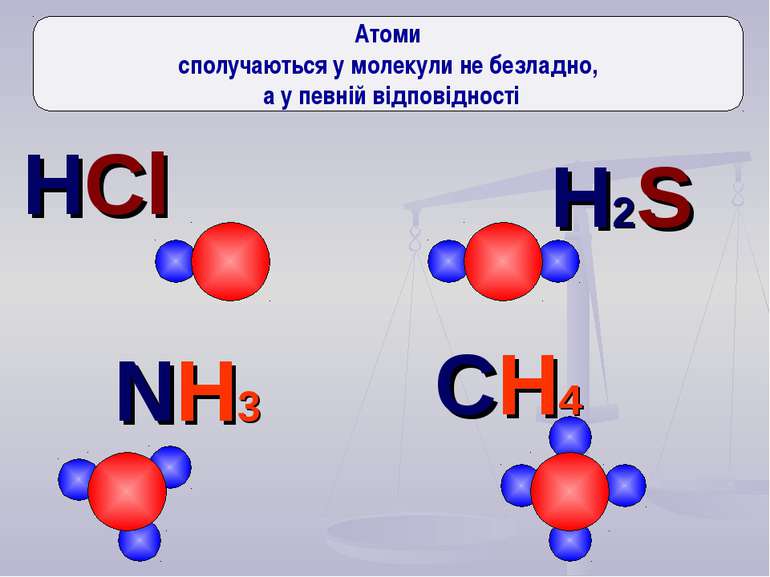
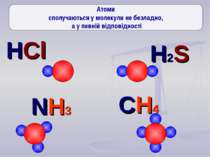
Давайте поміркуємо Чому в природі так мало окремих атомів, більшість існує тільки у вигляді молекул?
Ще три сотні років тому вчені встановили, що атоми з'єднуються в молекули не безладно, а в певній послідовності за допомогою зв'язків, які називають хімічними. Тоді атоми уявляли у вигляді кульок, що мають “гачки”, за допомогою яких вони сполучались один з одним. Тільки багато років потому була встановлена істина природа хімічного зв‘язку. Зверніть увагу
Як Ви вважаєте Атом може з'єднуватись з визначеною кількістю атомів, чи кількість таких зв'язків необмежена?
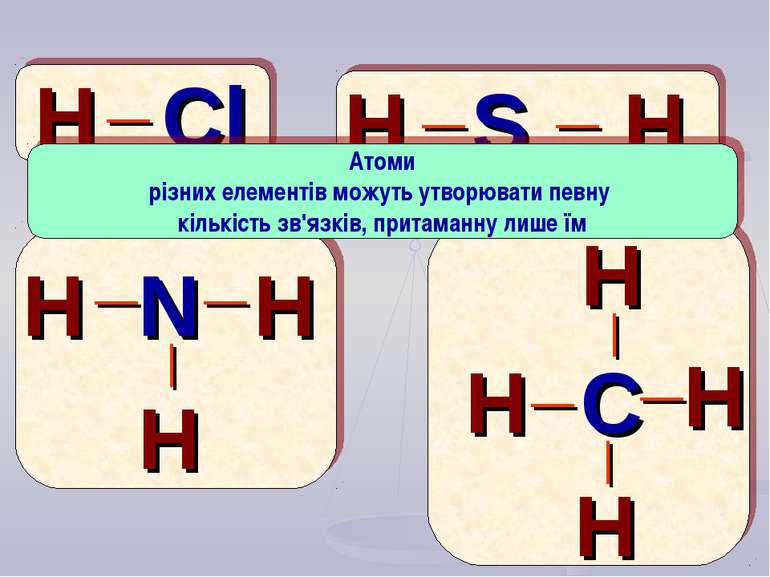
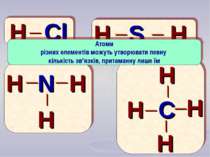
H Cl S N C H H H H H H H H H _ _ _ _ _ _ _ _ _ _ Атоми різних елементів можуть утворювати певну кількість зв'язків, притаманну лише їм
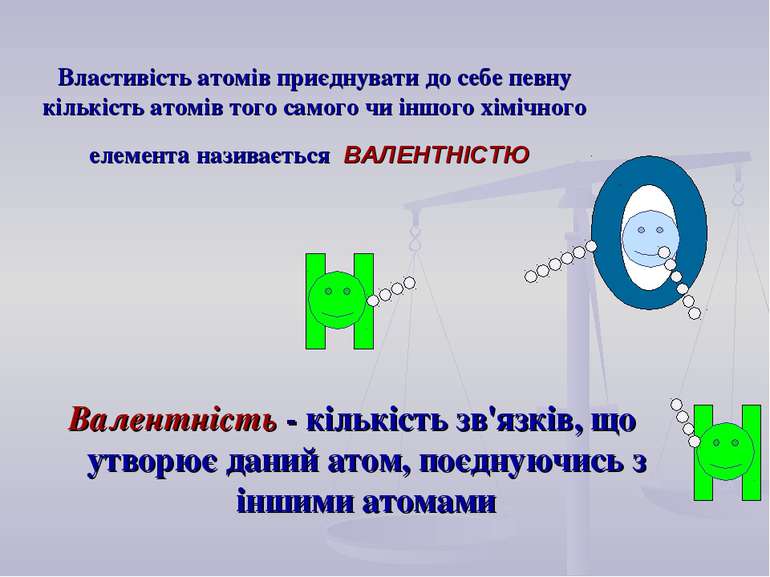
Виходячи з кількості хімічних зв'язків, що утворює атом даного елементу, зробіть визначення “ВАЛЕНТНОСТІ”.
Властивість атомів приєднувати до себе певну кількість атомів того самого чи іншого хімічного елементa називається ВАЛЕНТНІСТЮ Валентність - кількість зв'язків, що утворює даний атом, поєднуючись з іншими атомами
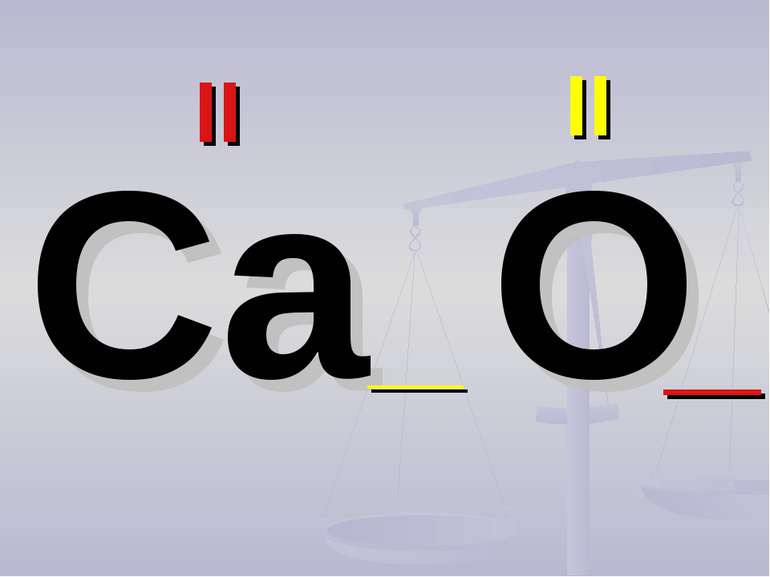
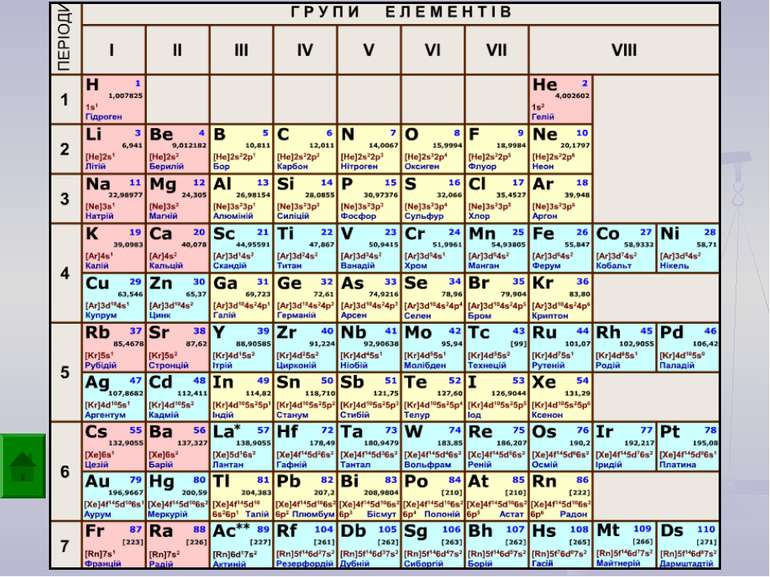
Валентність залежить від будови атома і визначається за положенням у періодичній системі. Валентність Стала Змінна Валентність (Н) = І Валентність (О) = ІІ Валентність (F) = І Максимальна валентність = № групи. (виключення О = ІІ, Fe = ІІ, ІІІ) Мінімальна валентність ( неметалів у сполуках із металами і Н) = 8 – № групи. Проміжні валентності = максимальна валентність мінус числа кратні двом. Валентність елементів І,ІІ,ІІІ груп = № групи (виключення Cu = I і ІІ) У бінарних сполуках сумарна валентність усіх атомів одного елемента завжди дорівнює сумарній валентності усіх атомів другого елемента
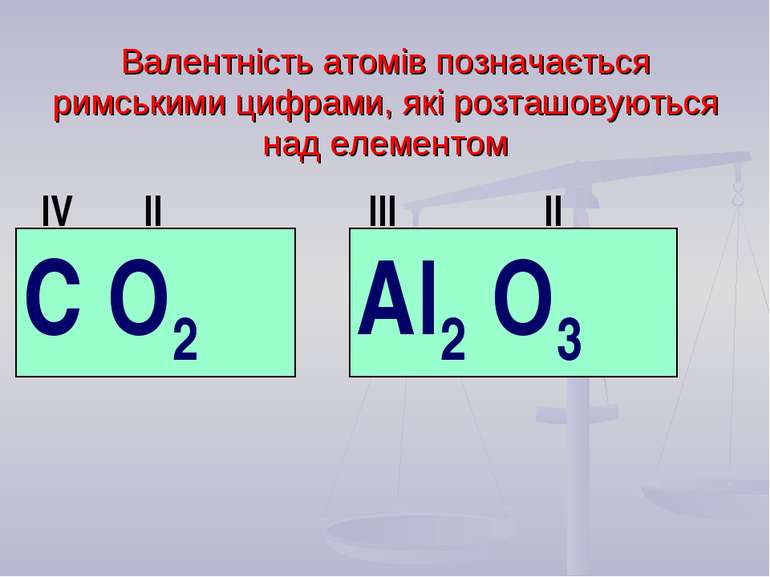
Валентність атомів позначається римськими цифрами, які розташовуються над елементом С О2 Al2 О3 IV II II III
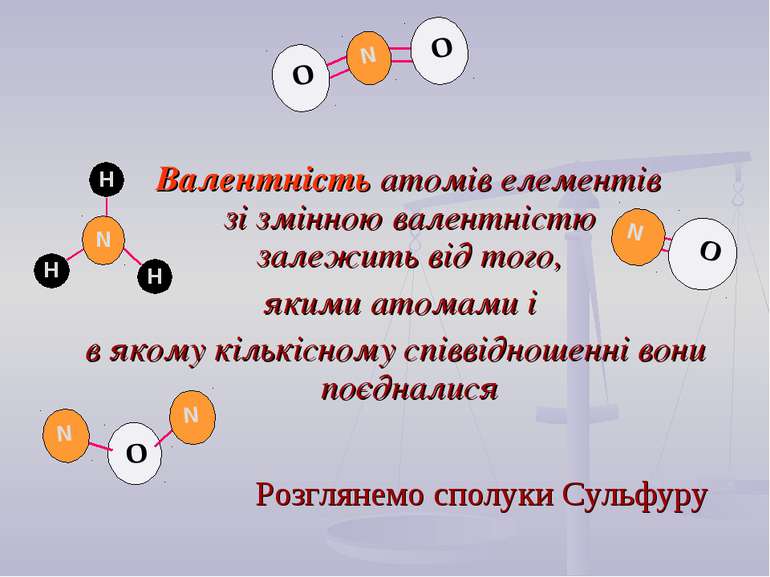
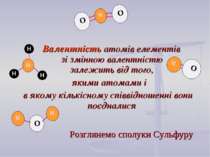
Валентність атомів елементів зі змінною валентністю залежить від того, якими атомами і в якому кількісному співвідношенні вони поєдналися Розглянемо сполуки Сульфуру
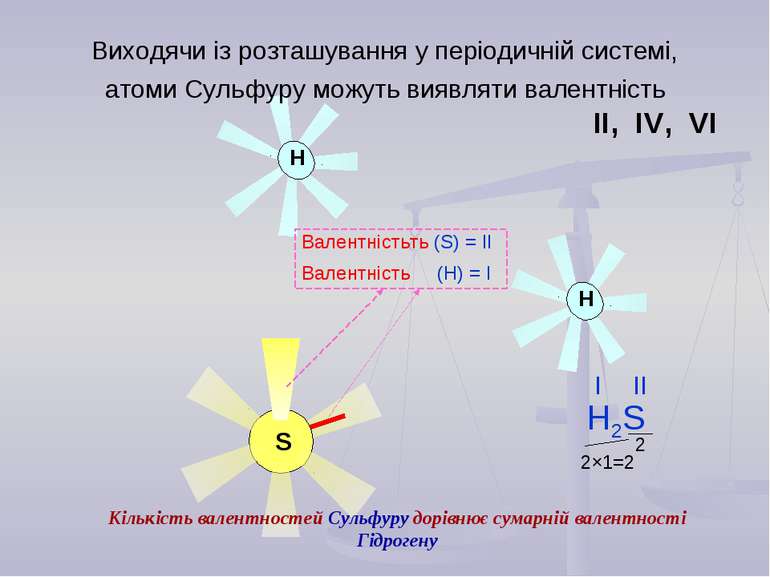
S Виходячи із розташування у періодичній системі, атоми Сульфуру можуть виявляти валентність ІІ, ІV, VІ Валентністьть (S) = ІІ Валентність (Н) = І Кількість валентностей Сульфуру дорівнює сумарній валентності Гідрогену 2×1=2 2
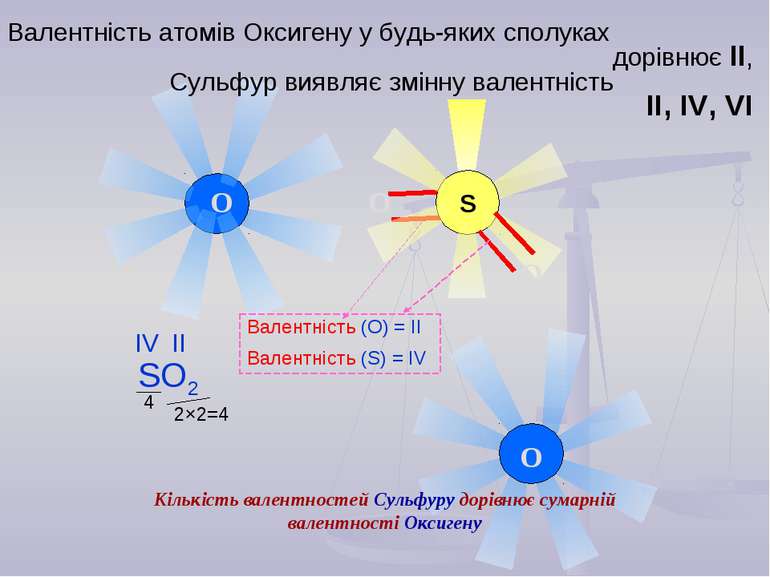
S O O O O Валентність атомів Оксигену у будь-яких сполуках дорівнює ІІ, Сульфур виявляє змінну валентність ІІ, ІV, VI Валентність (О) = IІ Валентність (S) = IV 2×2=4 4 Кількість валентностей Сульфуру дорівнює сумарній валентності Оксигену
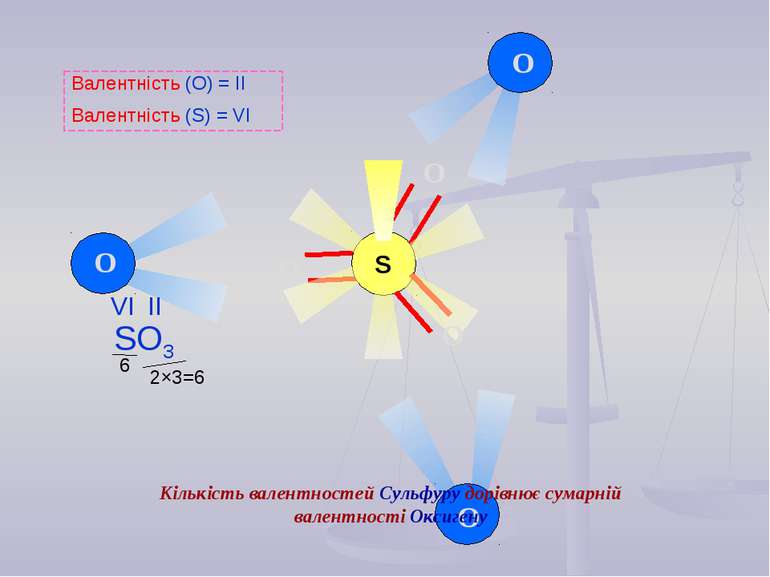
2×3=6 6 O O O S O O O Валентність (О) = ІІ Валентність (S) = VІ Кількість валентностей Сульфуру дорівнює сумарній валентності Оксигену
Алгоритм складання хімічних формул за валентністю. Правило знаходження валентності: - У металів валентність визначається за номером групи. - У неметалу, що стоїть на першому місці в формулі, ставиться вища валентність. - У неметалу, що стоїть на другому місці в формулі, ставиться нижча валентність. Na O Приклад: I II 2 Порядок дій: 1. Визначаємо валентність хімічних елементів. 2. Знаходимо найменше спільне кратне. 3. Знаходимо індекси. : 2 I = 2 2 2 : II = 1 1 S O VI II 6 1. Визначаємо валентність хімічних елементів. 2. Знаходимо найменше спільне кратне. 3. Находимо індекси. : 6 VI = 1 1 6 : II = 3 3 P O V II 10 1. Визначаємо валентність хімічних елементівх элементов. 2. Знаходимо найменше спільне кратне. 3. Знаходимо індекси. : 10 V = 2 2 10 : II = 5 5
Увага ! На першому місці записується символ того елемента, який у Періодичній системі розташований зліва або нижче порівняно з іншим. (виключення: метали з Гідрогеном – NaH, СаН2; NH3, РН3; Cl2O7). Складаючи хімічні формули бінарних сполук враховуйте порядок написання символів елементів у формулі.
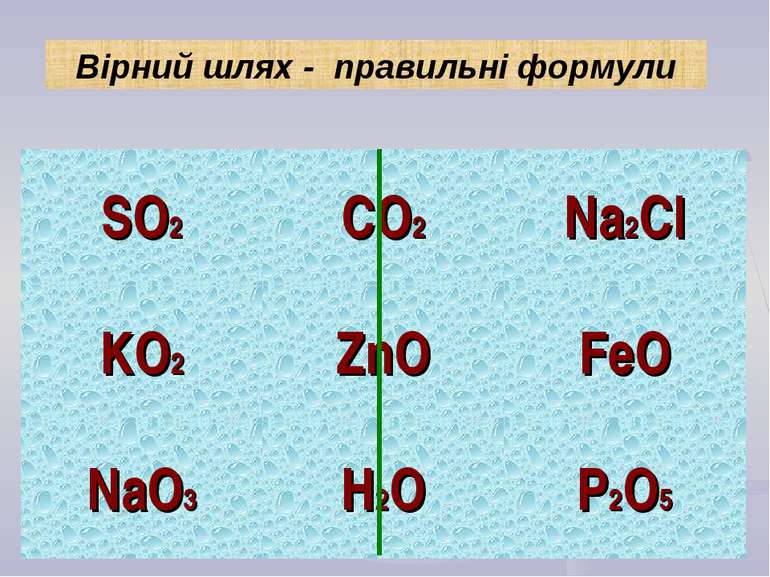
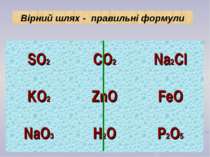
Складіть формули сполук за їх валентністю: KO, CaCl, AlCl, NaS, CuO, MgS Складіть формули бінарних сполук з Оксигеном: Натрію; Карбону (ІІ); Феруму (ІІІ); Нітрогену (V). Застосуємо набуті знання на практиці
Підведемо підсумки уроку З якою метою ми вивчали валентність хімічних елементів? Чи досягли ми мети? Чи навчилися складати хімічні формули сполук? Що необхідно знати для складання формул? Що є “підказкою”? Оцініть результати своєї діяльності задовільно добре відмінно
Схожі презентації
Категорії