Презентація на тему:
Хімічна кінетика та рівновага
Завантажити презентацію
Хімічна кінетика та рівновага
Завантажити презентаціюПрезентація по слайдам:
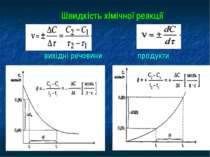
Хімічна кінетика - розділ хімії, який вивчає перебіг хімічних процесів за певний час 2Н2(г) + О2(г) = 2Н2О(г) , G = - 456,4 кДж При t=800 C G = - 495,3 кДж Предмет хімічної кінетики: вивчення чинників, які впливають на швидкість процесів; визначення оптимальних умов, за яких можна здійснити реакцію
Гомогенна система (однорідна) – складається з однієї фази Гетерогенна (неоднорідна) – складається з кількох фаз Фаза – однорідна частина системи, однакова за складом та властивостями і відокремлена від інших фаз поверхнею поділу. Гомогенні реакції відбуваються в усьому об’ємі системи Гетерогенні реакції– на поверхні поділу фаз
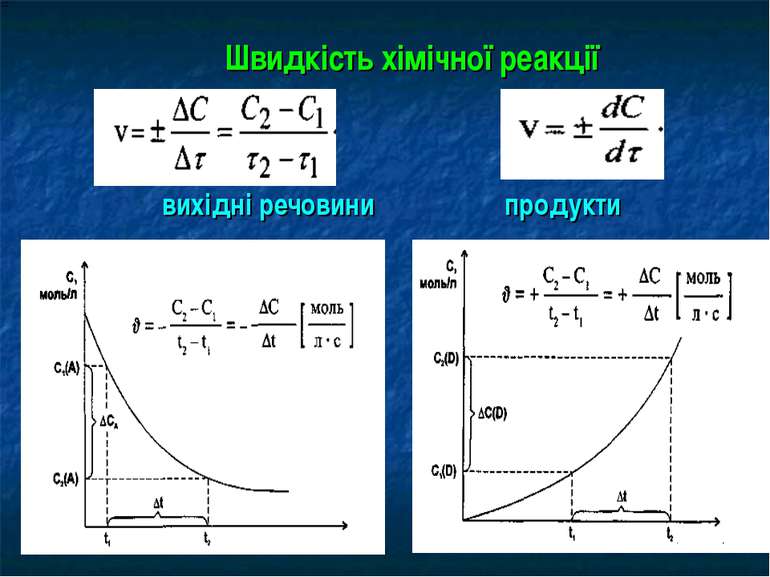
Закон діючих мас Швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин у ступенях, які дорівнюють коефіцієнтам, що стоять перед формулами речовин у відповідному рівнянні реакції
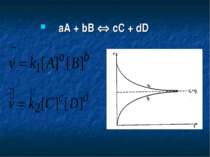
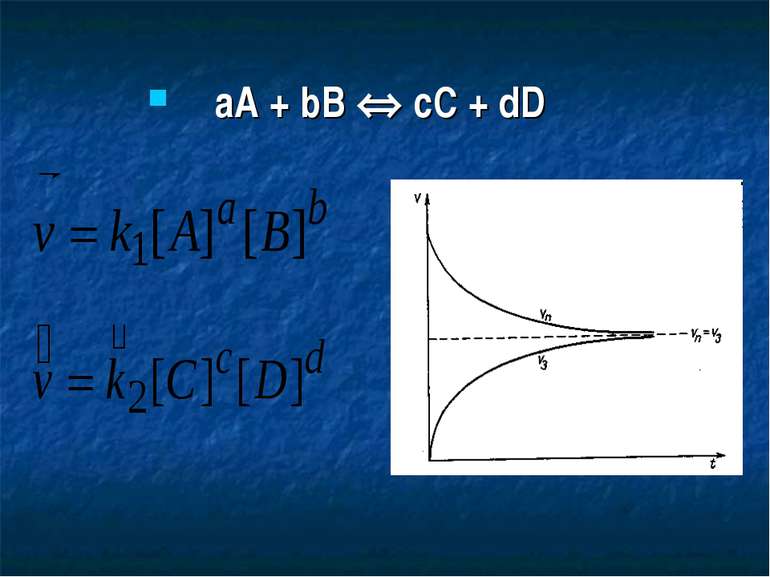
Залежність швидкості реакції від концентрацій реагуючих речовин Н2 + I2 = 2HI v = kC(H2)C(I2) 2NO + Cl2 = 2NOCl v = kC2(NO)C(Cl2). aA + bB = cC + dD v = kCa(A)Cb(B) = k[A]a[B]b
Стехіометричне рівняння 2HBr (г) = Н2 (г) + Br2 (г) Механізм реакції HBr +hv = H + Br; H + HBr = H2 + Br; Br + Br = Br2.
Принцип лімітуючої стадії – швидкість складної реакції визначається швидкістю найповільнішої (лімітуючої) елементарної стадії
Порядок реакції - характеристика механізму процесу Сумма показників ступенів в рівнянні швидкості хімічної реакції (кінетичного рівняння)
Молекулярність реакції – число молекул, які беруть участь в елементарному акті реакції Мономолекулярні – реакції, для перебігу яких необхідна одна молекула I2 = 2I; HBr = H + Br; N2O5 = 2NO2 + 1/2O2. Бімолекулярні – потрібна наявність двох молекул Н2 + І2 =2НІ Тримолекулярні – реагують одночасно три молекули 2NO + O2 = 2NO2
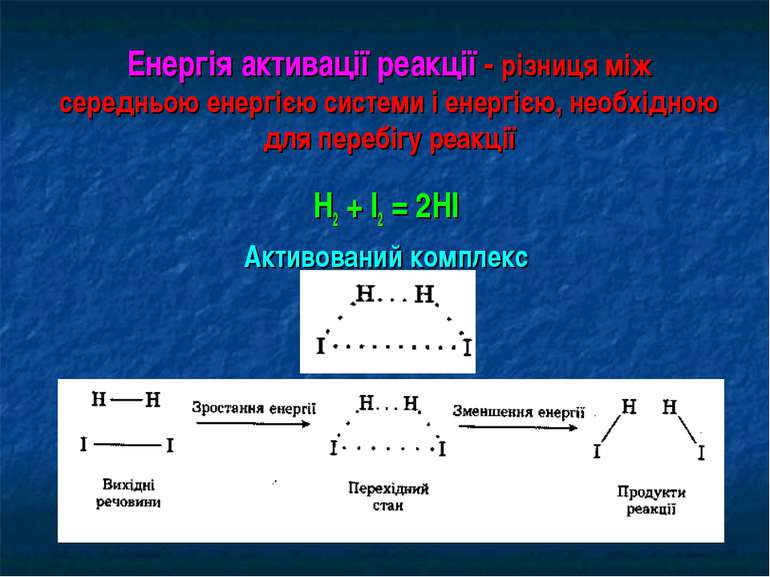
Енергія активації реакції - різниця між середньою енергією системи і енергією, необхідною для перебігу реакції Н2 + І2 = 2НІ Активований комплекс
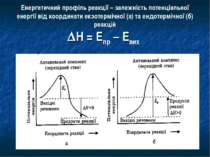
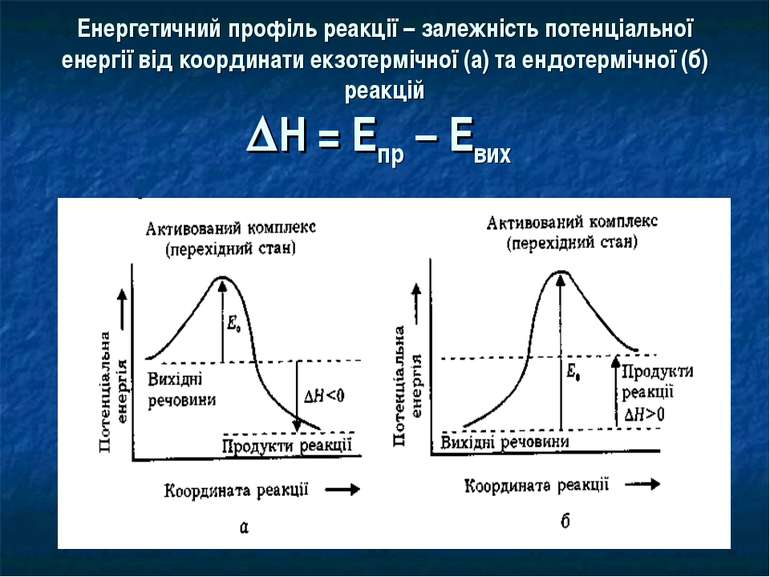
Енергетичний профіль реакції – залежність потенціальної енергії від координати екзотермічної (а) та ендотермічної (б) реакцій Н = Епр – Евих
Правило Вант-Гоффа: з підвищенням температури на кожні 10 градусів швидкість реакції зростає в 2-4 рази Температурний коефіцієнт показує, у скільки разів зросте швидкість реакції у разі підвищення температури на 10 градусів
Каталіз Каталізатор — це речовина, яка бере участь у проміжних стадіях, змінює швидкість реакції, але не входить до складу продуктів реакції і залишається після реакції в незмінній кількості. А + В = АВ (Ea) А + К = А...К (Е'а) А...К + В = АВ + К (Е а)
Хімічна рівновага Необоротні реакції - Н, + S 2KMnO4 = K2MnO4 + MnO2 + O2, 2KClO3 = 2KCl + 3O2 2K + 2H2O = 2KOH + H2
Оборотні реакції - Н, - S 2H2 + O2 2H2O 800–1500 С – пряма; 3000 – 4000 С – зворотна H2 + I2 2HI 300 – 400 С
Принцип Ле Шательє Зовнішній фактор Зміщення хімічної рівноваги Свих.реч.↓ В бік утворення вихідних речовин (зворотна реакція) Свих.реч.↑ В бік утворення продуктів (пряма реакція) Спрод.↓ В бік утворення продуктів (пряма реакція) Спрод.↑ В бік утворення вихідних речовин (зворотна реакція)
Принцип Ле Шательє Зовнішній фактор Зміщення хімічної рівноваги Т↑ В бік ендотермічної реакції (-Q, + Н) Т↓ В бік екзотермічної реакції (+Q, - Н) Р↑, V↓ В бік утворення менших об’ємів (меншого числа газоподібних часток) P↓, V↑ В бік утворення більших об’ємів (більшого числа газоподібних часток)
Схожі презентації
Категорії









![РЕАКЦІЇ НУЛЬОВОГО ПОРЯДКУ v = k -dC/d = k [k] = моль/л с СаСO3 = CaO + CO2 РЕАКЦІЇ НУЛЬОВОГО ПОРЯДКУ v = k -dC/d = k [k] = моль/л с СаСO3 = CaO + CO2](https://svitppt.com.ua/images/47/46877/770/img9.jpg)























![РЕАКЦІЇ НУЛЬОВОГО ПОРЯДКУ v = k -dC/d = k [k] = моль/л с СаСO3 = CaO + CO2 РЕАКЦІЇ НУЛЬОВОГО ПОРЯДКУ v = k -dC/d = k [k] = моль/л с СаСO3 = CaO + CO2](https://svitppt.com.ua/images/47/46877/210/img9.jpg)