Презентація на тему:
Оборотні й необоротні реакції. Хімічна рівновага.
Завантажити презентацію
Оборотні й необоротні реакції. Хімічна рівновага.
Завантажити презентаціюПрезентація по слайдам:
Zn +2HCl=ZnCl2+H2 Ba(NO3)2+Na2SO4=BaSO4+2NaNO3 Середовища виходять із середовища існування у вигляді осаду або газу Реакції необоротні
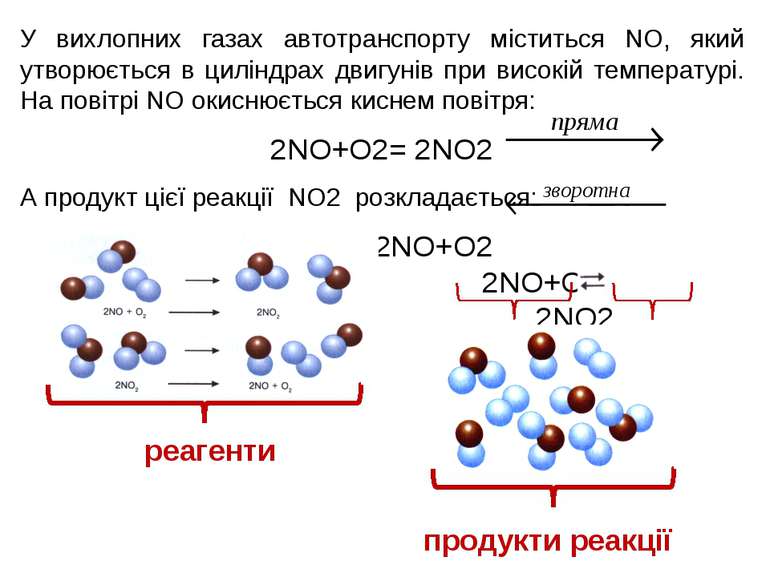
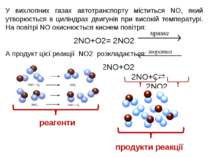
У вихлопних газах автотранспорту міститься NO, який утворюється в циліндрах двигунів при високій температурі. На повітрі NO окиснюється киснем повітря: 2NO+О2= 2NO2 А продукт цієї реакції NO2 розкладається: 2NO2= 2NO+О2 2NO+О2 2NO2 реагенти продукти реакції
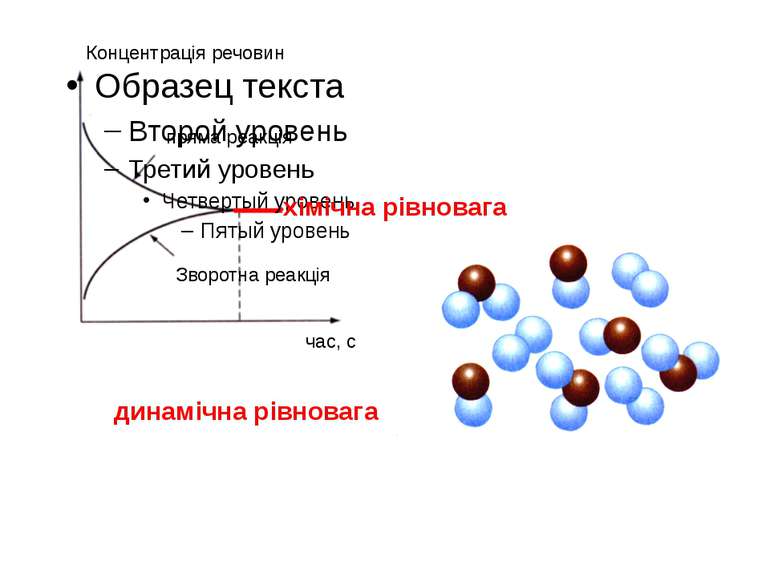
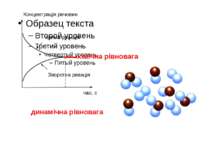
пряма реакція Зворотна реакція хімічна рівновага динамічна рівновага Концентрація речовин час, с
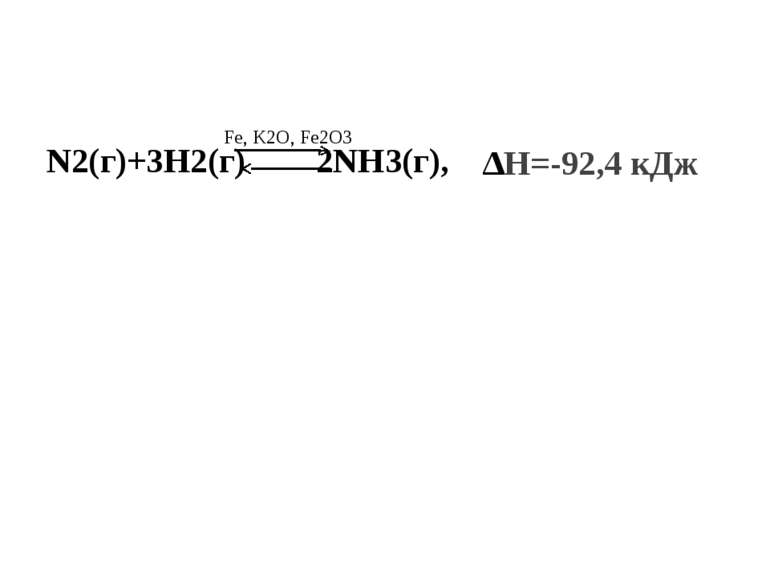
система протидіє (чинить навпаки) Якщо умови, за яких система знаходиться в рівновазі, змінити, рівновага зміщується в напрямку процесів, які протидіють цій зміні – принцип Ле Шательє У хімічній промисловості багато реакцій є оборотними і перед технологами постає проблема зміщення рівноваги в бік прямої реакції з метою добування більшої кількості продуктів . Наприклад: 2SO2+O2 2SO3 (одна із стадій добування сульфатної кислоти) 2NO+O2 2NO2 (одна із стадій добування нітратної кислоти) реакції гідролізу жирів Змістити напрямок реакції можна за допомогою зміни умов, тобто вплинувши на систему ззовні: зміна концентрації речовин зміна температури зміна тиску
Вплив концентрації речовин 2SO2(г)+O2(г) 2SO3(г) Зовнішній вплив Відповіднадія системи Висновок ЗменшенняконцентраціїSO3 (вилучаємо, відбираємо) ЗбільшенняконцентраціїSO3 (утворює) Зміщення в бік прямої реакції ЗбільшенняконцентраціїSO2 (додаємо) ЗменшенняконцентраціїSO3 (витрачає) Зміщення в бік прямої реакції
Вплив температури 4HCl(г)+O2(г) 2Cl2(г)+H2O(г), ∆Н=-116,4 кДж при екзотермічній реакції теплота виділяється, реагуюча система нагрівається при ендотермічній реакції теплота поглинається, система охолоджується Зовнішній вплив Відповіднадія системи Висновок Підвищеннятемператури (нагрівання) (охолодження) Зміщення в бік ендотермічноїреакції Зниженнятемператури (охолодження) (нагрівання) Зміщення в бік екзотермічноїреакції
Вплив тиску 4HCl(г)+O2(г) 2Cl2(г)+H2O(г), ∆Н=-116,4 кДж Зміною тиску можна змістити реакцію, в якій реагенти або продукти реакції знаходяться в газоподібному стані. Стан вказується праворуч біля індексів і до уваги беруться тільки газоподібні речовини, а саме їх об'єми, що за законом об'ємних відношень дорівнюють їх коефіцієнтам. Зовнішній вплив Відповіднадія системи Висновок Підвищеннятиску Зменшуєтиск (чим менший об'єм газів,тим менший тиск) Зміщення в бік реакції з меншим об'ємом газоподібних речовин Vp Зниженнятиску Підвищуєтиск (чим більший об'єм газів,тим більший тиск) Зміщення в бік реакції з більшим об'ємом газоподібних речовин PV
Вплив каталізатора 4HCl(г)+O2(г) 2Cl2(г)+H2O(г), ∆Н=-116,4 кДж . Каталізатори прискорюють пряму реакцію, а відповідно прискорюється і зворотня, тому каталізатори на зміщення хімічної рівноваги не впливають
Схожі презентації
Категорії