Презентація на тему:
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів.
Завантажити презентацію
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів.
Завантажити презентаціюПрезентація по слайдам:
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів. Тема уроку: Кошова Світлана Іванівна, вчитель хімії Шполянської загальноосвітньої школи I-III ступенів №5 Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл L/O/G/O
МЕТА УРОКУ: визначити місце окисно-відновних реакцій серед основних типів хімічних реакцій; визначати і застосовувати такі поняття: «ступінь окиснення», «окисник», «відновник», «окиснення», «відновлення», «електронний баланс»; навчитися складати рівняння окисно-відновні реакцій та розставляти коефіцієнти методом електронного балансу; з'ясувати значення окисно-відновних реакцій в природі та житті людини
Корозія − це явище руйнування металів унаслідок хімічних реакцій з речовинами навколишнього середовища
Девіз уроку: Навколишній світ – хімічна лабораторія, в якій щосекундно відбуваються окисно-відновні реакції.
Що ми називаємо хімічними реакціями? За якими ознаками класифікують хімічні реакції? Дайте визначення ступеня окиснення. Які значення має ступінь окиснення? Як визначається ступінь окиснення? Визначте ступінь окиснення елементів у речовинах: N2, NaCl, H2SO4. Дайте відповіді на запитання:
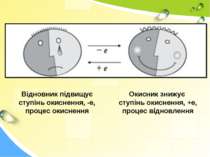
Окисно-відновні реакції - реакції, що відбуваються із зміною ступенів окиснення атомів, які входять до складу реагуючих речовин.
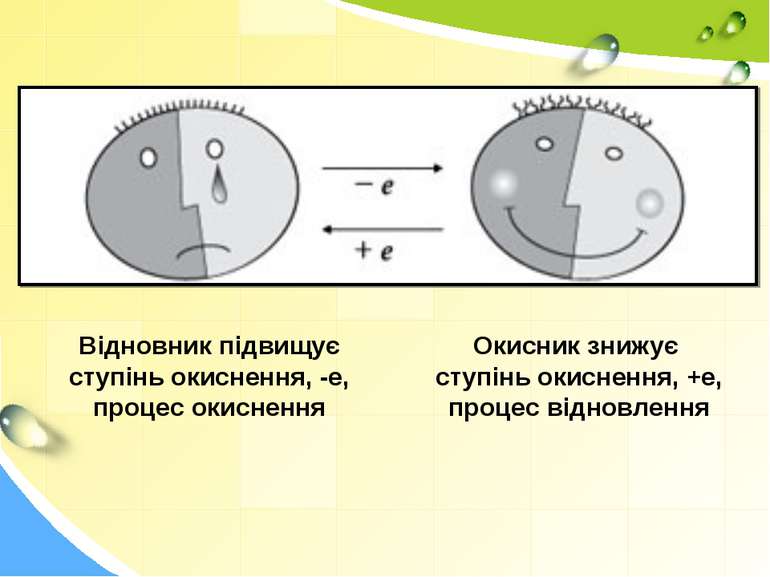
Відновник підвищує ступінь окиснення, -е, процес окиснення Окисник знижує ступінь окиснення, +е, процес відновлення
Алгоритм складання окисно – відновних реакцій методом електронного балансу Записати схему хімічної реакції. Визначити і записати ступені окиснення атомів у лівій і правій частинах складеної схеми, підкреслити символи елементів, що змінили ступені окиснення. Виписати елементи, що змінюють ступені окиснення. Скласти електронні рівняння, визначаючи число відданих і прийнятих електронів. Зрівняти число відданих і прийнятих електронів, підібравши найменше спільне кратне й додаткові множники. Отримані числа є коефіціентами в рівнянні реакції перед формулами речовин, що містять елементи, які змінили свої ступені окиснення. Всі інші коефіціенти отримуємо простим підбором. Визначаємо окисник і відновник, процеси окиснення та відновлення.
Знайдені методом електронного балансу коефіцієнти є остаточними. Змінювати їх не можна! Коефіцієнти з балансу спочатку запишіть у тій частині рівняння, де міститься більше сполук. В складних рівняннях коефіцієнти для Оксигену добирай в останню чергу. Корисні поради
Доберіть коефіцієнти у схемах окисно – відновних реакцій методом електронного балансу, вкажіть окисник і відновник, процеси окиснення та відновлення. Na + H2O → NaOH + H2 P + O2 → P2O5 H2S + O2→ SO2 + H2O 4. Ag + HNO3 → AgNO3 + NO2 +H2O
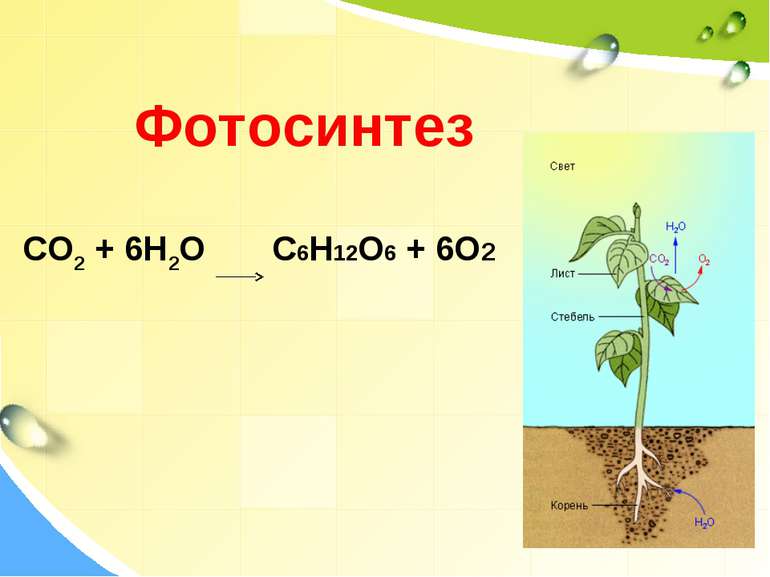
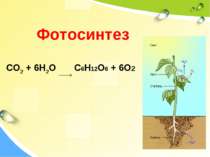
Окисно-відновні реакції в природі Завдяки окисно-відновним процесам на ранніх стадіях існування нашої планети утворилися гірські породи і мінерали
Цей природний катаклізм супроводжується низкою окисно-відновних реакцій: H2S + O2 SO2 + H2O Н2S + SO2 H2SO4 + S Виверження вулкану — це ОВР
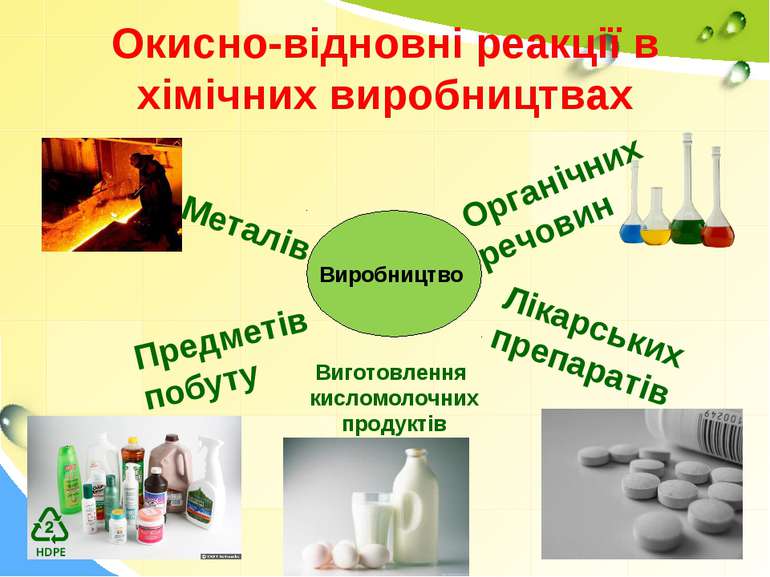
Окисно-відновні реакції в хімічних виробництвах Виробництво Металів Предметів побуту Органічних речовин Лікарських препаратів Виготовлення кисломолочних продуктів
Окисно-відновні реакції в побуті Почорніння срібних виробів Відбілювання і дезінфекція Ржавіння металів Хімічна завивка волосся
Чи досягнуто мети уроку? визначити місце окисно-відновних реакцій серед основних типів хімічних реакцій; визначати і застосовувати такі поняття: «ступінь окиснення», «окисник», «відновник», «окиснення», «відновлення», «електронний баланс»; навчитися складати рівняння окисно-відновні реакцій та розставляти коефіцієнти методом електронного балансу; з'ясувати значення окисно-відновних реакцій в природі та житті людини
Домашнє завдання § 16 Хімія 9 кл О.Г. Ярошенко Впр.3,4 с. 92 (всім обов’язково) Впр 5 с. 93 (за бажанням)
Схожі презентації
Категорії