Презентація на тему:
окисно-відновні реакції
Завантажити презентацію
окисно-відновні реакції
Завантажити презентаціюПрезентація по слайдам:
Окисно-відновні реакції, їхнє значення. Процеси окиснення, відновлення, окисники, відновники.
Мета. Сформувати знання про окисно-відновні реакції. Сформувати поняття про процеси окиснення, відновлення. Навчити розрізняти які з речовин є окисниками, а які відновниками
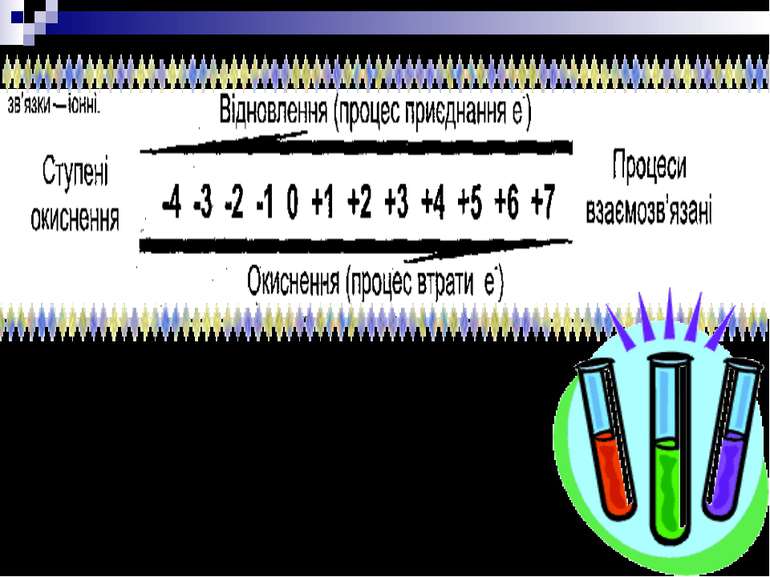
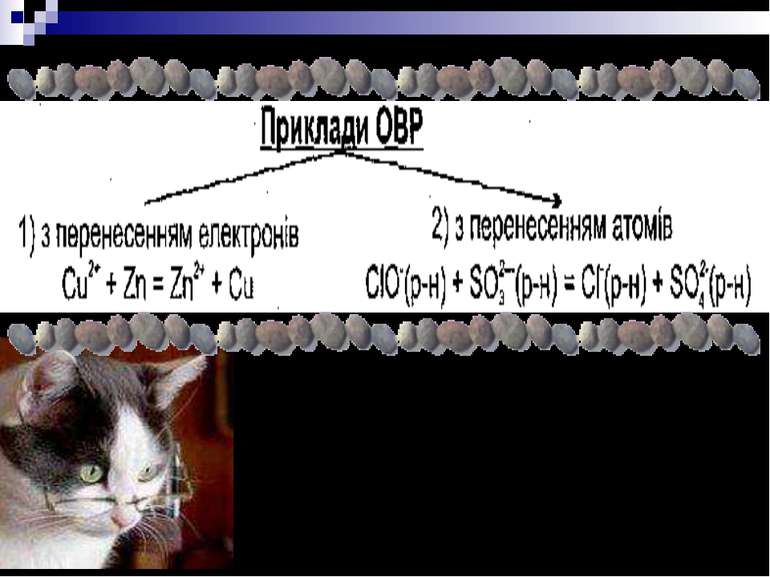
Окисно - відновними реакціями (ОВР) називають процеси, які здійснюються при переході електронів або атомів від одних частинок до інших, що призводить до зміни ступенів окиснення атомів елементів, які беруть участь у реакції.
Ступінь окиснення (С.О.) — умовна величина, що показує заряд того чи іншого елемента в сполуці . 1. Ступінь окиснення элемента в прості речовині = 0. H20 ; O20 ; F20 ; Cl20 ; Ca0. 2. Ступінь окиснення деяких элементів в сполуці: - H+1 - О-2 Ступінь окиснення металу співпадає з його валентністю : Na+1 ; K+1 ; Ca+2 ; Mg+2 ; Ba+2 ; Al+3 . 3. Сума ступенів окисненя элементів в сполуці, з врахуванням коэфіціентів= 0.
С.о. оксигену в оксиді =-2. С.о. водню в сполучені з неметалами=+1. С.о. металів 1 групи гол.підгр. =+1. С.о. металів 2 гр. гол. підгр. =+2. С.о. алюмінію =+3.
Правила складання хімічної формули: 1. На першому місці знаходиться элемент с позитивним ступенем окиснення. 2. На останьому місці знаходиться элемент с негативним ступенем окиснення
Находження ступеня окиснення элементів в сполуці. H2СO3 H С +1 О -2 +1 -2 Х 2 . (+1) + Х + 3 . (-2) = 0 2 + Х - 6 = 0 Х = +4 +4
Бинари – Оксиди Гідриди Хлориди Сульфіди Нітриди Фосфіди Карбіди Силіциди -2 O -1 H -1 Cl -2 S -3 N -3 P -4 C -4 Si Це речовини що складаються з двох элементів. +2 -2 +4 -2 +1 -2 +4 -2 CaO, SiO2, H2O, CO2, +1 -1 +2 -1 NaH , CaH2 , +1 -1 +1 -1 +3 -1 HCl, NaCl, FeCl3, +1 -2 +1 -2 +2 -2 H2S, Na2S, FeS, +1 -3 +2 -3 +3 -3 H3N, Ca3N2, AlN, +1 -3 +2 -3 +3 -3 H3P, Ca3P2 AlP, +1 -4 +2 -4 +3 -4 H4C, Ca 2C, Al4C3, +2 -4 +3 -4 Mg2Si, Al4Si3. +1 -3 +2 -3 +3 -3 H3P, Ca3P2 AlP,
Схожі презентації
Категорії