Презентація на тему:
КИСЛОТНО-ОСНОВНА РІВНОВАГА В БІОСИСТЕМАХ. БУФЕРНІ РОЗЧИНИ
Завантажити презентацію
КИСЛОТНО-ОСНОВНА РІВНОВАГА В БІОСИСТЕМАХ. БУФЕРНІ РОЗЧИНИ
Завантажити презентаціюПрезентація по слайдам:
Властивості розчинів електролітів. Константа дисоціації. Теорії кислот і основ. Теорія електролітичної дисоціації. Іонний добуток води. Буферні розчини, їх склад. Рівняня Гендерсона-Гассельбалха. Механізм буферної дії. Буферна ємність. Буферні системи крові. Кислотно-основний стан крові.
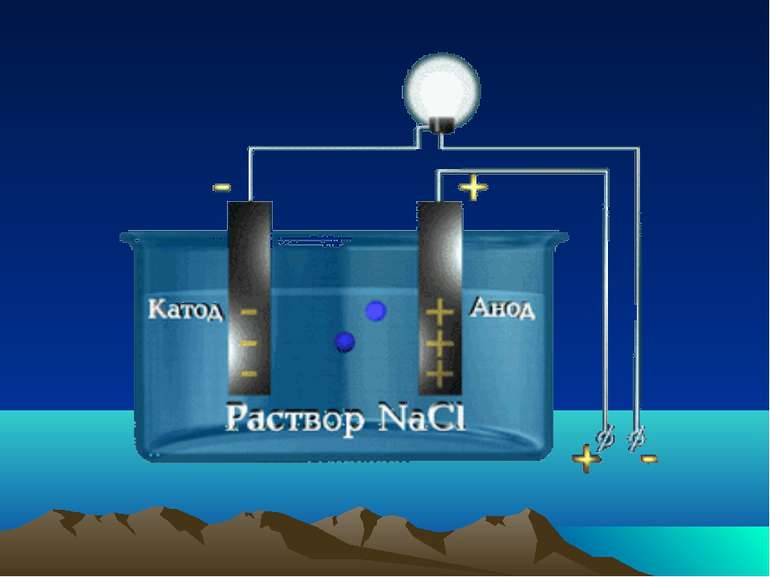
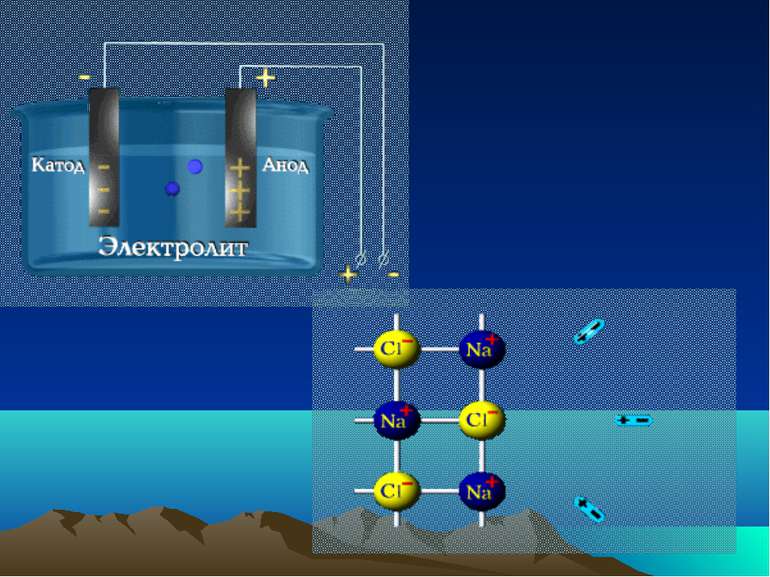
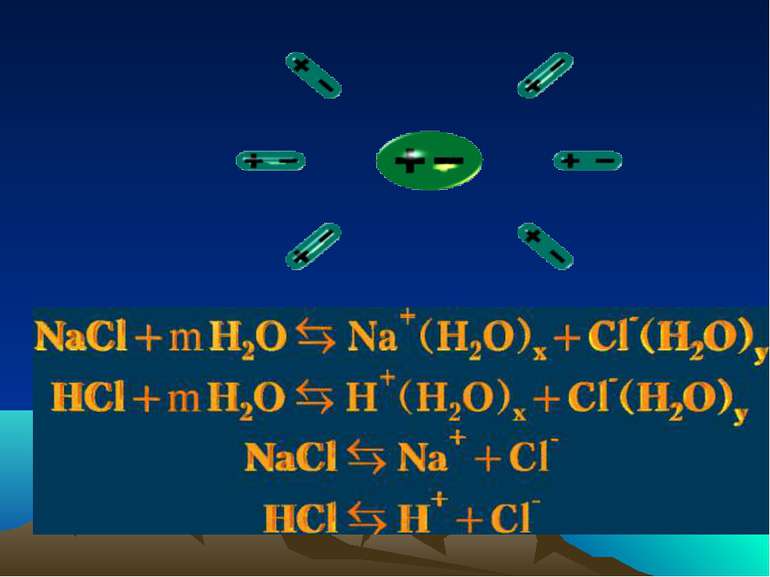
Теорії кислот і основ Електролітична теорія С.Арреніуса Кислоти — електроліти, які при дисоціації у водних розчинах, як катіони дають тільки катіони гідрогену (гідроксонію —H3O+). Наприклад HNO3 ↔ H+ + NO3− Основи — електроліти, які при дисоціації у водних розчинах як аніони дають тільки аніони гідроксиду (OH–) и катіони. Наприклад KOH ↔ K+ + OH–.
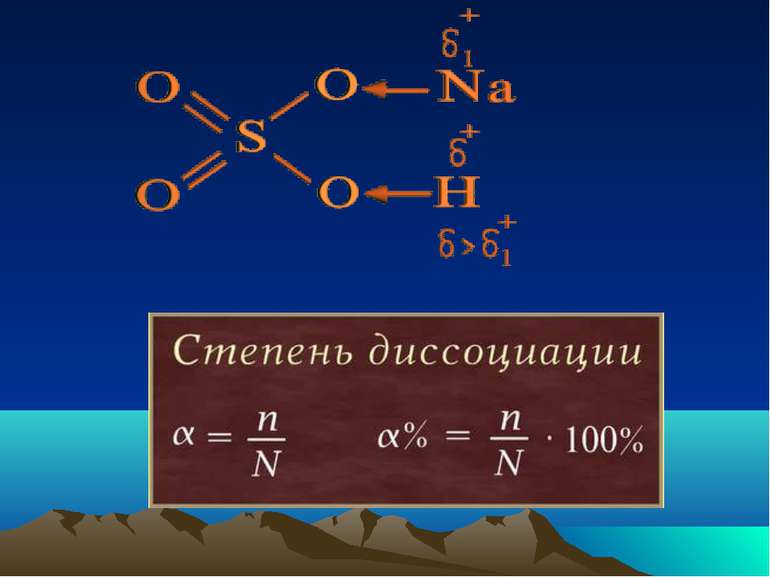
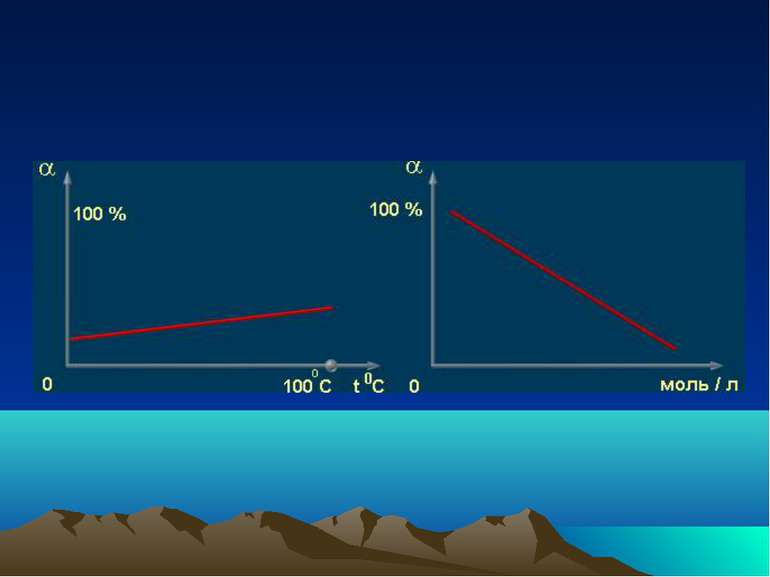
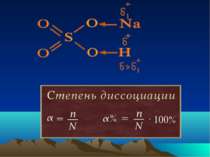
Класифікація електролітів Сильні електроліти α > 30 % Електроліти середньої сили 3 % < α < 30 % Слабкі електроліти α < 3 %
Сильні електроліти Середні водорозчинні солі Мінеральні кислоти Н2 SО4 , HCl, HNO3, HClO4, HBr Гідроксиди лужних і лужноземельних металів NaOH, KOH, Ca(OH)2, Ba(OH)2
Протонна (протолітична) теорія кислот і основ Й. Бренстеда і Т.Лоурі. -кислота = це сполука, яка віддає протон, є донором протонів Н+ НAn ↔ H+ + An- - основа - це сполука, яка приєднує протон, є акцептором протонів В + Н+ ↔ ВН
Електронна теорія кислот і основ Т.Льюіса -основа - це сполука, яка є донором электронної пари -кислота це сполука, яка є акцептором электронної пари
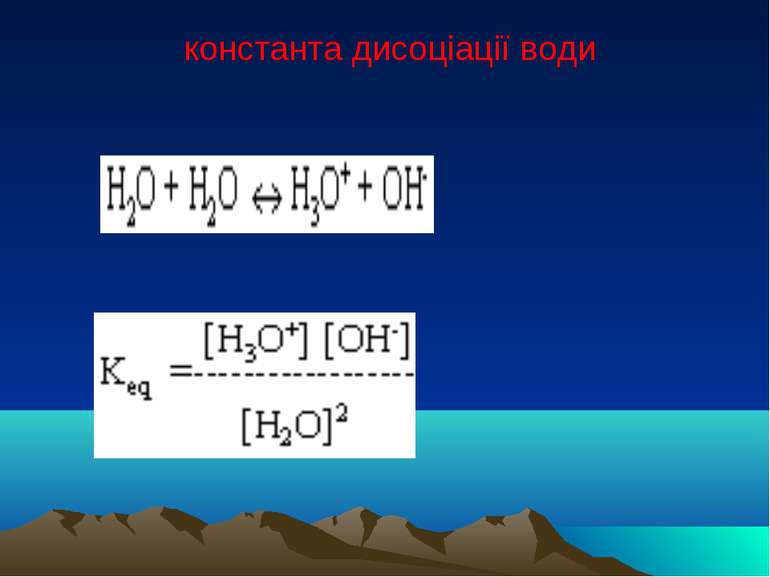
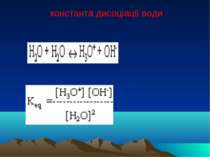
Дисоціація води Вода є слабким електролітом і дисоціює на гідроксид іони і іони гідрогену Н2О = H+ + ОН- В розчинах вільного протона (H+) немає, він знаходиться в гідратованому стані. Так, протон може зв'язуватися з однією молекулою води, утворюючи іон гідроксонію H3O+, двома Н5О2+, трьома Н7О3+.
Водневий показник Кw = [H+][ОН-] -7 [Н+] = [ОН-] = 10 моль/л нейтральне середовище -7 -7 [Н+] > 10 кисле, [Н+] < 10 лужне.
Водневий показник Водневий показник - від*ємний десятковий логарифм активності (концентрації) іонів гідрогену рН = - lg[H+]
Водневий показник Вода pH = 7.0 Кислі розчини рН < 7.0 Основні розчини рН > 7.0. 1 М NaOH - 14 Нашатирний спирт - 12 Морська вода – 8 Молоко - 7 Кров - 7.4 Слина - 6.6 Томатий сік - 4.4 Шлунковий сік - 1.5 1 М НСl - 0
Буферні системи Буферні системи – це розчини які здатні підтримувати сталим рН, як при додаванні сильних кислот або основ, так і при розведенні.
Буферні системи містять Слабку кислоту і сіль цієї кислоти, утворену сильною основою СН3СООН + СН3СООNa Слабку основу і сіль цієї основи, утворену сильной кислотою NH4OH +NH4Cl Солі багатоосновних кислот NaH2PO4+Na2HPO4
Склад буферних розчинів з точки зору теорії Бренстеда-Лоурі : (а) слабка кислота та спряжена до неї основа Н2СО3 / НСО3- СН3СООН / СН3СОО- H2PO4-/ HPO42- (б) слабка основа і спряжена до неї кислота NН3 / NH4+
Ацетатний буферний розчин (діапазон рН 3,7-5,6) СН3СООNa→СН3СОО- + Na+ СН3СООH ↔ СН3СОО- + H+ Константа дисоціації [СН3СОО- ] [H+] Ка = ------------------------- [СН3СООH ] Ка [СН3СООН ] [H+] = ------------------------- [H+]= Ка [кислота ]/ [основа] [СН3СОО- ]
Ацетатний буферний розчин (діапазон рН 3,7-5,6) В логарифмічному вигляді [кислота ] рН = рКа – lg -------------- [основа ] рН = рКа + lg [основа ]/ [кислота ]
Механізм буферної дії ацетатного буферу СН3СООNa→СН3СОО- + Na+(повна дисоціація) СН3СООH ↔ СН3СОО- + H+ (часткова дисоц-я) В розчині є іони СН3СОО-, H+, Na+ при додаванні сильної кислоти: СН3СОО- + H+ ↔ СН3СООH (сильна кислота замінюється на слабку) при додаванні сильної основи: СН3СООH +ОН-→ СН3СОО- + Н2О
Рівняння Гендерсона - Гассельбалха [кислота ] рН = рКа – lg -------------- [основа ] [основа] рН = рКа + lg ------------ [кислота ] Для розрахунку рН буферних розчинів
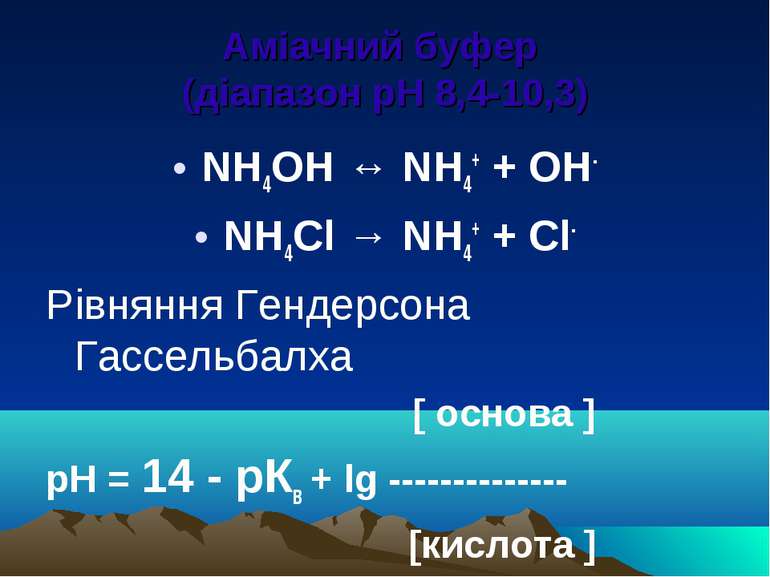
Аміачний буфер (діапазон рН 8,4-10,3) NH4OH ↔ NH4+ + OH- NH4Cl → NH4+ + Cl- Рівняння Гендерсона Гассельбалха [ основа ] рН = 14 - рКв + lg -------------- [кислота ]
Механізм дії аміачного буферу В розчині є NH3 і NH4+ NH3+ НОН ↔NH4+ + ОН- При додаванні кислоти: NH3 + HCl ↔ NH4Cl При додаванні лугу: NH4+ + ОН- ↔ NH4OH
Буферна ємність Буферна ємність – це число моль еквівалентів сильної кислоти або сильної основи, яке необхідно додати до 1 л буферного розчину, щоб змінити його рН на одиницю. В = n / ΔрН Буферна ємність залежить від концентрації компонентів та їх співвідношення
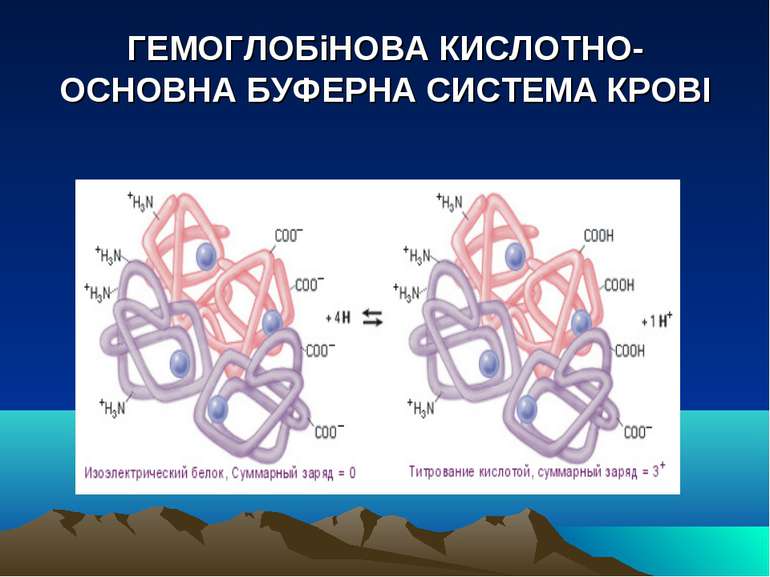
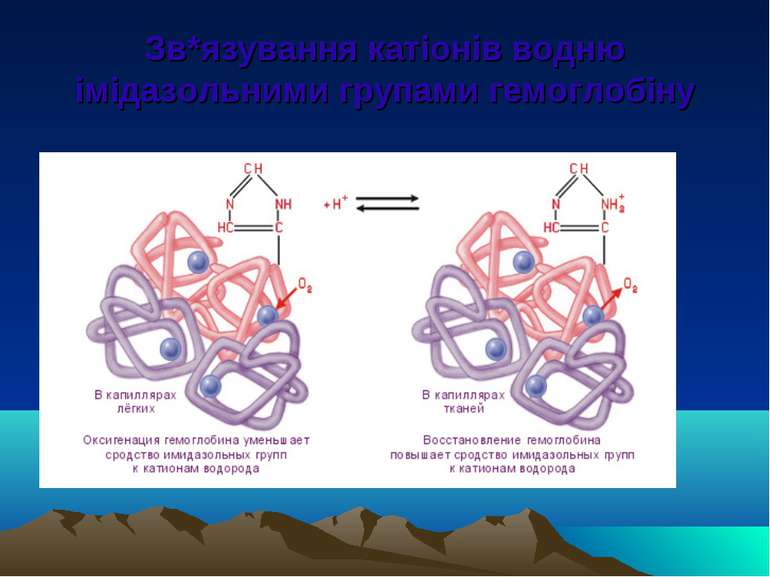
БУФЕРНі СИСТЕМи ОРГАНіЗМу 1. Гідрокарбонатна буферна система: H2CO3 / NaHCO3 2. Гемоглобінова буферна система крові: НHb / K-Hb і НHbO2 / K-Hb02 3. Буферна система білков плазми крові: Протеїнат Na / Білки (слабкі кислоти) 4. Фосфатна буферна система: Na2HPO4 (основний фосфат) / NaH2PO4 (кислий фосфат
Фізіологічні та фізико-хімічні механізми В процесі обміну речовин в клітинах, органах і тканинах неперервно утворюються продукти кислотного характеру. Кінцевий продукт окиснення поживних речовин – СО2 -накопичується в крові, створюється загроза підвищення концентрації катіонів Н+. Але надлишок СО2 збуджує дихальний центр, який посилає імпульси до дихальної мускулатури і зумовлює акти вдиху і видиху.
Схожі презентації
Категорії












![Водневий показник Кw = [H+][ОН-] -7 [Н+] = [ОН-] = 10 моль/л нейтральне серед... Водневий показник Кw = [H+][ОН-] -7 [Н+] = [ОН-] = 10 моль/л нейтральне серед...](https://svitppt.com.ua/images/19/18382/770/img17.jpg)








![Рівняння Гендерсона - Гассельбалха [кислота ] рН = рКа – lg -------------- [о... Рівняння Гендерсона - Гассельбалха [кислота ] рН = рКа – lg -------------- [о...](https://svitppt.com.ua/images/19/18382/770/img26.jpg)




















![Водневий показник Кw = [H+][ОН-] -7 [Н+] = [ОН-] = 10 моль/л нейтральне серед... Водневий показник Кw = [H+][ОН-] -7 [Н+] = [ОН-] = 10 моль/л нейтральне серед...](https://svitppt.com.ua/images/19/18382/210/img17.jpg)








![Рівняння Гендерсона - Гассельбалха [кислота ] рН = рКа – lg -------------- [о... Рівняння Гендерсона - Гассельбалха [кислота ] рН = рКа – lg -------------- [о...](https://svitppt.com.ua/images/19/18382/210/img26.jpg)































