Презентація на тему:
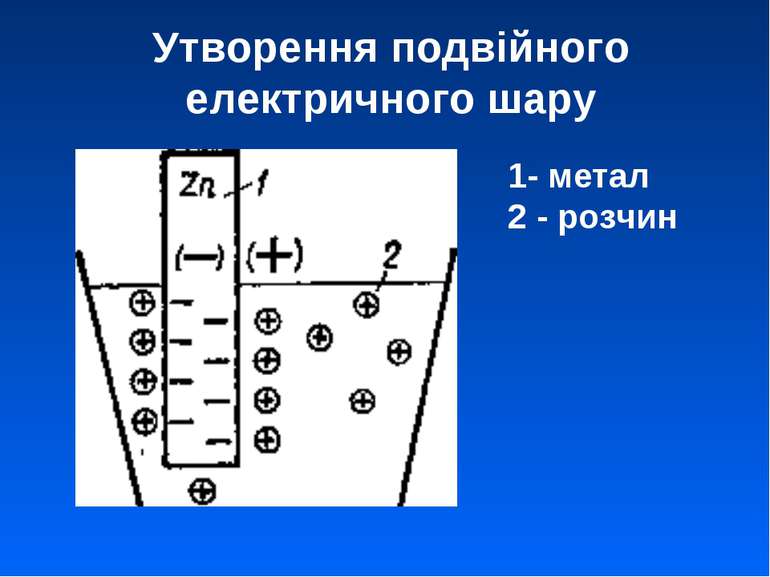
Електродні потенціали та механізм їх виникнення
Завантажити презентацію
Електродні потенціали та механізм їх виникнення
Завантажити презентаціюПрезентація по слайдам:
План 1. Електродні процеси. Електрод-ний потенціал. 2. Електроди різних типів. 3. Дифузійний і мембранний потен-ціали. 4. Гальванічні елементи .ЕРС. 5. Кінетика електрохімічних про-цесів.
Схема цинкового електроду (електрод І роду) Zn ZnSO4 Zn2+ | Zn φZn2+/Zn = φ0Zn2+/Zn + 0.059/2 lgaZn2+ Zn2+ + 2e = Zn
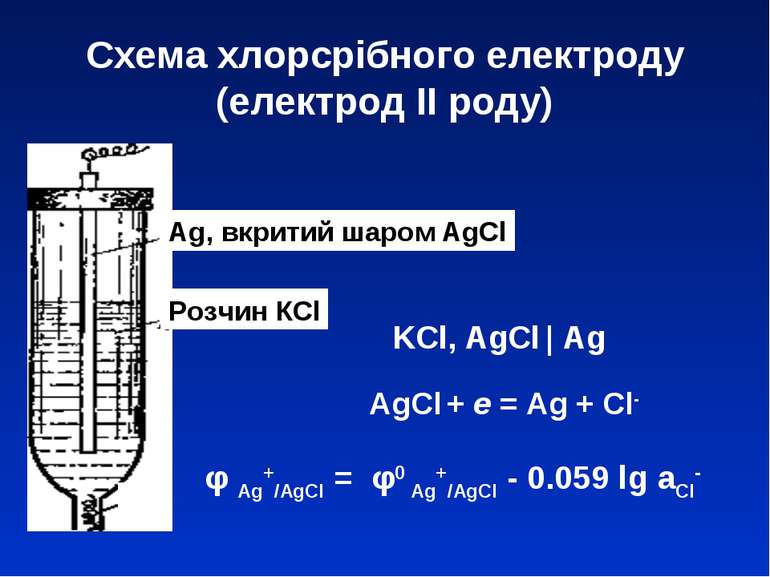
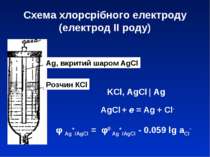
Схема хлорсрібного електроду (електрод ІІ роду) Ag, вкритий шаром AgCl Розчин КCl KCl, AgCl | Ag φ Ag+/AgCl = φ0 Ag+/AgCl - 0.059 lg aCl- AgCl + e = Ag + Cl-
Схема окисно-відновного електроду (електрод ІІІ роду) Pt FeCl3 + FeCl2 Fe3+ , Fe2+ | Pt φFe3+/Fe2+ = φ0Fe3+/Fe2+ + 0.059 (lg aFe3+- lg aFe2+) Fe3+ + e = Fe2+
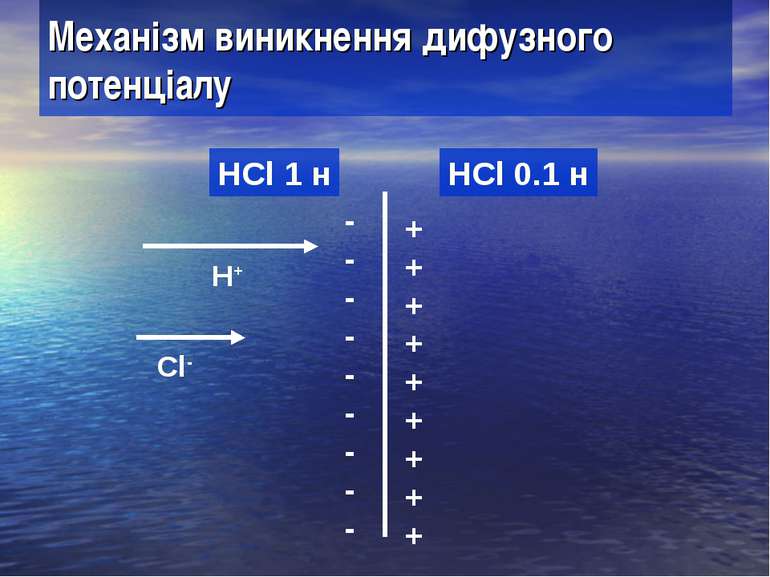
Механізм виникнення дифузного потенціалу HCl 1 н HCl 0.1 н H+ Cl- + + + + + + + + + - - - - - - - - -
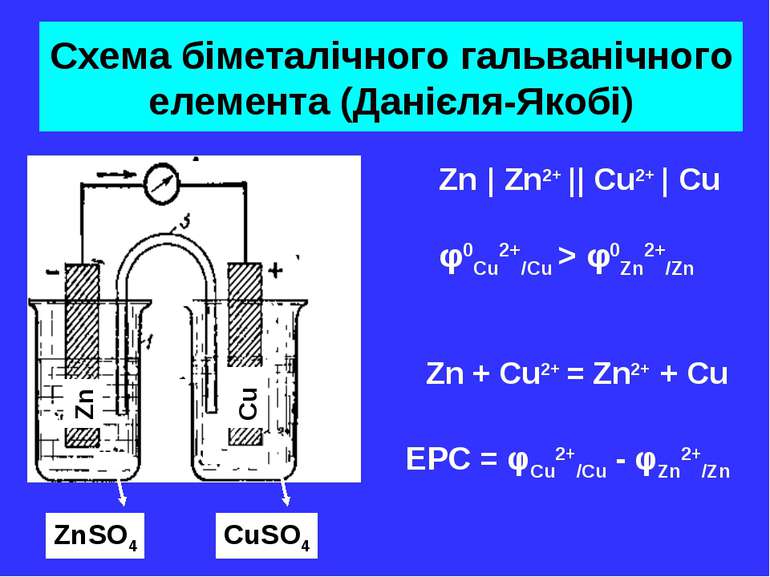
Схема біметалічного гальванічного елемента (Данієля-Якобі) Zn Cu ZnSO4 CuSO4 Zn + Cu2+ = Zn2+ + Cu Zn | Zn2+ || Cu2+ | Cu φ0Cu2+/Cu > φ0Zn2+/Zn EPC = φCu2+/Cu - φZn2+/Zn
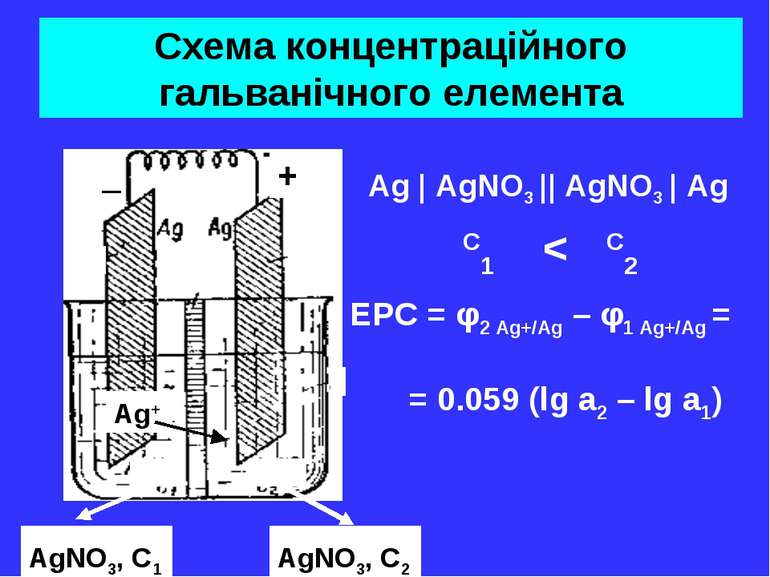
Схема концентраційного гальванічного елемента Ag | AgNO3 || AgNO3 | Ag C1 < C2 _ + AgNO3, C1 AgNO3, C2 Ag+ EPC = φ2 Ag+/Ag – φ1 Ag+/Ag = = 0.059 (lg a2 – lg a1)
Електроліз водного розчину H2SO4 Pt | H2SO4 | Pt _ + Aнод: OH- - e = ½ H2O + ¼ O2 φ = φ0 + 0.059 (lg P1/4 – lg a -) O2/OH- O2 OH Kатод: H+ + e = ½ H2 φ = φ0+ + 0.059 (lg P1/2 - lg a +) H /H2 H2 H
Схожі презентації
Категорії