Презентація на тему:
Водневий показник. Буферні системи, класифікація та механізм їх дії.
Завантажити презентацію
Водневий показник. Буферні системи, класифікація та механізм їх дії.
Завантажити презентаціюПрезентація по слайдам:
Водневий показник. Буферні системи, класифікація та механізм їх дії. Лектор асистент кафедри фармацевтичної хімії Бурмас Наталія Іванівна e-mail: Natashenka-Burmas@rambler.ru
План лекції: 1. Водневий показник 2. Буферні розчини. Типи буферних систем 3. Буферна дія 4. Буферна ємність 5. Буферні системи організму. Кислотно-основний стан крові
1. Водневий показник Водневий показник, pH — величина, що показує міру активності іонів гідроксонію(Н3О+) в розчині, тобто ступінь кислотності або лужності цього розчину. Формула для обчислення величини рН (що не має одиниць розмірності) є наступною: pH = lg [H3O+]
Наприклад, якщо до чистої води додати стільки кислоти, щоб концентрація Н+ підвищилась до 10-3, то Наприклад, якщо до чистої води додати стільки лугу, щоб концентрація ОН- підвищилась до 10-5, то Нейтральне середовище: [H+]=[OH-]=10-7 моль/л Кисле середовище: [H+] 10-7 моль/л. Проте числа у степенях незручні тому введено рН= -lg[H3O+]. Нейтральне середовище: рН=7 Кисле середовище: рН7 . Таким чином рН змінюється від 1 до 14. Розчини, значення рН від 0 до 3 – сильнокислі; 4 до 6 – слабокислі; 8 до 10 – слаболужні; 11 до 14 – сильнолужні
Для швидкого та наближеного визначення рН різних розчинів користуються індикаторами — складними органічними речовинами, які за хімічним характером є слабкими кислотами або основами.
2. Буферні розчини. Типи буферних систем Буферними системами називають розчини, які здатні зберігати постійну концентрацію іонів Гідрогену, тобто значення рН середовища, при добавлянні до них невеликих кількостей кислоти чи лугу або при розбавлянні їх.
Типи буферних систем До буферних систем належать суміші, що містять: Слабку кислоту і сіль цієї кислоти, утворену сильною основою, наприклад СН3СООН + СН3СООNa (ацетатний буфер); Слабку основу і сіль цієї основи, утворену сильною кислотою, наприклад NH4OH + NH4Cl (аміачний буфер); Солі багатоосновних кислот, наприклад NaH2PO4 + Na2HPO4 (фосфатний буфер); Na2CO3 + NaHCO3 (карбонатний буфер); Сильну або слабку кислоту (кислотний компонент) і гліцин або луг (основний компонент), наприклад HCl + NH2CH2COOH (діапазон рН 1,0-3,7), NH2CH2COOH + NAOH (діапазон рН 2,2 – 6,5).
Вплив розведення на рН буферних систем. Буферні розчини часто доводиться розбавляти водою, особливо у біохімічних дослідженнях при вимірюванні рН малих об'ємів біорідин, зокрема крові. Проте незначні зміни рН середовища все-таки відбуваються, що пояснюють впливом розбавляння на ступінь дисоціації слабкої кислоти та на ступінь гідролізу. Отже здатність буферних розчинів зберігати сталим значення рН при розбавлянні або при додаванні кислот є обмеженим.
3. Буферна дія За рахунок часткової дисоціації кислоти та повної дисоціації солі в розчині будуть знаходитись одночасно іони СН3СОО-, Н+, Na+: CH3COONa → CH3COO- + Na+ CH3COOH →CH3COO- + H+ Якщо до нього добавити сильної кислоти, то іони Гідрогену реагуватимуть з аніонами солі, утворюючи слабку ацетатну кислоту: CH3COO- + H+ → CH3COOH (рКа = 4,75) Сильна кислота заміняється еквівалентною кількістю слабкої кислоти і рівновага зміщується вліво. При добавлянні лугу до буферного розчину гідроксид-іони взаємодіятимуть з іонами Н+ ацетатної кислоти з утворенням молекул води: CH3COOH + ОН- →CH3COO- + H2О
Рівняння Гендерсона-Гассельбаха Рівняння Гендерсона-Гассельбаха дозволяє сформулювати ряд важливих висновків: 1. рН буферних розчинів залежить від негативної дії логарифма константи дисоціації слабкої кислоти р Ка чи підстави рКв і від відношення концентрацій компонентів КО-пари, але практично не залежить від розбавлення розчину водою. 2. Значення рКа будь-якої кислоти і рКв будь-якого небезпідставно можна обчислити за вимірюваним рН розчину, якщо відомі молярні концентрації компонентів. 3. Рівняння Гендерсона-Гассельбаха можна використовувати і для того, щоб дізнатися, в якому співвідношенні потрібно узятий компоненти буферної суміші, щоб приготувати розчин з заданим значенням рН.
4. Буферна ємність. Кількісною мірою стійкості буферних систем підтримувати стале значення рН є величина буферна ємність. Буферною ємністю називають кількість моль-еквівалентів сильної кислоти, яку необхідно долити до одного дециметра кубічного буферного розчину, щоб змінити його рН на одиницю. В=C·V/∆pH·Vбуф, де В – буферна ємність, С – концентрація кислоти або основи, V – обєм даного електроліту, Vбуф – обєм буферного розчину, ∆pH – зміна рН.
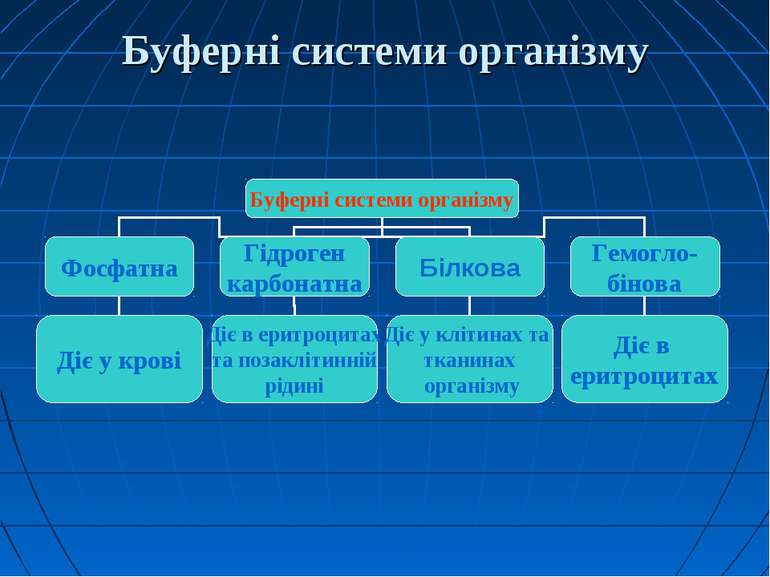
5. Буферні системи організму. Кислотно-основний стан крові Організм людини володіє спеціальним механізмом координації фізіологічних та біохімічних процесів і може підтримувати на певному рівні вміст різних речовин, а саме: газів, води, електролітів, іонів металів і Гідрогену, біолігандів. Ця координація за пропозицією К.Кеннона була названа гомеостазом. Під фізико-хімічним механізмом треба розуміти дію буферних систем. Вони надають можливість організму, як відкритій термодинамічній системі реалізувати принцип Ле Шательє, тобто активно протидіяти впливу зовнішніх чинників, спрямованих на зміну кислотності його фізілогічних рідин – крові, жовчі, сечі, секретів внутрішніх залоз.
1. Гемоглобінова буферна система рахуться найбільшою – до 75 % від усієї буферної ємності крові. Ця система складється з відновленого гемоглобіна (ННb) та його калієвої солі (КНb). Буферні властивості ННb зумовлені тим, що він будучи більш слабкою кислотою, ніж Н2СО3, віддає їй йони К+, а сам приєднуючи Н+, стає слабко дисоційованою кислотою. В тканинах система гемоглобіну виконує функцію основи, попереджуючи закислення крові внаслідок надходження до неї СО2 та Н+ - йонів. В легенях гемоглобін крові поводить себе як кислота, попереджуючи залужнення крові після видалення з неї СО2.
2. Гідрогенкарбонатна буферна система за силою займає друге місце, а за швидкістю реагування – перше. Складається з вугільної кислоти та бікарбонату натрію (плазма крові) або бікарбонату калію (цитоплазма клітин). Формула карбонатної буферної системи – або При утворенні в організмі надлишку кислоти, більш сильної, ніж вугільна, ця кислота реагує з сіллю вугільної кислоти (з бікарбонатом калію чи натрію). В результаті утворюється сіль цієї кислоти і слабка вугільна кислота, котра погано дисоціюєю. Таким чином, сильна кислота заміщується більш слабкою – запобігає зміні рН.
Характеристика гідрогенкарбонатної буферної системи: 1.Вона забезпечує швидку нейтралізацію кислот та лугів, що утворюються в ході метаболізму. 2.Має досить велику ємність – від 15 до 40% від загальної буферної ємності крові. 3.Швидко відновлюється за рахунок діяльності легень і нирок.
3. Фосфатна буферна система утворена дигідрофосфатом (NaH2PO4) та гідрофосфатом (Na2HPO4) натрію. Відповідно, формула формула фосфатної буферної системи така: Ця буферна система забезпечує підтримку рН на рівні 7,4 при співвідношенні основної та кислої солей, що рівне 4:1. При введені в кров більш сильної кислоти, вона прореагує з Na2HPO4, утворюючи нейтральну сіль та збільшуючи кількість дигідрофосфату натрію. При введенні в кров сильної основи, вона прореагує з NaH2PO4, утворивши гідрофосфат натрію. Надлишок в крові дигідрофосфату та гідрофосфату натрію буде виводитись із сечею.
4. Білкова буферна система. Білки плазми крові завдяки своїм амфотерним властивостям відіграють певну роль в кислотно-основній рівновазі. В кислому середовищі білки реагують як основи, а в основному як кислоти.
Кислотно-основний стан крові Невід'ємною складовою частиною гомеостазу внутрішнього середовища організму є кислотно-основний стан (КОС), що забезпечує оптимальні умови перебігу обмінних процесів і спрямований на підтримання сталої концентрації іонів Гідрогену. За нормальних умов рН крові коливається у межах 7,25 – 7,44. Зміщення КОС крові у напрямку підвищення концентрації іонів Гідрогену називається ацидозом, а в напрямку зниження їх концентрації – алкалозом.
Дайте будь-ласка відповіді на дані запитання. 1. Що таке буферна система? 2. Поясніть вплив розведення розчину на pH буферних систем? 3. При яких умовах виникає в організмі ацидоз і алкалоз? Ваші відповіді присилайте на даний e-mail: Natashenka-Burmas@rambler.ru
Схожі презентації
Категорії