Презентація на тему:
Економіки
Завантажити презентацію
Економіки
Завантажити презентаціюПрезентація по слайдам:
Л Е К Ц ІЯ 1 доц. Л.В. Вронська Стандартизація лікарських засобів: суть, мета, основні поняття. Загальні принципи системи стандартизації лікарських засобів.
План Суть поняття “стандартизація” і мета стандартизації ЛЗ Законодавчі акти і державна політика та регулювання Шляхи стандартизації ЛЗ Загальні принципи системи стандартизації лікарських засобів Фармаконагляд як складова фармацевтичної системи якості
Стандартизація лікарських засобів - діяльність щодо встановлення правил, норм і характеристик для загального і багаторазового використання щодо реально існуючих або потенційних завдань з метою створення, виробництва, контролю якості, реєстрації та торгівлі лікарських засобів, яку здійснює орган державного контролю якості лікарських засобів.
Основні поняття: Лікарські засоби - речовини або їх суміші природного, синтетичного чи біотехнологічного походження, які застосовуються для запобігання вагітності, профілактики, діагностики та лікування захворювань людей або зміни стану і функцій організму ЗУ “Про лікарські засоби” Лікарські засоби – речовини або суміш речовин природного або синтетичного походження, які застосовуються для лікування, профілактики і діагностики хвороб Чекман “Терміни в фармакології і фармації”
До лікарських засобів належать: діючі речовини (субстанції); готові лікарські засоби (лікарські препарати, ліки, медикаменти); гомеопатичні засоби; засоби, які використовуються для виявлення збудників хвороб; засоби для боротьби із збудниками хвороб або паразитами; лікарські косметичні засоби; лікарські домішки до харчових продуктів
готові лікарські засоби (лікарські препарати, ліки, медикаменти) - дозовані лікарські засоби в тому вигляді та стані, в якому їх застосовують діючі речовини (субстанції) - біологічно активні речовини, які можуть змінювати стан і функції організму або мають профілактичну, діагностичну чи лікувальну дію та використовуються для виробництва готових лікарських засобів
допоміжні речовини - додаткові речовини, необхідні для виготовлення готових лікарських засобів технологічний регламент виготовлення лікарського засобу (далі - технологічний регламент) - нормативний документ, в якому визначено технологічні методи, технічні засоби, норми та нормативи виготовлення лікарського засобу
якість лікарського засобу - сукупність властивостей, які надають лікарському засобу здатність задовольняти споживачів відповідно до свого призначення і відповідають вимогам, встановленим законодавством стара редакція ЗУ “Про лікарські засоби”
“якість лікарського засобу — сукупність властивостей, які характеризують його безпечність та ефективність і надають лікарському засобу здатність задовольняти споживачів згідно з його призначенням і яка не визначається лише вимогами до кінцевого продукту, а може розглядатися у сукупності даних щодо його створення, випробування та виробництва відповідно до наведених у реєстраційних матеріалах, ТНД, АНД та інших реєстраційних матеріалів.” Згідно змін до закону України “Про лікарські засоби”
Основні поняття: технологічна нормативна документація (ТНД) - документація, що затверджується суб’єктом господарювання, яка визначає вимоги щодо технологічних процесів, методів, норм і нормативів, комплексу технологічного обладнання і приміщень, умов та порядку проведення технологічного процесу, що забезпе-чує випуск лікарських засобів згідно з вимогами АНД.
Основні поняття: фармакопейна стаття - нормативно-технічний документ, який встановлює вимоги до лікарського засобу, його упаковки, умов і терміну зберігання та методів контролю якості лікарського засобу АНД МКЯ
Державна Фармакопея України правовий акт, який містить загальні вимоги до лікарських засобів, фармакопейні статті, а також методики контролю якості лікарських засобів ЗУ “Про лікарські засоби”
Фармакопея — один з найстаріших нормативних документів, які регламентують виробництво і якість лікарських засобів, коли ще не було ні регуляторних органів, таких як Управління по контролю за харчовими продуктами і лікарськими засобами США (Food and Drug Administration — FDA) або Європейське агентство по лікарських засобах (European Medicines Agency, раніше відоме як ЕМЕА), ні стандартів, подібних ISO або GMP.
Перша фармакопея, про яку нам відомо, була видана в 1498 г. у Флоренції під назвою «Ricettario Fiorentino». Пройшло більше п'ятсот років, перш ніж глобалізація досягла такого рівня, коли країнам стало необхідно і важливо розробляти і приймати спільні стандарти якості лікарських засобів. Безумовно, це не могло не зачепити і фармакопейний процес: окремі країни, які не мають своїх фармакопей, користуються авторитетними виданнями (такими як, наприклад, американська або британська фармакопеї), створюють спільні фармакопеї (для прикладу європейську або міжнародну), експерти різних країн діляться своїм досвідом…
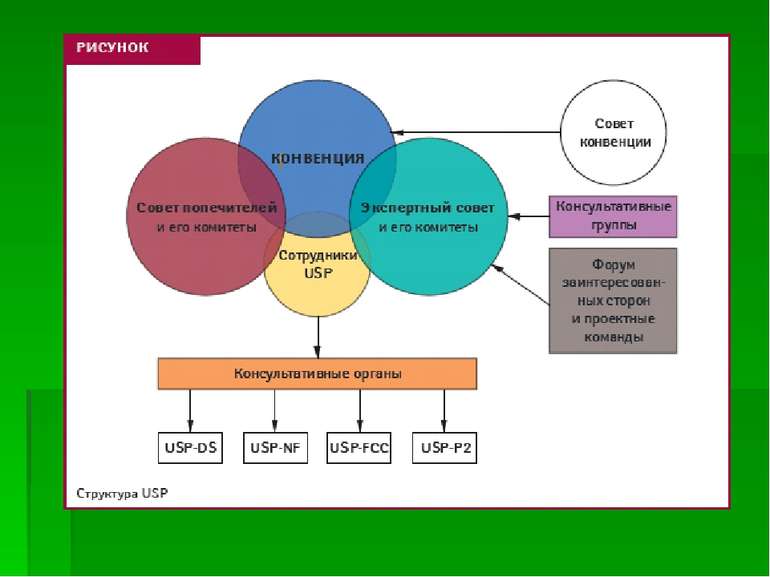
Пріоритети фармакопей в Україні ДФУ ЕP/ВР USP JP Міжнародна фармакопея ВОЗ Індійська, Китайська та ін. Роз’яснення ДФЦ МОЗ УКраїни
Державна фармакопея України є Конституцією якості лікарських засобів. Вона встановлює той рівень вимог до безпеки та якості ЛЗ, який держава гарантує своїм громадянам.
Державна політика у сфері створення, виробництва, контролю якості та реалізації лікарських засобів спрямовується на підтримку наукових досліджень створення та впровадження нових технологій розвиток виробництва високоефективних та безпечних лікарських засобів забезпечення потреб населення ліками належної якості та в необхідному асортименті Реалізація здійснення відповідних загальнодержавних програм пріоритетного фінансування їх надання пільгових кредитів встановлення податкових пільг тощо.
Державне Управління у сфері створення, виробництва, контролю якості та реалізації лікарських засобів здійснюють: Міністерство охорони здоров'я України Державний комітет України з медичної та мікробіологічної промисловості спеціально уповноважені ними державні органи
Державне управління у сфері обігу лікарських засобів здійснюється шляхом: реєстрації, сертифікації та стандартизації лікарських засобів; ліцензування, сертифікації, патентування і квотування окремих видів діяльності у сфері обігу лікарських засобів; атестації та сертифікації фахівців зайнятих у сфері обігу лікарських засобів; контролю виготовлення, виробництва, якості ефективності, безпеки реалізації лікарських засобів; регулювання цін і тарифів на лікарські засоби.
Державний контроль за додержанням умов виробництва лікарських засобів здійснюють Державний комітет України з медичної та мікробіологічної промисловості та уповноважені ним державні органи.
Спеціальним органом державного контролю якості лікарських засобів є Державна інспекція з контролю якості лікарських засобів Міністерства охорони здоров'я України з безпосередньо підпорядкованими їй державними інспекціями з контролю якості лікарських засобів в Автономній Республіці Крим, областях, містах Києві та Севастополі.
Державний контроль якості лікарських засобів це сукупність правових та організаційних заходів, спрямованих на додержання суб'єктами господарювання незалежно від форми власності та підпорядкування вимог законодавства щодо забезпечення якості, безпеки та ефективності лікарських засобів їх призначення під час виробництва (виготовлення), зберігання, транспортування, торгівлі, медичного застосування, умов відпуску, утилізації або знищення, реклами, а також щодо додержання ліцензійних умов виробництва лікарських засобів, оптової та роздрібної торгівлі лікарськими засобами.
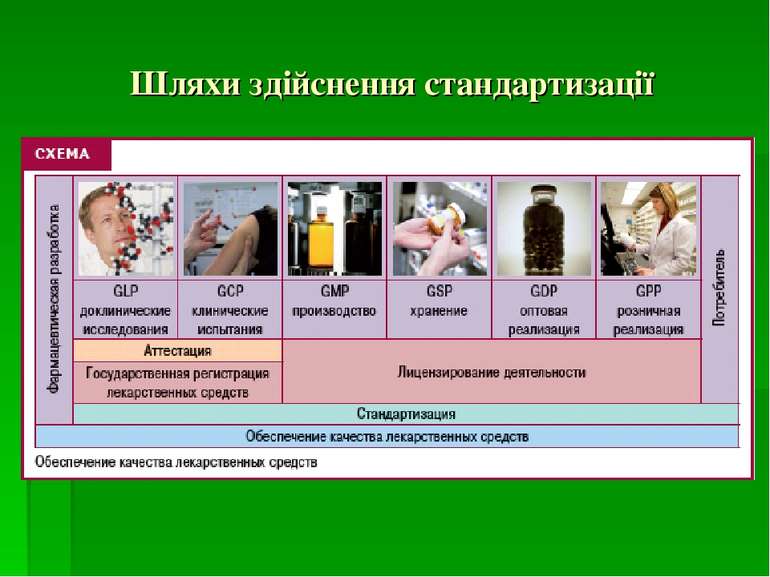
Якість ЛЗ закладається на етапі фармрозробки, для якої встановлений спеціальний методологічний підхід і специфічні підходи по відношенню до різних лікарських форм, генериків й оригінальних препаратів. Якість, закладена на етапі фармрозробки, проходить експертизу на етапі реєстрації, забезпечується при виробництві шляхом дотримання правил GMP, при дистриб’юції — шляхом дотримання вимог GDP і при роздрібній реалізації — шляхом виконання вимог GPP. Ефективність і безпечність розроблених ЛЗ підтверджується на етапах доклінічних і клінічних випробувань, а безпечність, виведених на ринок препаратів – досвідом їх клінічного застосування. Об’єктивність даних при цьому забезпечується шляхом дотримання правил GLP і GCP, а також фармаконаглядом.
належна лабораторна практика (GLР) - сукупність правил з планування, виконання, контролю, оцінки і документування лабораторних досліджень, які є частиною доклінічного вивчення і клінічних випробувань лікарських засобів і які забезпечують якість, точність і повноту отриманих даних. належна клінічна практика (GСР) - сукупність правил з планування, виконання, оцінки і документування клінічних випробувань лікарських засобів, додержання яких за-безпечує точність отриманих даних, захист прав осіб, які беруть участь у випробуваннях, конфіденційність даних про цих осіб.
належна виробнича практика (GMР) – сукупність організаційно-технічних заходів яка є частиною системи забезпечення якості, і гарантує, що продукція постійно вироблюється і контролюється за стандартами якості, які відповідають її призначенню та відповідно до вимог реєстраційного досьє. належна практика дистрибуції (GDР) - сукупність правил і вимог до дистрибуції, дотримання яких забезпечує якість лікарських засобів в процесі управління та організації їх оптової торгівлі на усіх її етапах.
Постановою КМУ від 28.10.2004 р. № 1419 було передбачено, що з 1 січня 2009 р. обіг ЛЗ на території України повинен здійснюватись у відповідності з вимогами GMP, GLP, GCP і GDP - практик, які гармонізовані з відповідними європейськими документами.
Наказ від 14.09.2005 № 471 “Про затвердження документів з питань стандартизації фармацевтичної продукції” ним затверджено стандарт СТ МОЗУ 42-1.0:2005 «Фармацевтична продукція. Система стандартизації. Основні положення»
Відповідно до стандарту МОЗУ “СТ МОЗУ 42-1.0:2005” Органом по стандартизації, уповноваженим затверджувати нормативні документи відносно виробництва лікарських засобів, є Міністерство охорони здоров’я України.
Прийняття в Україні міжнародних і європейських стандартів у сфері ЛЗ передбачає гуманні, економічні і політичні цілі та є необхідною умовою: забезпечення якості ЛЗ в інтересах споживачів; створення технічних бар’єрів, які гарантують поступлення на національні ринки тільки якісних препаратів; подолання технічних бар’єрів у сфері міжнародної торгівлі, вихід вітчизняних виробників на світові фармацевтичні ринки і збільшення експортного потенціалу; вступ України до ВОТ і ЄС.
Що вже зроблено на шляху до стандартизації? Розроблена і введена ДФУ та 3 Доповнення Розроблені і введені керівництва і стандарти: Фармацевтична розробка Специфікації Дослідження стабільності Виробництво ГЛЗ Валідація процесів Допоміжні речовини Біодоступність та біоеквівалентність Належна клінічна практика (GCP) Керівництво по належній виробничій практиці Керівництво по належній виробничій практиці активних фармацевтичних інгредієнтів Керівництво по належній практиці дистриб’юції Керівництво по технологічній документації ряд стандартів ДСТУ ISO по чистих приміщеннях і стерилізації.
Законодавча база України Конституція України (стаття 3) Цивільний кодекс України (стаття 283 Право на охорону здоров’я, 284 Право на мед. допомогу п.2) Закон України “Про захист прав споживачів” Закон України “Основи законодавства України про охороні здоров’я” (стаття 6, 39, 43) Закон України “Про лікарські засоби”. Наказ МОЗ України № 898 від 27.12.2006 «Про затвердження Порядку здійснення нагляду за побічними реакціями лікарських засобів, дозволених до медичного застосування»
Законодавча база України Наказ МОЗ України від 24.07.2009 р. № 531 «Про затвердження порядку здійснення моніторингу безпеки і ефективності в стаціонарах закладів охорони здоров’я” Наказ МОЗ України від 01.09.2009 р. №654 «Про затвердження Плану заходів покращення здійснення післяреєстраційного нагляду за безпекою і ефективністю лікарських засобів і моніторингу безпеки і ефективності лікарських засобів у стаціонарах закладів охорони здоров’я»
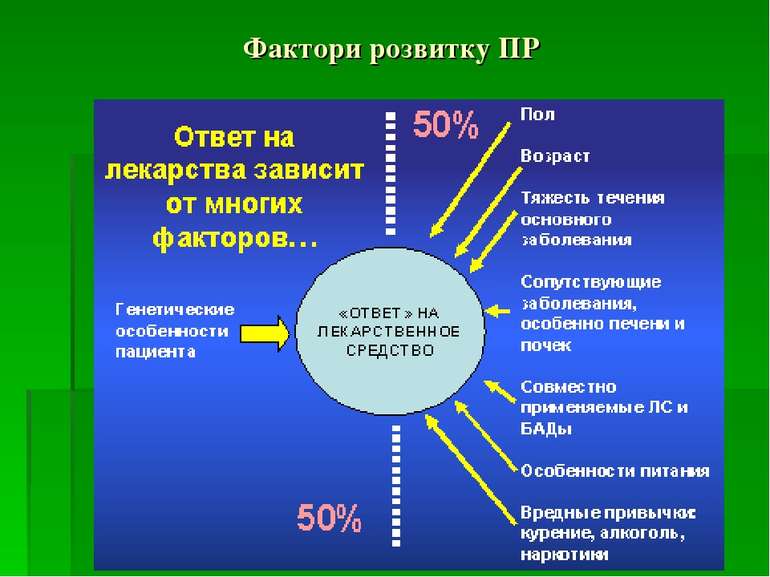
Основні поняття Безпека ЛЗ - характеристика препарату, заснована на порівняльній оцінці користі від його застосування і потенціальної шкоди, яка може бути завдана пацієнту при застосуванні цього ЛЗ. (Наказ МОЗ України №543) Фармаконагляд – державна система збору, наукової оцінки і контролю інформації про побічні реакції ЛЗ в умовах їх звичайного застосування з метою прийняття відповідних регуляторних рішень з приводу зареєстрованих в країні ЛЗ. (Наказ МОЗ України № 898)
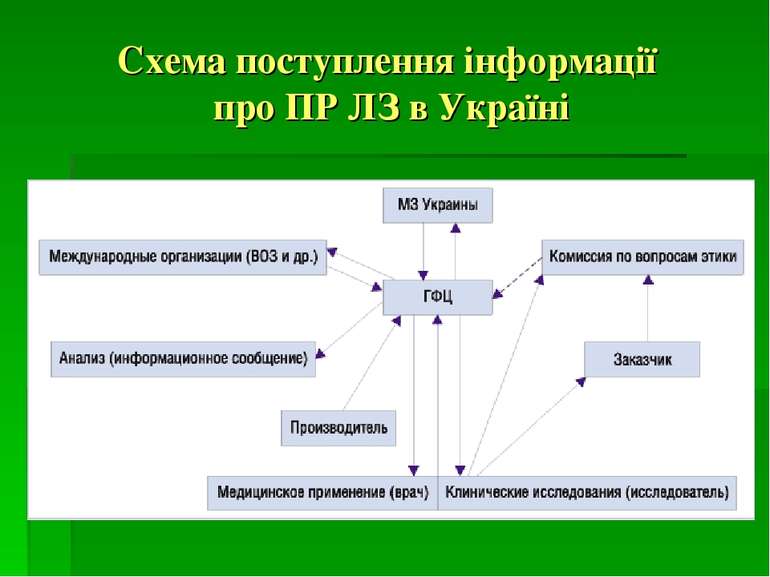
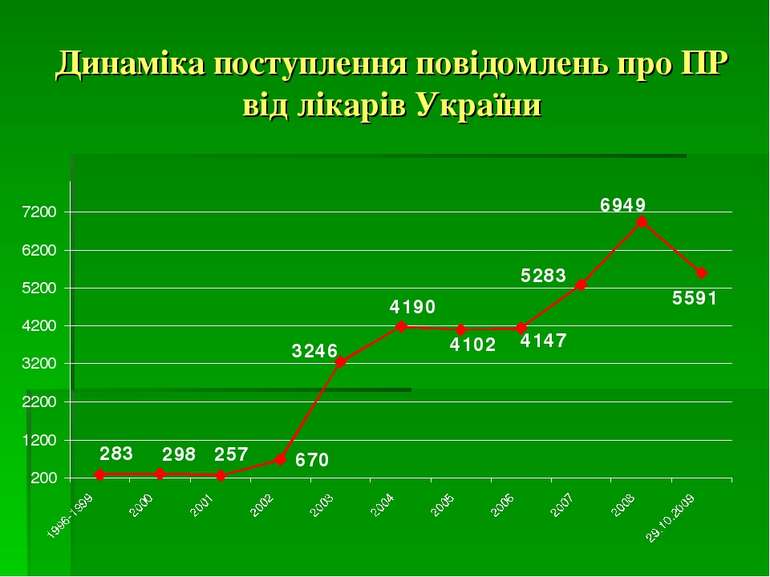
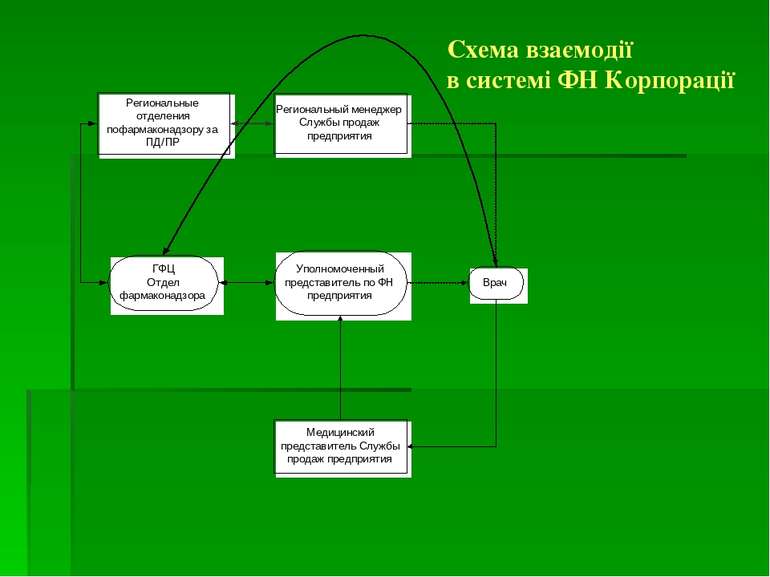
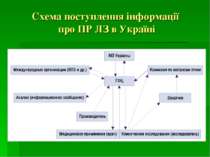
Координатором фармаконагляду в Україні є ДП «Державний фармакологічний центр» МОЗ України. Підрозділом ДП «Державний фармакологічний центр» є Управління післяреєстраційного нагляду, куди поступає, де обробляється і аналізується інформація про побічні реакції ЛЗ. В склад Управління входять регіональні відділи, співробітники яких співпрацюють з керівниками лікувально-профілактичних закладів і лікарями всіх регіонів України.
Побічна реакція – неспеціальна і шкідлива для організму реакція на ЛЗ, яка спостерігається у людини при використанні препарату у звичайних дозах з метою профілактики, діагностики і лікування захворювання або для відновлення, корекції або модифікації фізіологічної функції, а також маючи можливість причинно-наслідкового зв’язку між прийомом ЛЗ і побічним явищем Побічне явище – будь-яка небажаний клінічний випадок у пацієнта, пов’язаний в часі з прийомом ЛЗ, необов’язково маючи причинно-наслідковий зв’язок з прийомом даного ЛЗ
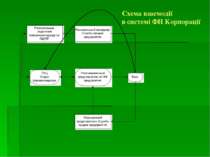
Система ФН виробника Законодавством ЄC відповідальність за забезпечення безпеки ЛЗ покладена на фарм. компанії При отриманні торгової ліцензії її власник повинен підтвердити, що він володіє відповідною системою ФН для того, щоб: - гарантувати зобов’язання і відповідність його продукції заявленим вимогам; - гарантувати, що у випадку необхідності будуть прийняті відповідні заходи
Чому необхідна система ФН виробникові? Наявність інформації про ПР ЛЗ і її об’єктивна оцінка робить виробника ЛЗ захищеним; дозволяє виробнику своєчасно реагувати у відповідь на несприятливу ситуацію, яка може статись в зв’язку з ПР ЛЗ; дозволяє захистити себе і споживача від важких наслідків ПР ЛЗ; дозволяє попередити розвиток ПР ЛЗ; дозволяє розвіяти підозри відносно небезпеки ЛЗ.
Істотною функцією служби ФН вітчизняного виробника є надання регулярно оновлюваних звітів про безпеку ЛЗ (PSUR): 1 раз на півроку протягом перших 2-х років з часу реєстрації; щорічно протягом наступних 3-х років; в майбутньому - 1 раз в 5 років (при умові перереєстрації ЛЗ).
Джерела поступлення даних про випадки ПР ЛЗ Спонтанні повідомлення (лікар, провізор, медичний представник) Постмаркетингові клінічні дослідження; Дані з Інтернету, наукових медичних видань та інших джерел літератури; Система повідомлень про ПР регуляторними органами; Інші джерела
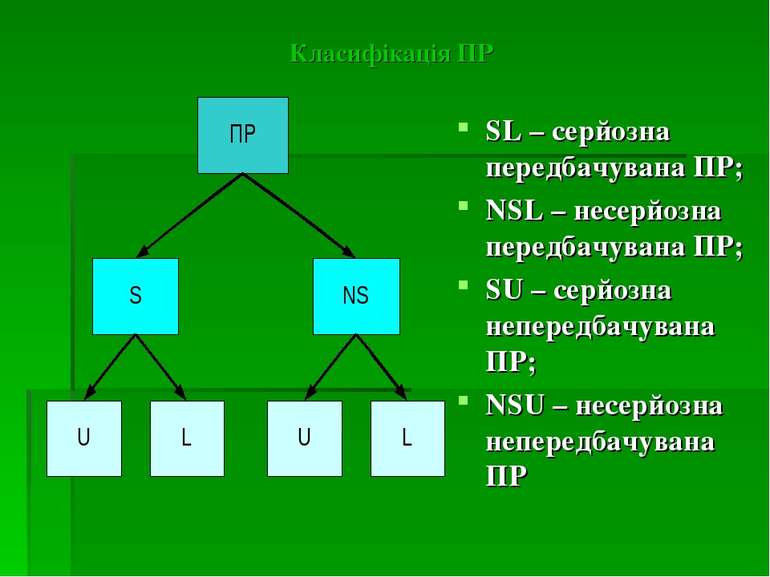
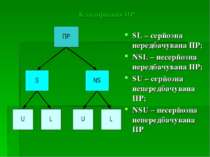
Класифікація ПР SL – серйозна передбачувана ПР; NSL – несерйозна передбачувана ПР; SU – серйозна непередбачувана ПР; NSU – несерйозна непередбачувана ПР
Серйозна ПР: - яка приводить до смерті - яка представляє загрозу для життя - викликаюча постійну або виражену непрацездатність або інвалідність - вимагаюча гостпіталізації пацієнта або подовження її термінів - проявляється вродженою аномалією/вадою розвитку Непередбачувана ПР – ПР, характер, важкість або наслідок якої не узгоджується з даними, вказаними в інструкції
Частота ПР - – співвідношення кількості пацієнтів, у яких за визначений відрізок счасу виникла ПР при застосуванні ЛЗ, до кількості пацієнтів, які за цей же відрізок часу приймали даний ЛЗ, виражене у % ЧПР=ПР/(V/Q)*100% , де Q= R·K·T ПР – кількість пацієнтів із зафіксованою ПР V – загальна кількість реалізованого ЛЗ. Q – кількість ЛЗ, яку прийняв пацієнт. R – разова доза ЛЗ. K – кратність прийому ЛЗ. T – тривалість курсу лікування
Критерії оцінки показника ЧПР, рекомендовані ВООЗ: Показник ЧПР > 10%, ПР слід розглядати як дуже часті; Показник 1% > ЧПР > 10%, ПР слід розглядати як часті; Показник 0,1% > ЧПР > 1%, ПР слід розглядати як нечасті; Показник 0,01%ЧПР > 0,1%, ПР слід розглядати як поодинокі; Показник ЧПР < 0,01%, ПР слід розглядати як рідкісні
«Нет ни одного лекарства, прием которого не был бы сопряжен с риском. Тщательная оценка рисков и преимуществ лекарственных средств способствует безопасности пациентов» (ВОЗ, www.who.int)
Схожі презентації
Категорії