Презентація на тему:
Визначення алергії
Завантажити презентацію
Визначення алергії
Завантажити презентаціюПрезентація по слайдам:
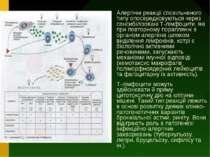
Визначення алергії Алергія (від грец. аllos – інший, ergon – дію) – якісно змінена реакція організму на дію речовин антигенної природи (алергенів), яка спричинює різні порушення в організмі – запалення, спазм бронхів, некроз, шок та ін. Алергени можуть потрапляти в організм різними шляхами: контактним (через шкіру, слизові оболонки), інгаляційним, пероральним, парентеральним. Механізми алергічної реакції принципово подібні до механізмів специфічного імунітету, і різниця між ними виявляється на кінцевому етапі їх розвитку. Імунна реакція на сторонній агент не веде до пошкодження тканин, воно притаманне лише алергічній реакції.
Типи алергійних реакцій За патогенетичними механізмами (за Джеллом і Кумбсом) виділяють такі типи алергічних реакцій: 1) анафілактичні або реагінові; 2) цитотоксичні; 3) імунокомплексні; 4) сповільнена гіперчутливість. Перші три з них належать до реакцій негайного типу, які розвиваються через декілька хвилин після контакту з алергеном. Сповільнена гіперчутливість розвиваться через 24-28 год. і опосередковується сенсибілізованими лімфоцитами.
Стадій алергійних реакцій Розрізняють три стадії алергічних реакцій: імунологічну біохімічну (патохімічну) патофізіологічну (стадія функціональних і структурних порушень).
Імунологічна стадія Імунологічна стадія охоплює всі зміни в імунній системі, що виникли з моменту поступлення алергена в організм до утворення антитіл і/або сенсибілізованих лімфоцитів і сполучення їх з потрапившим повторно або персистуючим в організмі алергеном. Відбувається сенсибілізація організму, тобто підвищення чутливості і набуття здатності бурхливо реагувати на повторне введення антигену. Перше введення антигену називається сенсибілізуючим, а повторне, яке безпосередньо спричинює прояв алергії, – завершальним.
Біохімічна (патохімічна) і патофізіологічна стадії Сутність другої, патохімічної стадії, полягає в утворенні біологічно активних медіаторів (гістамін, брадикінін, серотонін, простагландини,, фатор, що активує тромбоцити (ФАТ), “повільнореагуюча субстанція анафілаксії ((МРС-А). Патофізіологічна (ІІІ) стадія або стадія клінічних проявів, характеризується патогенною дією утворених медіаторів на клітини, органи і тканини організму. Функціональні і структурні розлади в органах можуть розвиватися внаслідок прямого ушкодження клітин лімфоцитами і гуморальними антитілами, дії біологічно активних речовин, що утворюються під впливом комплексу антиген-антитіло, а також повторно, як реакція на первинні алергічні зміни в будь-якому органі.
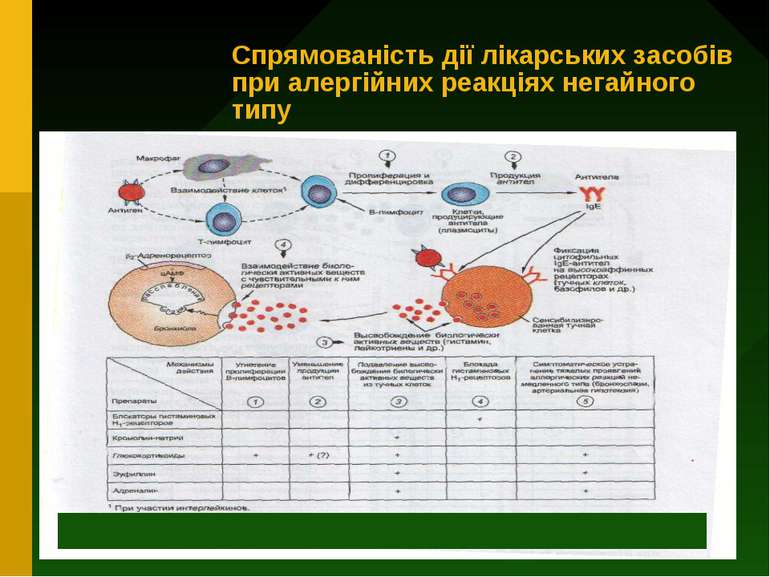
При І (реагіновому) типі алергічних реакцій у відповідь на потрапляння в організм алергена утворюються реагіни (переважно це імуноглобуліни класу Е). Вони фіксуються на лаброцитах та базофілах і тим самим створюють стан сенсибілізації. Повторне потрапляння в організм того ж алергена веде до сполучення його з утвореними реагінами, що виклкає виділення з лаброцитів і базофілів цілого ряду медіаторів (гістамін, серотонін, брадикінін, лейкотрієни та ін.). Ці медіатори діють на судини і клітини-мішені, опосередковано включаючи в реакцію еозинофіли, тромбоцити та інші клітини. В результаті підвищується проникність мікроциркуляторного русла, що супроводжується виходом рідини із судин і розвитком набряку і серозного запалення. При локалізації патологічного процесу на слизових оболонках підсилюється утворення відповідних екскретів. В органах дихання розвивається бронхоспазм. Всі ці ефекти клінічно проявляються у вигляді приступу бронхіальної астми, риніту, кон юнктивіту, кропив янки, набряку, свербіння шкіри, проносів та ін. Цей тип алергії супроводжується збільшенням кількості еозинофілів у крові, харкотинні, серозному ексудаті.
При цитотоксичному (ІІ) типі пошкодження тканин антигеном є клітина, точніше її клітинні антигенні детермінанти. Проти них утворюються антитіла (імуноглобуліни класів ІgG та Іg М), які сполучаються з детермінантами і викликають пошкодження самої клітини. Для того, щоб включився даний механізм, клітини організму повинні набути аутоалергенних властивостей. Це відбувається під дією різних хімічних речовин, найчастіше ліків, а також при різних паразитарних, бактеріальних або вірусних інфекціях. В клініці цитотоксичний тип алергічної реакції може бути одним з проявів медикаментозної алергії у вигляді тромбоцитопенії, гемолітичної анемії та ін. Цей же механізм включається при переливанні групонесумісної крові.
Загальний механізм пошкодження імунними комплексами (ІІІ тип алергічних реакцій) полягає в утворенні антитіл у відповідь на потрапляння в організм розчинного антигерна. Комплекси антигена з антитілом виявляють пошкоджуючу дію шляхом активації комплементу, звільнення лізосомальних ферментів та ін. Утворення імунних комплексів обумовлюється введенням в організм атибіотиків, атитоксичних сироваток, гама-глобулінів, деяких харчових продуктів, бактеріальних і вірусних антигенів. Комплеки невеликої молекулярної маси погано видаляються з організму клітинами РЕС, тривало циркулюють в крові і здатні осаджуватись в різних органах і тканинах з розвитком в них асептичного запалення. Третій тип алергічних реакцій є ведучим у розвитку сироваткової хвороби, екзогенних алергічних альвеолітів, аутоалергічних захворювань. При значній активації комплементу може розвинутись анафілактичний шок. Механізми, що обумовлюють утворення медіаторів, можуть спричиняти бронхоконстрикцію та розвиток бронхіальної астми.
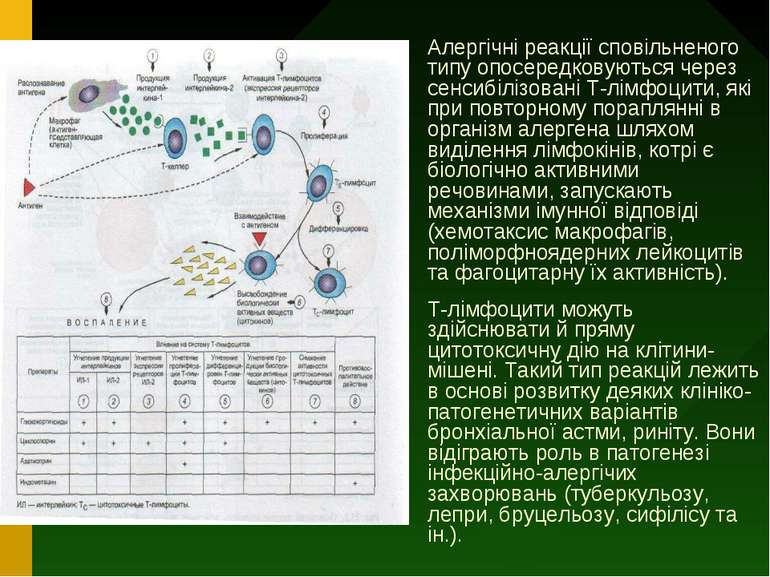
Алергічні реакції сповільненого типу опосередковуються через сенсибілізовані Т-лімфоцити, які при повторному пораплянні в організм алергена шляхом виділення лімфокінів, котрі є біологічно активними речовинами, запускають механізми імунної відповіді (хемотаксис макрофагів, поліморфноядерних лейкоцитів та фагоцитарну їх активність). Т-лімфоцити можуть здійснювати й пряму цитотоксичну дію на клітини-мішені. Такий тип реакцій лежить в основі розвитку деяких клініко-патогенетичних варіантів бронхіальної астми, риніту. Вони відіграють роль в патогенезі інфекційно-алергічих захворювань (туберкульозу, лепри, бруцельозу, сифілісу та ін.).
Загальною ознакою гіперчутливості негайного типу є приступоподібність симптомів. Цим алергічним реакціям властивий зворотній розвиток і повільний темп розвитку ускладнень. У випадку загальних реакцій (анафілактичний шок) або набряку гортані може настати смерть. При алергічних реакціях сповільненого типу запальний процес протікає важче, може закінчитись рубцюванням, тобто органічними змінами в органах і тканинах.
Скарги хворих на алергійні захворювання Хворих на алергію найчастіше турбують зміни з боку шкіри, органів дихання, очей, травного тракту. Крім того, ряд захворювань (сироваткова хвороба, поліноз, харчова алергія) супроводжуються підвищенням температури тіла, порушенням загального стану (загальною слабкістю, головним болем, подразливістю, порушенням сну). При сироватковій хворобі, медикаментозній алергії внаслідок ураження серця хворі можуть відчувати слабкість, задишку, серцебиття, біль в ділянці серця.
Анафілактичний шок Анафілактичний шок (від грец. anaphylaxis – зворотній захист) – це синдром, що виникає гостро і проявляється загальними тяжкими реакціями негайного типу, що в основному характеризуються початковим збудженням з наступним гальмуванням функції ЦНС, бронхоспазмом, артеріальною гіпотонією. Причниною розвитку анафілактичного шоку може бути введення в організм лікарських і профілактичних препаратів, сироваток і вакцин, гормонів, переливання крові і кровозамінників, неправильне проведення гіпосенсибілізації, вжалення комахами та ін. Майже будь-який лікарський чи профілактичний засіб у сенсибілізованих осіб може викликати шокову реакцію, проте найчастіше вона розвивається при застосуванні антибіотиків, особливо пеніцилінового ряду. Частіше анафілаксія спостерігається при парентеральному введенні препарата, особливо внутрішньовенно; реакція розвивається на протязі години (іноді негайно, “на кінчику голки”).
Патогенез. Анафілактичний шок є реакцією негайного типу і найчастіше розвивається як І тип гіперчутливості. В результаті активації біологічно активних речовин і вивільнення значної кількості медіаторів підвищується проникність судинної стінки з розвитком набряків та гіперсекреції, виникає спазм гладких м язів, порушення вегетативної регуляції серцево-судинної системи. В результаті розвивається цілий комплекс патологічних змін у внутрішніх органах.
Клініка. Анафілактичний шок виникає дуже швидко – через декілька секунд або хвилин з моменту надходження в організм алергена. Існує закономірність: чим менше часу пройшло з цього моменту до перших проявів шоку, тим важча клінічна його картина. Першими симптомами, на які вказує хворий, може бути відчуття жару з різким почервонінням шкіри обличчя, запаморочення, біль голови пульсуючого характеру, відчуття страху, неспокою, стиснення в грудях, холодний піт, шум у вухах. В деяких випадках одночасно з являється свербіння шкіри, кропив янка, алергічні набряки, серцебиття. Спазм гладких м язів дихальних шляхів проявляється приступами кашлю, експіраторною задишкою, шлунково-кишкового тракту – спастичними болями по всьому животу, нудотою, блювотою, проносами. При вираженому набряковому синдромі з локалізацією патологічного процесу на слизовій оболонці гортані може розвинутися асфіксія.
Кропив янка (алергічний дерматоз, urticaria). Кропив янка – швидка поява більш чи менш розповсюджених сверблячих пухирів на шкірі, що являють собою набряк обмеженої ділянки головним чином сосочкового шару шкіри. У здорових осіб такий вид висипань може виникати при опіку кропивою. Одним з видів кропив янки є набряк Квінке (гігантська кропив янка, ангіоневротичний набряк). В якості алергена частіше всього виступають лікарські препарати, харчові продукти, укуси різних комах, фізичні фактори. У патогенезі синдрому основне місце займають судинні реакції, збільшення проникності судинної стінки.
Набряк Квінке (ангіоневротичний набряк, гігантська кропив янка) – це приступи перехідного обмеженого набряку шкіри, що розповсюджується на всі її шари, деколи і на підшкірну основу, слизові оболонки. Описаний Quincke H. I. у 1882 р. Набряк Квінке може бути алергічним і псевдоалергічним Він розвивається внаслідок накопичення в шкірі значних концентрацій медіаторів запалення і збільшення під їх впливом проникності судинної стінки.
Сінна лихоманка (алергічний риніт, поліноз, від лат. pollеn - пилок). Це алергічне захворювання, що викликається пилком рослин і характеризується гострими запальними змінами слизових оболонок, головним чином дихальних шляхів та очей. Захворювання має чітко повторювану сезонність, що співпадає з періодом цвітіння деяких рослин, наприклад, весною – вільхи, горішника, клена, ясена, берези, влітку – лукових злакових трав (тимофіївки, пирію, жостеру та ін.), пізнього літа і восени – полину, лободи. Крім того, симптоми полінозу можуть виникнути при вживанні в їжу продуктів, спільних за антигенними властивостями з цими рослинами. Розвитку сінної лихоманки сприяє спадкова схильність до гіперпродукції імуноглобуліну Е.
Синдром Лайєлла (токсичний епідермальний некроліз, necrolysis epidermalis toxica) – описаний англійським лікарем Лайєллом (Lyell) у 1956 р. Синдром являє собою ураження шкіри токсико-алергічної природи, що характеризуєтья некрозом поверхневих шарів епідермісу. Найчастішою причиною виникнення синдрому Лайєлла є розвиток гіперчутливості сповільненого типу у відповідь на вживання ряду медикаментозних засобів (антибіотики, сульфаніламіди, бабітурати, сироватки та ін.). Рідше, переважно в дітей, етіологічним чинником є стафілококовий екзотоксин.
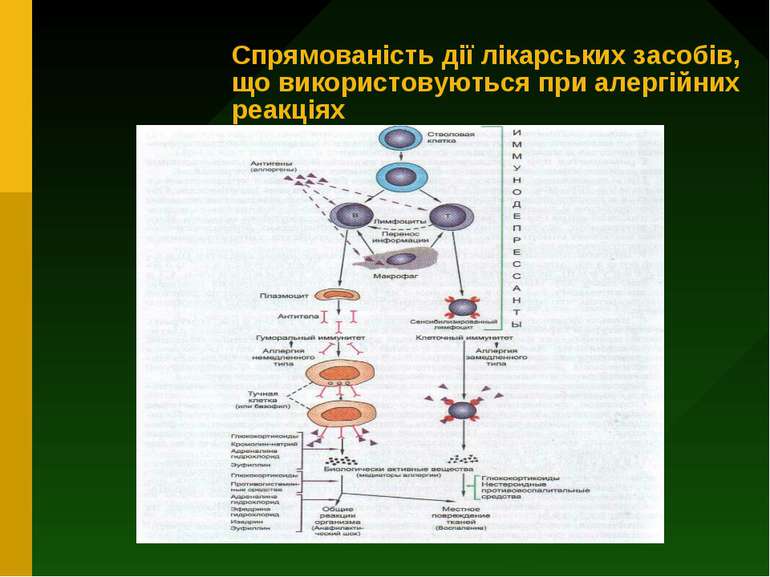
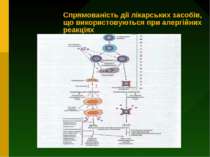
Загальні принципи попередження та лікування алергічних реакцій 1) Уникнення контакту з алергеном 2) Проведення специфічної десенсибілізації шляхом повторного введення хворому невеликих доз специфічного алергену 3) Проведення неспецифічної десенсибілізації шляхом призначення препаратів, які пригнічують імунні реакції (імунодепресантів) 4) Застосування протиалергічних засобів, які здатні попередити вивільнення медіаторів алергії шляхом стабілізації мембран опасистих клітин (лаброцитів) або ж заблокувати рецептори, з якими ці медіатори взаємодіють у тканинах 5) Симптоматичне лікування проявів алергічних реакцій, які вже розвинулись
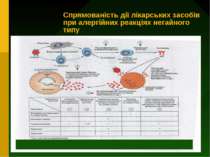
Напрямки терапії реакцій гіперчутливості негайного типу 1) Протиалергічні препарати : а) засоби, які стабілізують мембрани опасистих клітин (лаброцитів) та базофілів і гальмують вивільнення із них медаторів реакції гіперчутливості (кромолін-натрію, кетотіфен) б)протигістамінні засоби - блокують рецептори , з якими з`єднується у тканинах гістамін ( димедрол, супрастин та ін.) 2) Засоби, які зменшують пошкодження тканин (глюкокортикостероїди) 3) Засоби симптоматичного лікування (адреналін, еуфілін)
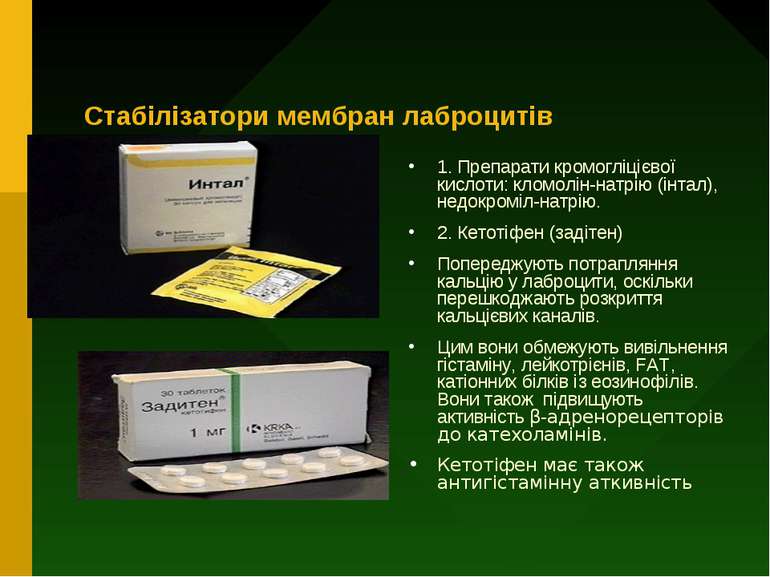
Стабілізатори мембран лаброцитів 1. Препарати кромогліцієвої кислоти: кломолін-натрію (інтал), недокроміл-натрію. 2. Кетотіфен (задітен) Попереджують потрапляння кальцію у лаброцити, оскільки перешкоджають розкриття кальцієвих каналів. Цим вони обмежують вивільнення гістаміну, лейкотрієнів, FAT, катіонних білків із еозинофілів. Вони також підвищують активність β-адренорецепторів до катехоламінів. Кетотіфен має також антигістамінну аткивність
Застосування Препарати кромогліцієвої кислоти застосовують інгаляційно при синдромі бронхіальної обструкції для довготривалого лікування (але не для зняття нападів) атопічної бронхіальної астми (перевагу має недокроміл-натрію). Кетотіфен призначають всередину для лікування атопічної бронхіальної астми, сінної лихоманки ринітів і інших алергійних реакцій митєвої дії. Препарати можна поєднувати зі всіма іншими засобами, що використовуються для профілактики синдрому бронхіальної обструкції.
Блокатори Н1 гістамінорецепторів Блокатори Н1 гістамінорецепторів за хімічною будовою поділяють на похідні: 1) етилендіаміну (супрастин) 2) етаноламіну (димедрол, клемастин) 3) піперазину (цетиризин) 4) алкіламінів (фенірамін) 5) фенотіазину (дипразин, терален) 6) різної будови (діазолін, перитол, фенкарол)
Антигістамінні засоби різних поколінь Перше покоління: дифенілгідрамін (димедрол, бенадрил), прометазин (дипразин, піпольфен), хлорпірамін (супрастин), мебгідролін (діазолін), клемастин (тавегіл), фенкарол. Друге покоління: лоратидин (кларитин), терфенадин (телдан, бронал), астемізол (гісманал), акривастин (семпрекс), цетиризин (зіртек), левокабастин (ливостин), азеластин (алергодил, ринопласт), ебастин (кестин). Третє покоління: тексофенадин (телфаст)
Порівняльна протиалергічна активність Н1 гістаміноблокатори 1-го покоління Дипразин>тавегіл>димедрол>супрастин> фенкарол>діазолін Н1 гістаміноблокатори 2-го і 3-го покоління Цетиризин>ебастин>терфенадин= фексофенадин>астемізол>лоратадин
Показання до застосування протигістамінних препаратів 1. Кропив’янка 2. Сінна лихоманка 3. Вазомоторні риніти 4. контактні дерматити 5. Ангіоневротичний набряк 6. Сироваткова хвороба 7. Анафілактичний шок 8. Інші
Побічна дія блокаторів Н1-гістамінових рецепторів 1-го покоління 1)Пригнічують вплив на ЦНС (порушення координації рухів, підвищена втомлюваність, запаморочення, затьмарення зору,диплопія,тремор, ейфорія, нервозність,безсоння) 2) Порушення функції ШКТ :зниження апетиту, нудота, блювання, біль в епігастрії, закреп або діарея 3) Внаслідок М-холіноблокуючої активності-сухість слизових оболонок, розлади зору, імпотенція, затримка сечовипускання, тахікардія, головний біль, психози при тривалому застосуванні-тахіфілаксія
Властивості блокаторів Н1-гістамінових рецепторів 2-го і 3-го поколінь 1) блокують Н1-гістамінні рецептори 2) Стабілізують опасисті клітини 3) Мають протизапальну активність 4) Знижують виділення гістаміну
Переваги блокаторів Н1-гістамінових рецепторів 2-го і 3-го поколінь над класичними Н1-антагоністами 1) Високі специфічність і спорідненість до Н1-рецепторів 2) Короткий латентний період 3) Тривала дія (до 24 годин) 4) Відсутність блокади інших типів рецепторів 5) Непроникнення через ГЕБ у терапевтичних дозах 6) Відсутність тахіфілаксії
Взаємодія антигістамінних препаратів Димедрол і дипразинпідсилюють дію місцевих анестетиків, жарознижувальнихї засобів і холіноблокаторів. Вони ж, а також супрастин і тавегіл потенціюють ефекти снодійних засобів, нейролептиків, засобів для наркозу і всіх засобів, які пригнічують ЦНС. Терфенадин і астемізол не можна призначати разом з еритроміцином і гепатотоксичними препаратами (ушкодження печінки), а аткожз кетоконазолом, флуконазолом, інтраконазолом (виникають кардіоміопатії). Димедрол, піпольфен – індуктори мікросомальних ферментів гепатоцитів.
Ці засоби подавляють переважно клітинний імунітет, тому використовуються тільки при алергічних реакціях сповільненої дії. До імуносупресивних засобів належать: глюкокортикостероїди, циклоспорин, такролімус, а також протипухлинні засоби цитотоксичної дії (циклофосфан, азатіоприн, метотрексат, меркаптопурин).
Циклоспорин А Механізм дії циклоспорину А полягає в спотворенні клітинної опосередкованої імунної реакції. Зі всіх популяцій імунокомпетентних клітин циклоспорин селективно впливає на Т-лімфоцити. Зв'язуючись із специфічними внутріклітинними рецепторами (циклофілінами), циклоспорин селективно інгібує експресію генів, що беруть участь в ранніх етапах активації Т-лімфоцитів. До ефектів циклоспорину відносять придушення транскрипції тРНК Т-клітинних цитокінів (інтерлейкіну-2, інтерлейкіну-3, інтерлейкіну-4, інтерферону, експресії мембран ІЛ-2 рецепторів на Т-лімфоцитах, хемотаксису мононуклеарних фагоцитів, синтезу чинника некрозу пухліни і у меншій мірі ІЛ-1 і експресії антигенів класу II головного комплексу гістосумісності на мембранах антиген-презентуючих клітин. Особливо ефективний циклоспорин А, коли антигеном є клітини алотрансплантанта. Застосовують препарат при пересадці нирки, печінки, підшлункової залози, серця. Завдяки циклоспорину ступінь приживлення серцевих і печінкових трансплантантів протягом року досягає 80 і 70 % відповідно. Побічні ефекти: нефротоксичність, гепатоксичність. Токсичні реакції спостерігаються при концентраціях циклоспорину більше 1000 нг/мл (а за деякими даними вже при 800 нг/мл).
Такролімус Відноситься до антибіотиків-макролідів. Пригнічує активацію Т-лімфоцитів і зменшує продукцію інтерлейкіну-2 . Активніший циклоспорину у 100 разів. Застосовують при трансплантації органів. Вводять ентерально та внутрішньовенно. Має нефротоксичну, нейротоксичну дію, викликає гіпертензію, гіперглікемію.
Наявні в даний час імунодепресивні засоби мають певну специфічність дії або на лімфоїдну тканину в цілому, або на окремі імунокомпетентні клони клітин. Однією з фундаментальних властивостей імунодепресивних засобів є їх антипроліферативна активність, тобто всі імунодепресанти є цитостатиками. У зв'язку з високою динамічністю імунної системи і наявністю сильних регуляторних механізмів ефекти імунодепресантів в значній мірі залежать від стану самої системи у момент введення препаратів, а також від схеми їхнього застосування. Тому поділ імунотропних засобів на імуностимулятори і імунодепресанти умовний: всі класичні імунодепресанти можуть викликати не тільки пригнічення імунної системи, але і імуностимулюючий ефект.
Імуностимулюючі засоби Імуностимулюючі засоби можна розділити на такі групи: Продукти мікроорганізмів і грибків (бронховаксом, бронхомунал, нуклеїнат натрію, продигіозан, пірогенал, імудон, ІРС-19 хрестин, лентинан, биостим, рибомунил); Головною мішенню їхньої дії є клітини моноцитарно-макрофагальної системи. Імуностимулятори тваринного походження: а)екстракти пептидів тимусу (тимостимулін, тактивін, тимоптин, тимактид, тимомодулін); б) препарати кістково-мозкового генезу (мієлопід=В-активін і ін.). Вони використовуються при захворюваннях з ураженням В-системи імунітету. Рекомбінантні імуностимулятори (філграстим=нейпоген, молграмостин=лейкомас, реаферон, ранколейкін, беталейкін і ін. Регулюють клітинний і гуморальний імунітет. Імуноглобуліни. Синтетичні імуностимулятори (левамізол, диуцифон, тимоген інозин пранобекс, імпрег, броміпірин і ін.), а аткож метил урацил та дібазол.
Невідкладна допомога при анафілактичному шоку Засобом вибору у такій ситуації є адреналіну гідрохлорид, який коригує зниження артеріального тиску і знімає бронхоспазм. Препарат у вигляді 0,1 % розчину вводять внутрішньом’язово по 0,3-0,5 мл кожні 5-10 хвилин до покращання стану хворого. В разі необхідності адреналіну гідрохлорид вводять повільно внутрішньовенно, попередньо розчинивши 0,5 мл 0,1 % розчину в 10 разів, при зупинці серця – внутрішньосерцево. В останніх двох випадках можливий розвиток шлуночкової фібриляції, що в даній небезпечній ситуації є менш грізним ускладненням, ніж сам анафілактичний шок. Високо ефективне негайне крапельне введення (40-50 крапель за хвиліну) такої суміші: 5 мл 0,1 % розчину адреналіну гідрохлориду, 500 мг гідрокортизону (або 60 мг преднізолону, або 12 мг дексаметазону) в 500 мл 0,9 % розчину натрію хлориду.
Глюкокортикостероїди використовуються як протиалергічні та протишокові засоби. Але їх дія розвивається через 30-60 хв після введення. Добова доза ГКС у перерахунку на преднізолон може становити 200-1200 мг. Такі ін’єкції продовжують 1-3 дні. Для усунення бронхоспазму, крім адреналіну гідрохлориду, застосовують еуфілін (внутрішньовенно 10-20 мл 2,4 % розчину). На початку лікування можна використати аерозольні форми бронхолітиків: орципреналіну сульфату (алупенту), саль бутамолу та ін. Проводиться інтенсивна оксигенотерапія. Для стимуляції дихального центру можна використовувати кордіамін (2-4 мл), кофеїн-бензоат натрію (1-2 мл 10 % розчину). При наявності гострого набряку легень як прояву гострої серцевої недостатності до складу коктейлю для внутрішньовенного крапельного введення додають 1 мл 1 % розчину фуросеміду. Протигістамінні засоби використовують лише в дошоковому періоді. За відсутності гострої серцевої недостатності проводять швидке внутрішньовенне введення сольових розчинів, плазми та ін. для корекції гемодинамічних розладів. Нормалізація кислотно-лужної рівноваги здійснюється внутрішньовенним введенням натрію гідрокарбонату. Судоми усуваються введенням сибазону (внутрішньовенно або внутрішньом’язово 2-4 мл 0,5 % розчину) та ін.
Фармацевтична опіка при призначенні протиалергійних засобів Фармацевтична опіка при застосуванні препаратів для лікування симптомів алергії При першому вияві алергічної реакції потрібно обов'язково звернутися до лікаря і спробувати встановити причину виникнення алергії. При встановленому зв'язку алергічної реакції з тим або іншим алергеном вжити всі можливі заходи для припинення подальшого контакту з ним. У випадку, коли лікарська терапія, прописана лікарем, перестала надавати належний ефект, повторно звернутися до лікаря для корекції лікарської терапії. Препарати, містять антигистаминные компоненти першого покоління, можуть викликати сонливість, відчуття утомленості, тому їх потрібно приймати увечері (особливо пероральні лікарські форми). Препарати, містять антигистаминные компоненти, не потрібно вживати під час управління транспортними засобами, оскільки вони викликають порушення уваги і координації рухів. Препарати, містять антигистаминные компоненти як першого, так і другого поколінь, не потрібно поєднувати з алкоголем, седативними, снодійними, транквілізаторами, нейролептиками, наркотичними анальгетиками - можливе посилення пригнічуючої дії препаратів на ЦНС.
Седативна дія антигістамінних препаратів першого покоління, що варіює від легкої сонливості до глибокого сну, часто може виявлятися навіть при використанні їх в звичайних терапевтичних дозах. Препарат дипразин (піпольфен) може викликати коливання артеріального тиску. Антигістамінні препарати першого покоління, особливо ципрогептадил (перитол), можуть викликати підвищення апетиту. При тривалому використанні антигістамінних препаратів першого покоління спостерігається значне зниження їхньої терапевтичної ефективності (тахіфілаксія). При алергічних ринітах (сезонних і цілорічних) і при полінозах застосування антигістамінних препаратів першого покоління небажане, оскільки вони, маючи М-холінолітичну дію, можуть викликати сухість слизових, збільшувати в'язкість секрету і сприяти розвитку гаймориту і синуситів, а при бронхіальній астмі - викликати або усилювати бронхоспазм. Стабілізатори мембран лаброцитів застосовуються тільки з профілактичною ціллю. Ефект препаратів з групи стабілізаторів мембран лаброцитів повністю розвивається після закінчення курсу лікування - 10-12 тижнів постійного прийому.
Схожі презентації
Категорії