Презентація на тему:
Інформаційні технології в дослідженнях з квантової фармакології
Завантажити презентацію
Інформаційні технології в дослідженнях з квантової фармакології
Завантажити презентаціюПрезентація по слайдам:
Інформаційні технології в дослідженнях з квантової фармакології Т.Ю. Небесна – асп. каф. фармакології з курсом клінічної фармакології Науковий керівник: І.С. Чекман, член-кор. НАН і АМН України, засл. діяч науки і техніки України, д.м.н., проф., завідувач кафедри фармакології з курсом клінічної фармакології Національного медичного університету імені О.О. Богомольця Національний медичний університет імені О.О. Богомольця
Квантова фармакологія: розділ науки, в якому знання електронної структури препаратів використовується для de novo дизайну лікарських засобів, вивчення зв’язку між структурою та біологічною активністю речовин та встановлення фармакофорів і пояснення механізму дії медикаментів – W.G. Richards, 1977. (Oxford University, England).
Перші наукові роботи в галузі квантової фармакології Нітро-гетероциклічні лікарські засоби, що активуються в стані гіпоксії, для радіо- та хіміотерапії раку. Adams G. E.; Stratford I. J. Biochemical Pharmacology (1986) Розрахунок відносної зміни вільної енергії зв’язування при утворенні комплексу білок-інгібітор. Bash P.A., Singh U.C., Brown F.K., Langridge R., Kollman P.A. Science (1987) Електростатичний потенціал та зв’язування ліків з ДНК. Burridge J.M.; Quarendon P.; Reynolds C. A.; Goodford P.J. Journal of Molecular Graphics (1987) Розробка специфічних інгібіторів дигідрофолатредуктази. Reynolds C.A., Richards W.G., Goodford P.J. Anticancer Drug Des. (1987) Фізико-хімічні механізми дії агапурину (пентоксифіліну). Chekman I.S., Bobkov V.M., Svintitsky A.S., Bondur V.V., Zagorodny M.I. Fundamental & Clinical Pharmacology (1999) Молекулярні механізми дії капотену та моноприлу. Chekman I.S., Bobkov V.M., Svintitsky A.S., Bondur V.V., Zagorodny M.I. Fundamental & Clinical Pharmacology (1999)
Квантова фармакологія На кафедрі фармакології з курсом клінічної фармакології НМУ ім. О.О.Богомольця дослідження з квантової фармакології ведуться з 1998 р. Вивчені квантово-фармакологічні властивості лікарськіихзасобів: Антигіпертензивні (каптоприл, лізиноприл, фозиноприл, метопролол, атенолол, пропранолол, карведілол, празозин, доксазозин); Засоби для лікування гіперплазії простати (тамсулозин, теразозин, альфузозин) Адреноміметики (адреналін, мезатон) Протизапальні (анальгін, ацетилсаліцилова кислота); Експекторанти – відхаркувальні (ацетилцистеїн) Гіполіпідемічні (уфібрат) Метаболітні препарати (кверцетин, таурин, тіотриазолін, яктон).
Квантова фармакологія Результати досліджень квантово-фармакологічних лікарських засобів, проведених на кафедрі фармакології з курсом клінічної фармакології НМУ імені О.О. Богомольця надруковані в таких журналах: “Доповіді НАН України” “Лікарська справа” “Вісник Національного медичного університету імені О.О. Богомольця” “Fundamental & Clinical Pharmacology” Зроблені доповіді на таких наукових форумах: Конгреси фармакологів України: Дніпропетровськ (2002), Одеса (2006) Конгреси кардіологів України: Київ (2003, 2007) Конгрес “Человек и лекарство” – Москва, (2000, 2005, 2007) 2nd European congress of pharmacology – Budapest, Hungary (1999) VI International congress of medical sciences for students and young doctors – Sofia, Bulgaria (2007)
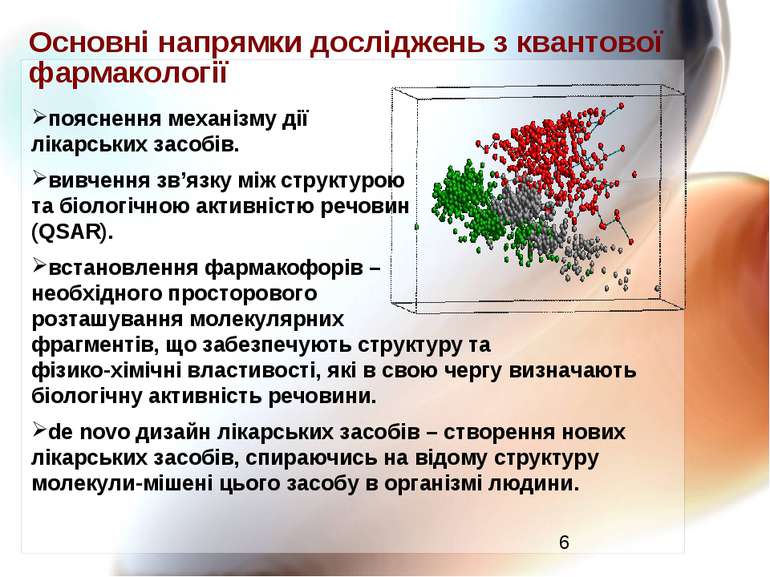
Основні напрямки досліджень з квантової фармакології пояснення механізму дії лікарських засобів. вивчення зв’язку між структурою та біологічною активністю речовин (QSAR). встановлення фармакофорів – необхідного просторового розташування молекулярних фрагментів, що забезпечують структуру та фізико-хімічні властивості, які в свою чергу визначають біологічну активність речовини. de novo дизайн лікарських засобів – створення нових лікарських засобів, спираючись на відому структуру молекули-мішені цього засобу в організмі людини.
- наука, яка використовує методи комп’ютерного моделювання та принципи теоретичної хімії для встановлення молекулярної структури ліків та механізмів їх взаємодії з рецепторами та іншими біомолекулами організму Сучасне визначення квантової фармакології Завдання квантової фармакології: Дослідження структури окремих лікарських засобів Дослідження залежності “структура – активність” (QSAR) Дослідження білок-лігандних взаємодій Дослідження реакцій, в які вступають лікарські засоби в організмі людини
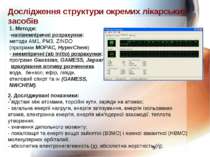
Дослідження структури окремих лікарських засобів 2. Досліджувані показники: - відстані між атомами, торсійні кути, заряди на атомах; - загальна енергії напруги, енергія зв’язування, енергія ізольованих атомів, електронна енергія, енергія між’ядерної взаємодії, теплота утворення; - значення дипольного моменту; - локалізація та енергії вищої зайнятої (ВЗМО) і нижчої вакантної (НВМО) молекулярних орбіталей; - абсолютна електронегативність (χ), абсолютна жорсткість (ή); 1. Методи: напівемпіричні розрахунки: методи АМ1, РМ3, ZINDO (програми MOPAC, HyperChem) неемпіричні (ab initio) розрахунки: програми Gaussian, GAMESS, Jaguar врахування впливу розчинника вода, бензол, ефір, ліпіди, етиловий спирт та ін (GAMESS, NWCHEM). .
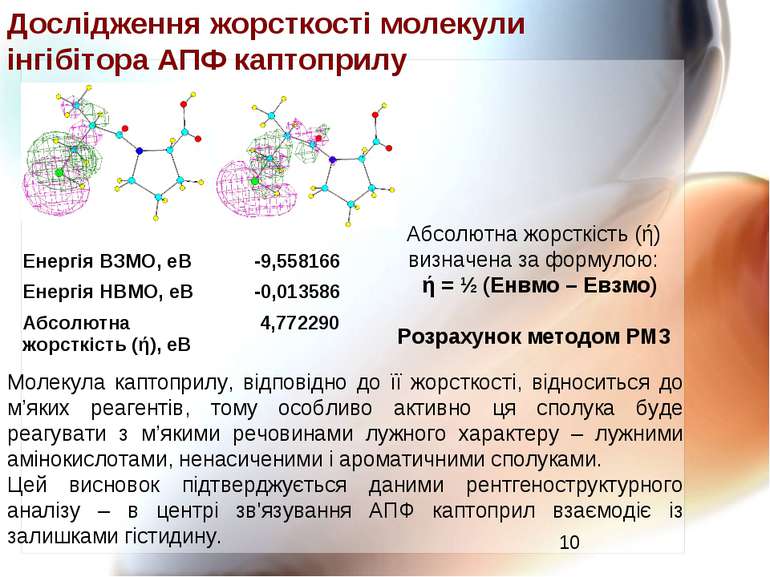
Дослідження жорсткості молекули інгібітора АПФ каптоприлу Молекула каптоприлу, відповідно до її жорсткості, відноситься до м’яких реагентів, тому особливо активно ця сполука буде реагувати з м’якими речовинами лужного характеру – лужними амінокислотами, ненасиченими і ароматичними сполуками. Цей висновок підтверджується даними рентгеноструктурного аналізу – в центрі зв'язування АПФ каптоприл взаємодіє із залишками гістидину. Абсолютна жорсткість (ή) визначена за формулою: ή = ½ (Енвмо – Евзмо) Розрахунок методом РМ3
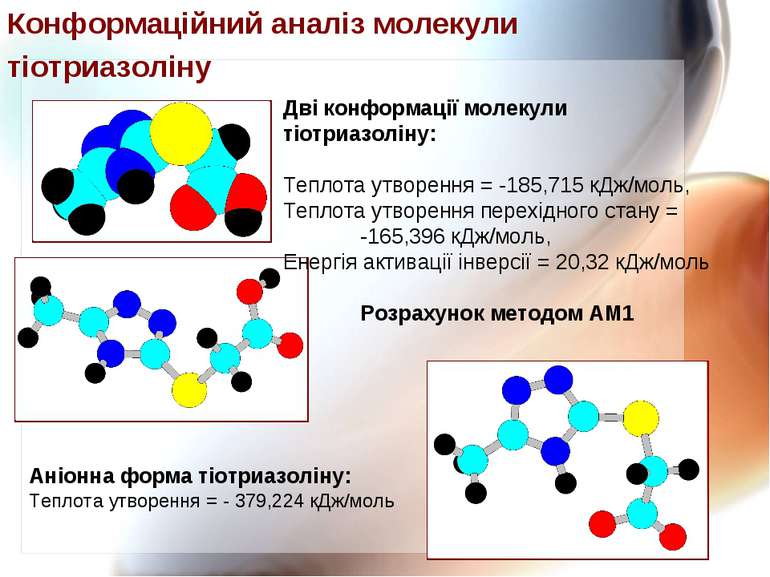
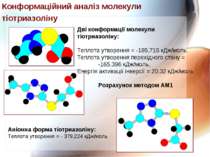
Дві конформації молекули тіотриазоліну: Теплота утворення = -185,715 кДж/моль, Теплота утворення перехідного стану = -165,396 кДж/моль, Енергія активації інверсії = 20,32 кДж/моль Розрахунок методом АМ1 Аніонна форма тіотриазоліну: Теплота утворення = - 379,224 кДж/моль Конформаційний аналіз молекули тіотриазоліну
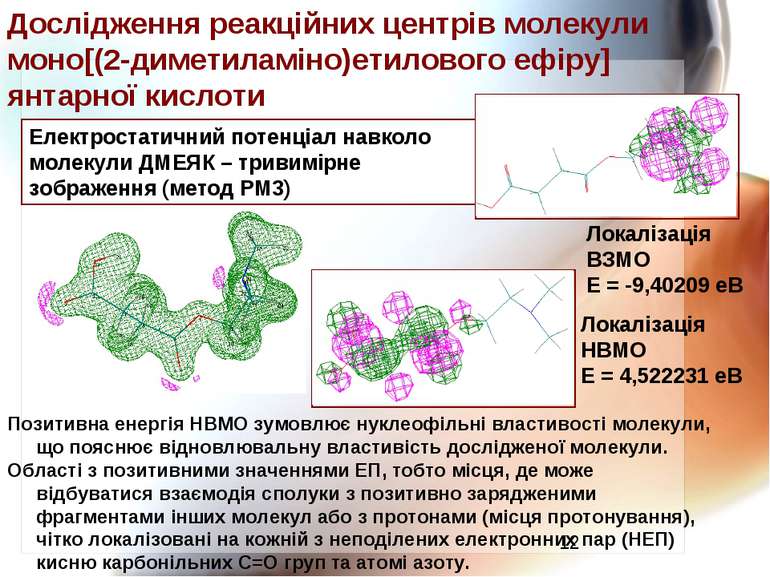
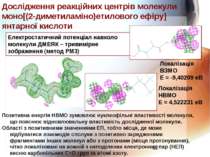
Електростатичний потенціал навколо молекули ДМЕЯК – тривимірне зображення (метод РМ3) Локалізація ВЗМО Е = -9,40209 еВ Локалізація НВМО Е = 4,522231 еВ Дослідження реакційних центрів молекули моно[(2-диметиламіно)етилового ефіру] янтарної кислоти Позитивна енергія НВМО зумовлює нуклеофільні властивості молекули, що пояснює відновлювальну властивість дослідженої молекули. Області з позитивними значеннями ЕП, тобто місця, де може відбуватися взаємодія сполуки з позитивно зарядженими фрагментами інших молекул або з протонами (місця протонування), чітко локалізовані на кожній з неподілених електронних пар (НЕП) кисню карбонільних С=О груп та атомі азоту.
Вплив сольватації на властивості біомолекул СОЛЬВАТАЦІЯ - взаємодія молекул розчиненої речовини (або їх асоціатів) з молекулами розчинника, яка приводить до зміни властивостей молекул у розчині (у порівнянні з властивостями газової фази), впливає на всі фізичні і фізико-хімічні процеси, що протікають у розчинах, у т.ч. визначає швидкість реакцій у розчинах і положення рівноваги, а в ряді випадків і їхній механізм.
Використання сольватаційної моделі для розрахунку квантово-фармакологічних параметрів серцевого глікозиду – дигоксину: методи Сольватаційна модель SM5.42R/HF/6-31G(d)//PM3 (GAMESOL) Gs(R) = GEP + GCDS GEP = EE + GP GEP – електростатична компонента Gs, EE – енергія деформації молекули Ak – доступна поверхня атома k k – атомарний поверхневий натяг атома k як функція просторової геометрії розчину та набору параметрів розчинника. Оптимізація геометрії у розчині дає рівноважну геометрію розчинених молекул R(l): Gs = G(l,R(l)) - G(g,R(g))=Е(l,R(l)) + G(R(l)) + G(R(l)) - Е(g,R(g)), де індекси l та g відповідають рідкій та газовій фазі, а R- рівноважна геометрія системи.
Використання сольватаційної моделі для розрахунку квантово-фармакологічних параметрів серцевого глікозиду – дигоксину: висновки Вільна енергія гідратації дигоксина становить -40,4 ккал/моль Значення цього параметра вказує на гарну розчинність дигоксина у воді. При вивченні взаємодії дигоксину з будь-якими молекулами або активними центрами у водному середовищі необхідно враховувати ефекти сольватації, оскільки енергія взаємодії дигоксина з молекулами води може перевищувати енергію взаємодій з іншими, розчиненими сполуками, тобто утворення відповідних комплексів, особливо одноцентрових, може бути енергетично невигідним. Виходячи зі структури дигоксина й розрахованих параметрів, можна вважати, що тільки багатоцентрові його комплекси з відповідними біоструктурами можуть бути ефективні у водному середовищі.
Quantitative Structure-Activity Relationship З’ясування залежності між хімічною будовою речовини, їх фізико-хімічними властивостями та біологічною активністю QSAR (Quantitative Structure-Activity Relationship) – один із шляхів до пояснення механізмів дії біологічно активних речовин, підвищення ефективності та зниження вартості розробки оригінальних лікарських засобів. QSAR вимагає максимально детальної інформації про тривимірну структуру як біологічно активних речовин, так і молекул-мішеней людського організму.
Молекулярні дескриптори - набір незалежних параметрів, які характеризують електронні, структурні, геометричні та інші особливості молекул Елементарні дескриптори – брутто-формула молекули або її атомний склад. Електронні дескриптори – набір індексів, що характеризують зарядовий розподіл молекули та її енергію (розраховуються квантово-хімічними методами): електронна густина, порядок звязку, індекс вільної валентності, Е(НОМО, LUMO), жорсткість, електронегативність, молекулярний дипольний момент, поляризовність та ін. Геометричні дескриптори – параметри, які характеризують форму молекул (індекс Балабана, площа молекулярної поверхні, об’єм, та ін.). Фізико-хімічні дескриптори описують фізико-хімічні параметри молекулярних систем (показник ліпофільності, температура кипіння та ін.)
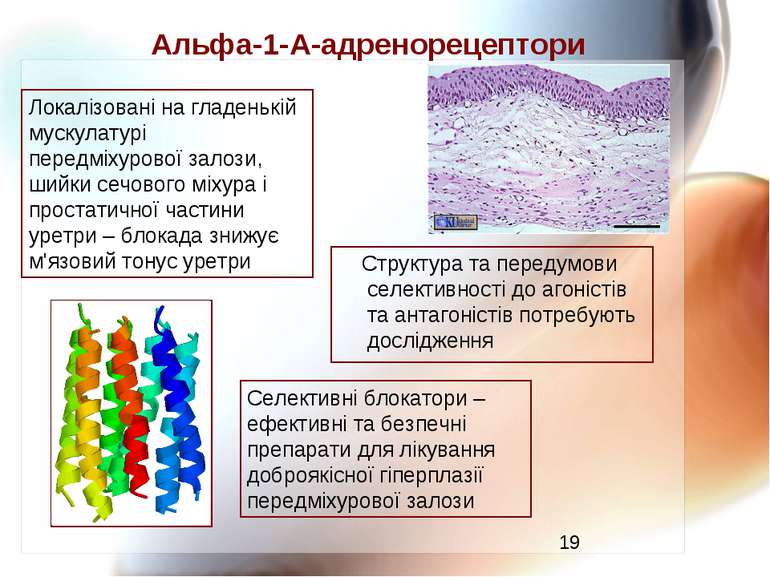
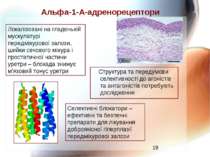
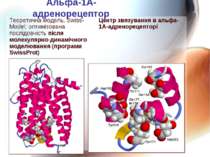
Альфа-1-А-адренорецептори Структура та передумови селективності до агоністів та антагоністів потребують дослідження Селективні блокатори – ефективні та безпечні препарати для лікування доброякісної гіперплазії передміхурової залози Локалізовані на гладенькій мускулатурі передміхурової залози, шийки сечового міхура і простатичної частини уретри – блокада знижує м'язовий тонус уретри
Розрахунок дескрипторів Проведено оптимізацію геометрії молекул послідовно методом молекулярної механіки ММ+ та напівемпіричним методом PM3. Серед досліджених показників заряди на атомах; значення дипольного моменту молекул; енергії вищої зайнятої (ВЗМО) і нижчої вільної (НВМО) молекулярних орбіталей; абсолютна жорсткість (ή), показник ліпофільності; загальноенергетичні властивості молекул топологічні дескриптори (індекс Балабана, індекс Вінера, топологічний діаметр, індекс загальної молекулярної зв’язності, площа молекулярної поверхні, об’єм, та ін.) похідних апорфіну
Статистична обробка даних Регресійний аналіз - програмний засіб ПЗ ПРІАМ (Планування, Регресія та Аналіз Моделей). Аналіз нормальності залишків та побудова статистичних графіків -програма SPSS 13.0 та MS Excel. З метою одержання стійкого як відносно структури, так і відносно коефіцієнтів, рівняння регресії в процесі аналізу проведено перетворення вихідних даних – ортогоналізація (ПЗ ПРІАМ з використанням ортогональних поліномів Чебишева) та нормування. Для одержання математичної моделі, яка б адекватно описувала досліджувані взаємозв’язки, були проаналізовані усі ефекти попарних взаємодій лінійних ефектів незалежних змінних. Усього, на етапі побудови математичної моделі проаналізовано на предмет їх включення в рівняння регресії 98 головних ефектів та 1225 ефектів взаємодій (всього 1323 ефекти).
Багатофакторна математична модель x27 = 6,38446*(X27 +0,0373734); x30 = 5,38746*(X30 +0,148487); x34 = 47,4261*(X34 +0,0564796); x46 = 0,0636783*(X46 – 81,7039); x47 = 0,95*(X47 – 9,05263); x48 = 2690,5*(X48 – 0,000173929); x50 = 0,00182324*(X50 – 1130,53). X27 Заряд на атомі вуглецю С11 X30 Заряд на атомі вуглецю С8 X34 Заряд на атомі вуглецю С4 X46 Індекс вільної валентності (total valence degree) X47 Топологічний діаметр (topological diameter) X48 Індекс загальної молекулярної зв’язаності (total connectivity) X50 Індекс Вінера a1A (pKi) (показник зв’язування речовини з альфа-1-А-адренорецептором)
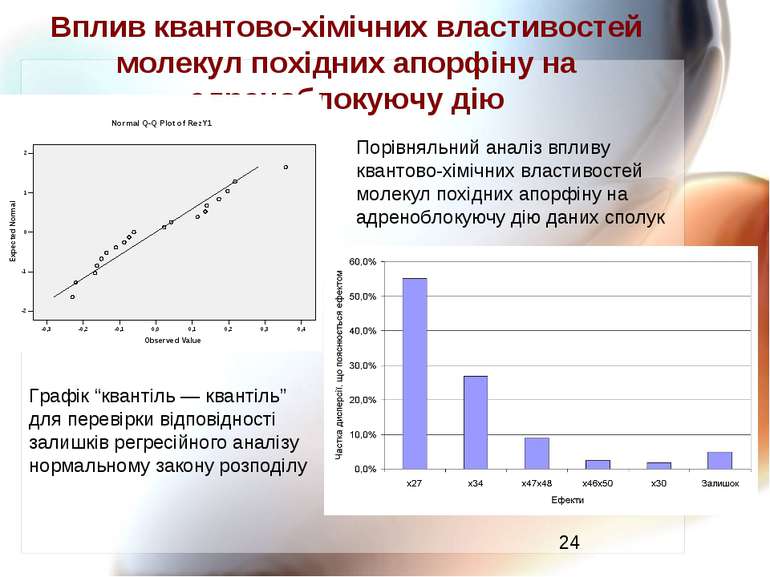
Вплив квантово-хімічних властивостей молекул похідних апорфіну на адреноблокуючу дію Порівняльний аналіз впливу квантово-хімічних властивостей молекул похідних апорфіну на адреноблокуючу дію даних сполук Графік “квантіль — квантіль” для перевірки відповідності залишків регресійного аналізу нормальному закону розподілу
Застосування QSAR для створення оригінальних лікарських засобів: пошук нових антиконвульсантів Tropsha A. Variable selection QSAR modeling, model validation, and virtual screening // An. Rep. Comp. Chem. – 2007. – Vol. 2. – P. 113-168
Концепція дескрипторного фармакофору Сучасні програмні засоби з комп’ютерного моделювання дозволяють розрахувати більше 1000 видів молекулярних дескрипторів Правильний вибір набору дескрипторів – запорука отримання ефективної QSAR моделі Дескрипторний фармакофор для дослідження сполук з певним типом фармакологічної активності – набір молекулярних дескрипторів, які найчастіше входять до ефективних QSAR моделей, розроблених при дослідженні різних хімічних груп сполук з цим типом фармакологічної активності.
Застосування QSAR у токсикології Використання класичних фізико-хімічних дескрипторів у QSAR–моделях для токсикології дало змогу прогнозувати такі важливі токсикологічні властивості речовин, як Коефіцієнт проникнення через шкіру та індекс подразнення шкіри для органічних кислот, основ, фенолів та електрофільних органічних сполук Індекс подразнення ока для нейтральних органічних сполук Створені бази даних з інформацією про різні види токсичності речовин та можливістю їх прогнозування
Застосування електронних дескрипторів для QSAR у токсикології Прогнозування місця гідроксилювання в ряду похідних фторбензолу цитохромом Р450 (дескриптори – електронна густина граничних орбіталей) Визначення рівня р-гідроксилювання похідних аніліну цитохромом Р450 (дескриптор – енергія вищої занятої молекулярної орбіталі) Визначення рівня кон’югації похідних фторнітробензолу з глутатіоном, каталізованого S-трансферазою (дескриптор – енергія нижчої вакантної молекулярної орбіталі) Визначення рівня кон’югації двозаміщених похідних 1-хлоро-4-нітробензолу з глутатіоном, каталізованого S-трансферазою (дескриптор – енергія нижчої вакантної молекулярної орбіталі та Ван-дер-Ваальсів об'єм) Рівень мутагенності ароматичних та гетероциклічних сполук (дескриптор – енергія нижчої вакантної молекулярної орбіталі) Прогнозування гострої токсичності (LD50) для речовин для полярного
Порівняльний аналіз молекулярних полів (Comparative Molecular Field Analysis, coMFA) Метод, заснований на тому, що взаємодія біологічно активної речовини з мішенню визначається, в першу чергу, нековалентними міжмолекулярними ефектами, які залежать від просторових особливостей та форми молекул. Мета coMFA – дослідження кореляцій між тривимірними харкктеристиками молекул та їх біологічною активністю. При CoMFA розрахунках проводиться аналіз набору гомологічних лігандів та виділяються області лігандного каркасу, модифікація яких потенційно призводить до підсилення або зниження активності. Особливість моделі – дескриптори молекули обчислюються у вигляді тривимірної карти, що описує задану властивість у просторі.
Порівняльний аналіз молекулярних полів (Comparative Molecular Field Analysis, coMFA) Навколо молекул формується куб, в середині якого задається сітка. Розрахунок амплітуди полів відбувається з використанням пробних атомів, які розміщуються в вузлах сітки. Використовуються наступні типи пробних атомів: атом вуглецю, позитивно чи негативно заряджений атом, донор чи акцептор водневого зв’язку, ліпофільна проба. Результатом аналізу є рівняння регресії з тисячами коефіцієнтів, що звязують величину активності зі значеннями амплітуди для полів, розрахованих з використанням пробних атомів.
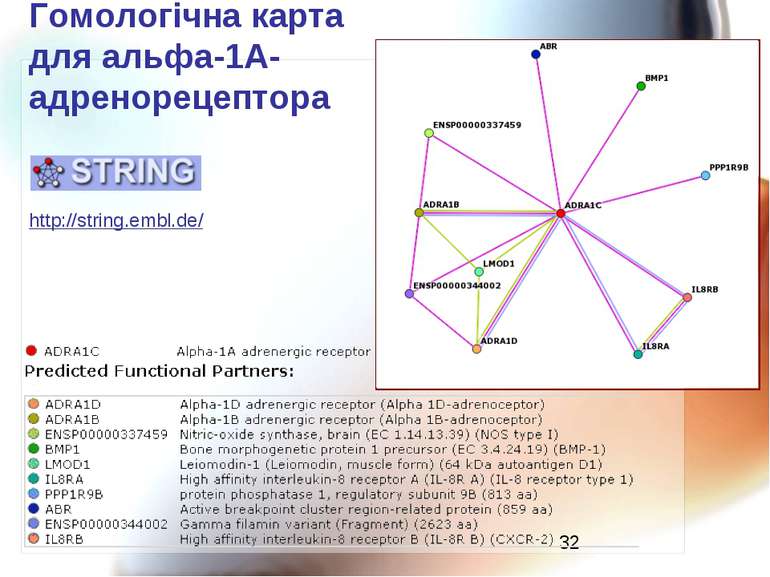
Дослідження білок-лігандних взаємодій Молекулярний докінг - віртуальне «прилаштування» ліганда до місця зв’язування в білку (програми DOCK, AutoDOCK, FlexDock, GOLD). Центр звязування білку в комплексі з лігандом може бути досліджений квантово-фармакологічними методами. Дослідження активного центру адренорецепторів: взаємодія адреналіну з бета-1-адренорецепторами
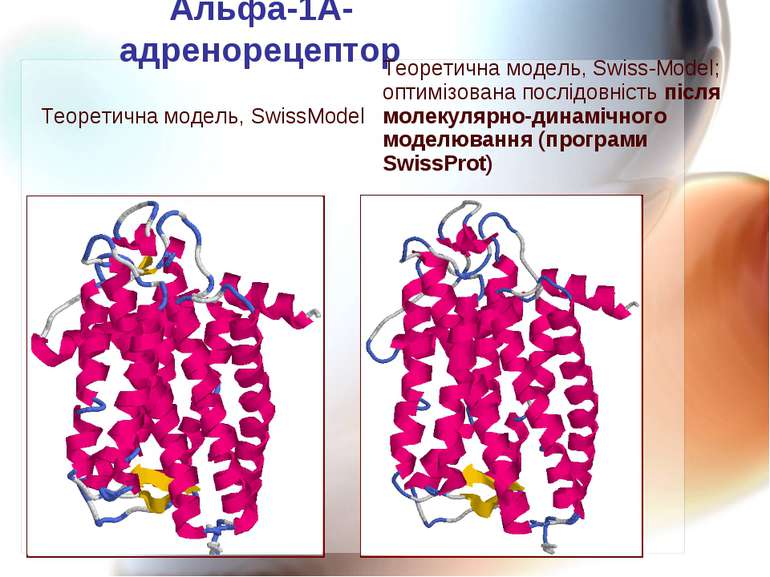
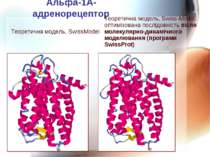
Альфа-1А-адренорецептор Теоретична модель, SwissModel Теоретична модель, Swiss-Model; оптимізована послідовність після молекулярно-динамічного моделювання (програми SwissProt)
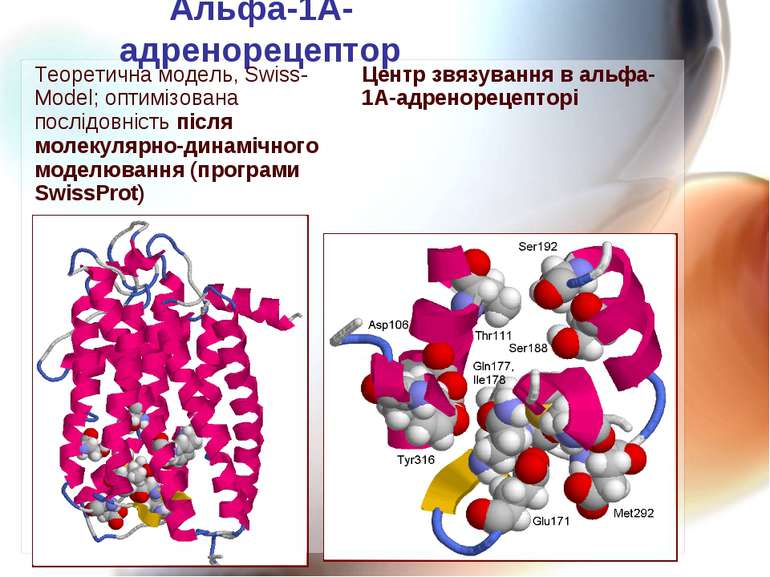
Альфа-1А-адренорецептор Теоретична модель, Swiss-Model; оптимізована послідовність після молекулярно-динамічного моделювання (програми SwissProt) Центр звязування в альфа-1А-адренорецепторі
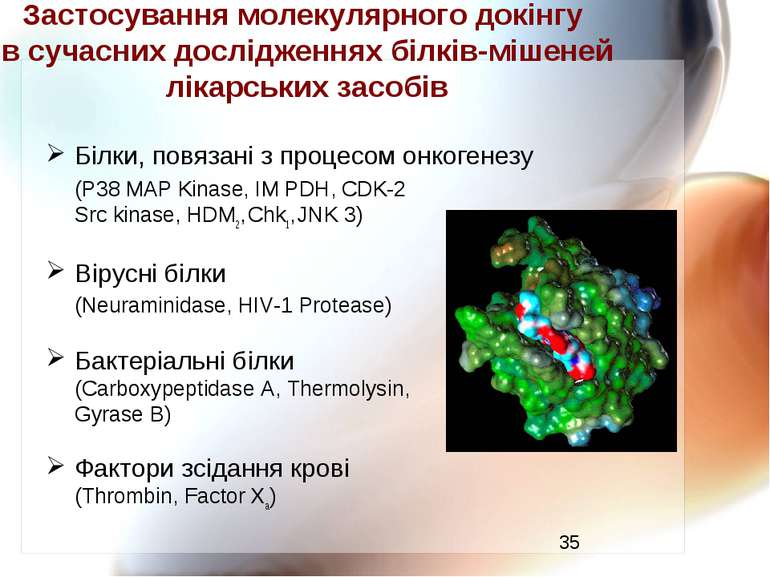
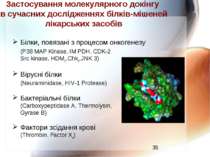
Застосування молекулярного докінгу в сучасних дослідженнях білків-мішеней лікарських засобів Білки, повязані з процесом онкогенезу (P38 MAP Kinase, IM PDH, CDK-2 Src kinase, HDM2, Chk1, JNK 3) Вірусні білки (Neuraminidase, HIV-1 Protease) Бактеріальні білки (Carboxypeptidase A, Thermolysin, Gyrase B) Фактори зсідання крові (Thrombin, Factor Xa)
Перспективи розвитку квантової фармакології: Розрахунки квантово-фармакологічних параметрів біомолекул великих розмірів Якомога точніше урахування оточення середовища досліджуваних молекул Вдосконалення методів розрахунку 3D-дескрипторів Підвищення ефективності QSAR-моделювання.
Схожі презентації
Категорії