Презентація на тему:
Оцтова кислота. Функціональна карбоксильна група. Використання оцтової кислоти
Завантажити презентацію
Оцтова кислота. Функціональна карбоксильна група. Використання оцтової кислоти
Завантажити презентаціюПрезентація по слайдам:
Запитання Що називають функціональною групою? Які функціональні групи ви знаєте? Які фізичні й хімічні властивості спиртів пов’язані з наявністю функціональної гідроксильної групи? Як діють етиловий і метиловий спирти на лакмус, метилоранж, фенолфталеїн? Запишіть формулу оцтової кислоти. Чи можна стверджувати, що фізичні й хімічні властивості оцтової кислоти будуть такими ж, як в етилового спирту?
Лабораторний дослід 9. Дія оцтової кислоти на індикатори У три пробірки наллємо по 1 мл розчину оцтової кислоти. У першу додамо кілька крапель лакмусу, у другу — метилоранжу, у третю — фенолфталеїну. Як змінилося забарвлення індикаторів? Для порівняння паралельно візьмемо три пробірки з хлоридною кислотою й виконаємо той же експеримент. Порівняйте спостереження й зробіть висновок. Висновок: оцтова кислота діє на індикатори так само, як і неорганічні кислоти.
Насичені одноосновні карбонові кислоти Органічні речовини, молекули яких містять одну або кілька функціональних карбоксильних груп, з’єднаних з вуглеводнями, називаються карбоновими кислотами. Загальна формула карбонових кислот: R –(COOH)n
Класифікація карбонових кислот За природою вуглеводневого радикала: насичені; ненасичені; ароматичні. За кількістю гідроксильних груп: одноосновні (монокарбонові); двохосновні (дикарбонові).
Номенклатура одноосновних карбонових кислот Відповідно до систематичної номенклатури, назви кислот походять від назв відповідних вуглеводнів з додаванням закінчення -ова. Нумерацію карбонового скелета починають з атома Карбону карбоксильної групи. H−COOH — метанова кислота (мурашина кислота); CH3−COOH — етанова кислота (оцтова кислота); C2H5−COOH — пропанова кислота (пропіонова кислота); C3H7−COOH — бутанова кислота (масляна кислота)
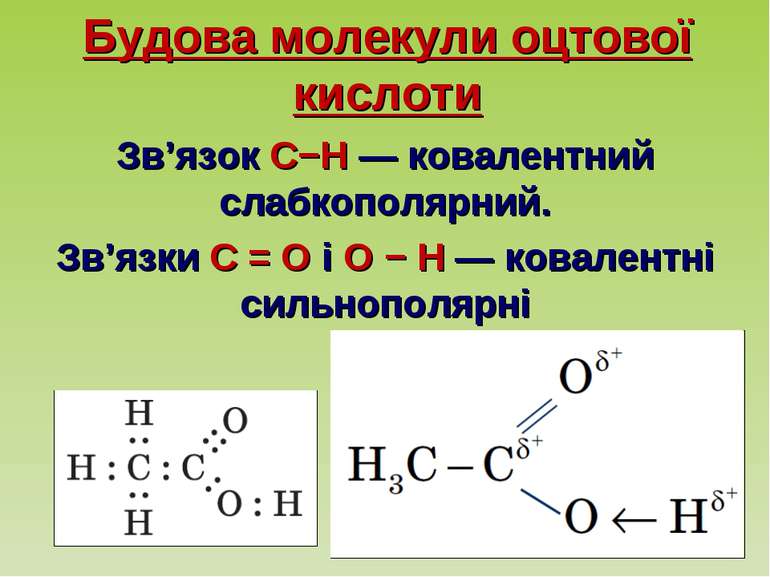
Будова молекули оцтової кислоти Зв’язок C−H — ковалентний слабкополярний. Зв’язки C = O і O − H — ковалентні сильнополярні
Фізичні властивості оцтової кислоти Оцтова кислота — це безбарвна рідина з різким запахом, температури кипіння й плавлення низькі (температура плавлення — 16,6°С, температура кипіння — 118,1°С, густина — 1,049 г/см3), добре розчинна у воді (розчин оцтової кислоти у воді називається оцтом)
Застосування виробництво барвників; розчинник; харчова промисловість; виробництво ацетатного волокна; виробництво лікарських препаратів та ін.
Запитання 1. Запишіть рівняння дисоціації оцтової кислоти. CH3 − COOH → CH3 − COO− +H+ 2. Чому оцтова кислота — одноосновна кислота? 3. Назвіть нижченаведені сполуки за систематичною номенклатурою: б) CH3 − CH2 − CH2 −COOH Чи можна вважати ці сполуки гомологами? ізомерами? Побудуйте найближчі гомологи та ізомери речовини б), назвіть їх за систематичною номенклатурою.
4. Обчисліть і порівняйте масову частку Оксигену в молекулах оцтової кислоти й етилового спирту. 5. Виходячи з будови молекули й отриманих знань, запропонуйте хімічні властивості оцтової кислоти.
Домашнє завдання Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи. Творче завдання. Підготувати схему (таблицю, презентацію) застосування оцтової кислоти.
Схожі презентації
Категорії