Презентація на тему:
Концепція розвитку фармацевтичного сектору галузі охорони здоров’я України
Завантажити презентацію
Концепція розвитку фармацевтичного сектору галузі охорони здоров’я України
Завантажити презентаціюПрезентація по слайдам:
Заступник Міністра Охорони Здоров’я України Гудзенко Олександр Павлович Концепція розвитку фармацевтичного сектору галузі охорони здоров’я України
доступність якісних, ефективних та безпечних лікарських засобів - основний фактор, який визначає доступність системи охорони здоров'я як в умовах стаціонару, так і у вигляді первинної медико-санітарної допомоги; перехід від контролю якості до створення гарантованої системи забезпечення якості ліків; формування менеджменту у фармацевтичному секторі, адекватної трансформації суспільства, поліпшення інформаційного забезпечення функціонування галузі та створення прозорої системи її функціонування; створення системи раціонального використання лікарських засобів та матеріальних ресурсів усіх рівнів; реформування науки та освіти, адекватної потребам галузі та сучасного стану суспільства. Актуальні проблеми фармацевтичного сектору системи охорони здоровۥя КОНЦЕПЦІЯ РОЗВИТКУ ФАРМАЦЕВТИЧНОГО СЕКТОРУ ГАЛУЗІ ОХОРОНИ ЗДОРОВ'Я УКРАЇНИ Наказ МОЗ від 18 грудня 2007 р. N 838
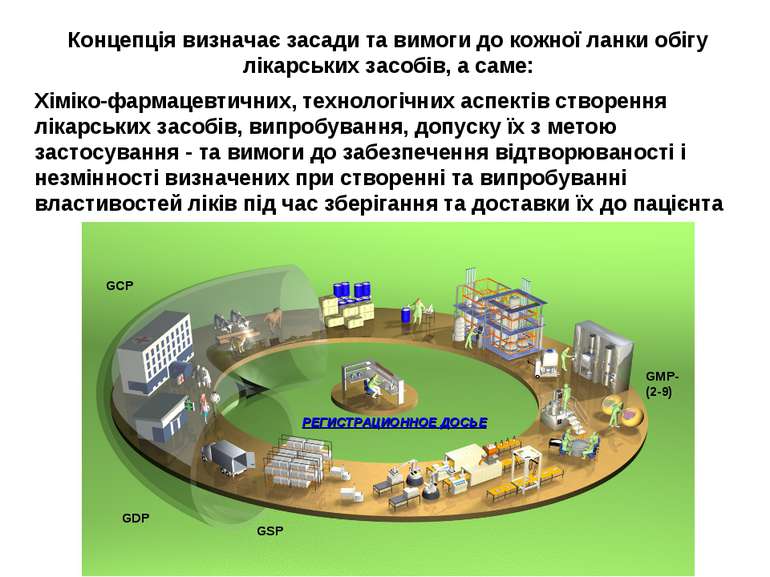
Концепція визначає засади та вимоги до кожної ланки обігу лікарських засобів, а саме: Хіміко-фармацевтичних, технологічних аспектів створення лікарських засобів, випробування, допуску їх з метою застосування - та вимоги до забезпечення відтворюваності і незмінності визначених при створенні та випробуванні властивостей ліків під час зберігання та доставки їх до пацієнта РЕГИСТРАЦИОННОЕ ДОСЬЕ
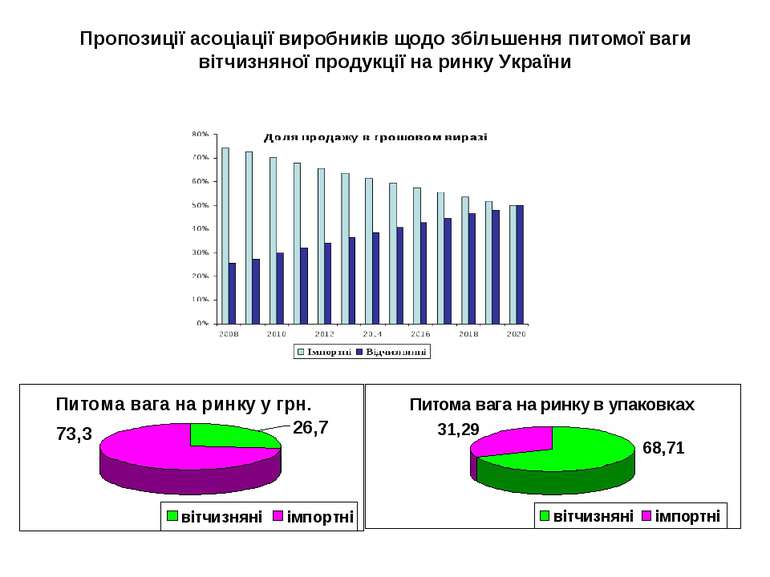
Пропозиції асоціації виробників щодо збільшення питомої ваги вітчизняної продукції на ринку України
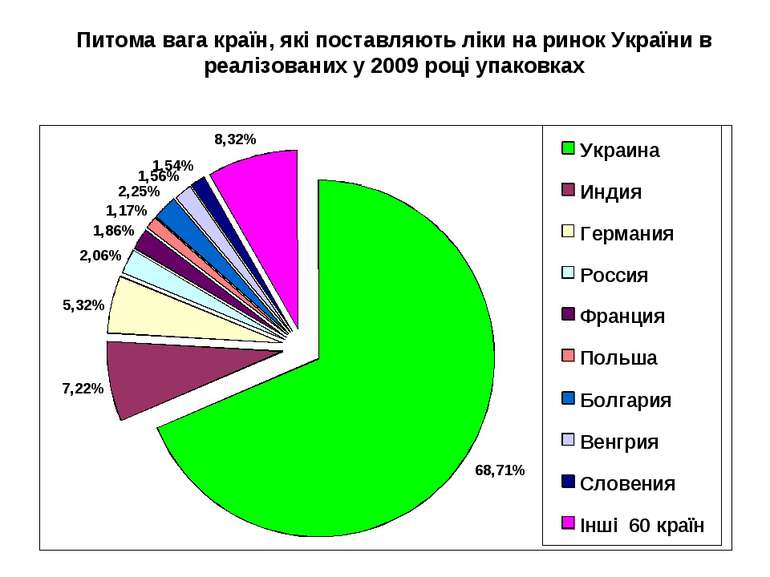
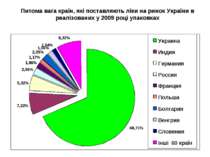
Питома вага країн, які поставляють ліки на ринок України в реалізованих у 2009 році упаковках
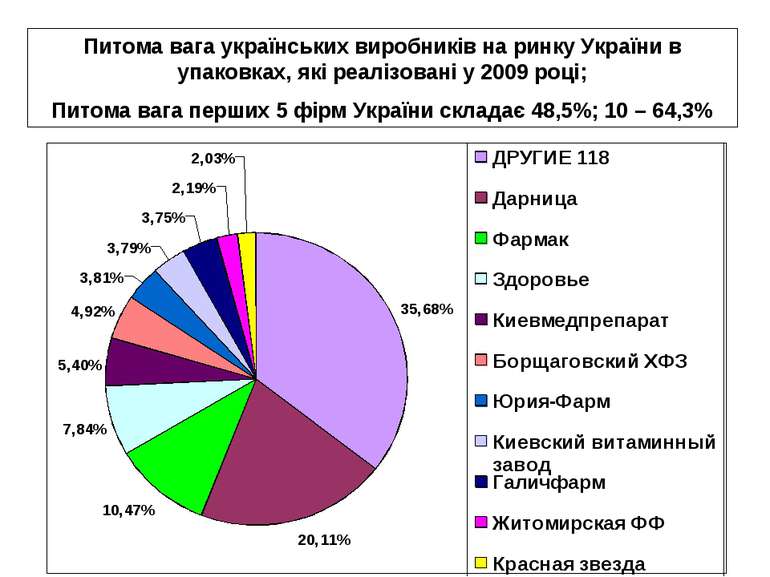
Питома вага українських виробників на ринку України в упаковках, які реалізовані у 2009 році; Питома вага перших 5 фірм України складає 48,5%; 10 – 64,3%
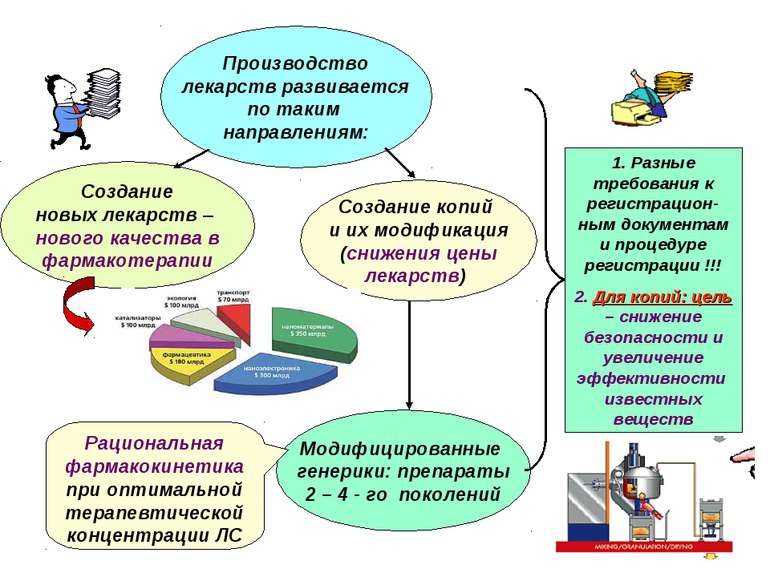
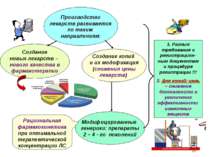
Производство лекарств развивается по таким направлениям: Создание новых лекарств – нового качества в фармакотерапии Модифицированные генерики: препараты 2 – 4 - го поколений Создание копий и их модификация (снижения цены лекарств) 1. Разные требования к регистрацион-ным документам и процедуре регистрации !!! 2. Для копий: цель – снижение безопасности и увеличение эффективности известных веществ Рациональная фармакокинетика при оптимальной терапевтической концентрации ЛС
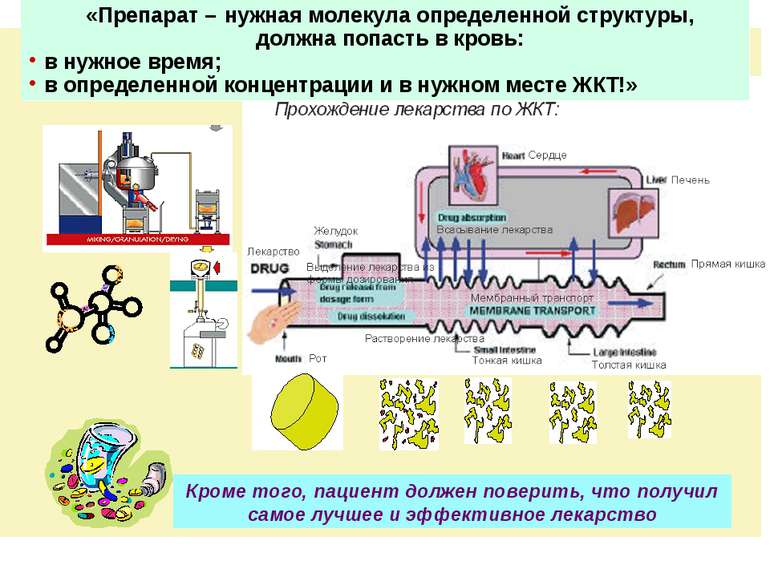
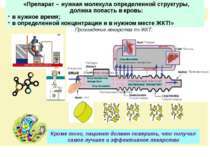
Кроме того, пациент должен поверить, что получил самое лучшее и эффективное лекарство «Препарат – нужная молекула определенной структуры, должна попасть в кровь: в нужное время; в определенной концентрации и в нужном месте ЖКТ!»
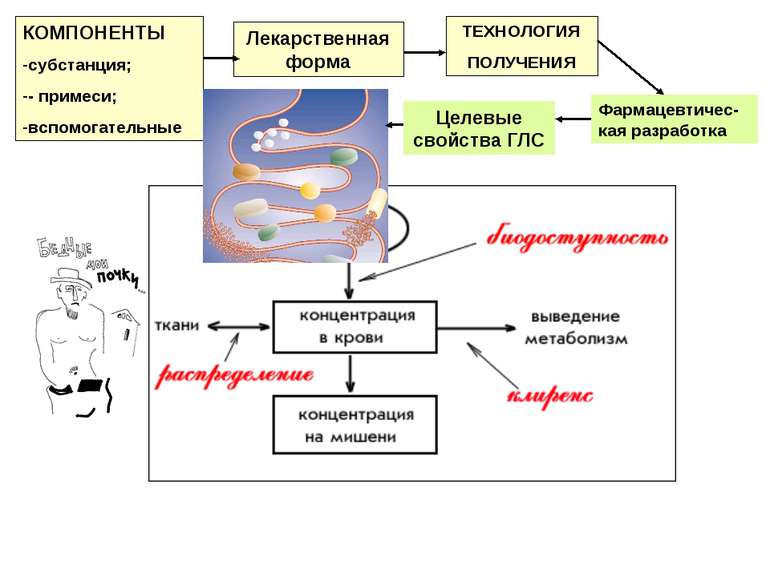
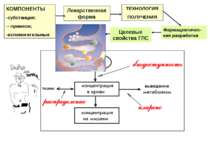
Лекарственная форма КОМПОНЕНТЫ субстанция; - примеси; вспомогательные ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ Фармацевтичес-кая разработка Целевые свойства ГЛС
ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ДЛЯ КОТОРЫХ ИССЛЕДОВАНИЕ БИЭКВИВАЛЕНТНОСТИ НЕ ПРОВОДЯТСЯ, так как взаимозаменяемость гарантируется доказательством соответствия фармакопейным спецификациям армацевтическая эквивалентность) Парентеральные лекарственные средства Растворы для орального применения Порошки для приготовления растворов Газы Глазные, ушные лекарственные средства в форме водных растворов Лекарственные средства местного действия в форме водных растворов Назальные спреи и ингаляционные препараты в форме водных растворов ПРИКАЗ МЗ УКРАИНЫ ОТ 17.04.2007 № 190 Вітчизняні 60% Іноземні 40%
Исследования биоэквивалентности методами in vitro Биофармацевтическая классификационная система Приказ МЗ № 426 от 28.06.2005/№ 95 от 01.03.2006, № 190 от 17.04.07. Класс 1 – Высокая растворимость, высокая проницаемость от изучения биоэквивалентности можно отказаться Класс 2 – Низкая растворимость, высокая проницаемость от изучения биоэквивалентности можно отказаться при условиях если активное вещество – это слабая кислота и генерик растворяется ≥ 85% в-ва при pH 6.8 за ≤ 30 мин. и его профиль растворения подобен профилю референтного препарата при pH 1.2, 4.5, 6.8; Класс 3 – Высокая растворимость, низкая проницаемость от изучения биоэквивалентности можно отказаться при условиях: если генерик и референтный препарат очень быстро растворимые ≥ 85% в-ва за ≤ 15 мин. при pH 1.2, 4.5, 6.8 Класс 4 – Низкая растворимость, низкая проницаемость исследования биоэквивалентности in vivo проводятся всегда !!!
КРИТЕРИИ ВЫБОРА МЕТОДА ОЦЕНКИ ЭКВИВАЛЕНТНОСТИ (ВЗАИМОЗАМЕНЯЕМОСТИ) Исследования in vitro проводят для препаратов в твердой дозированной форме немедленного высвобождения системного действия Фармакодинамические испытания проводят для препаратов, для которых невозможно определить концентрации действующего вещества в биологических жидкостях, но возможно оценить значимые фармакодинамические показатели, вызываемые лекарственным средством Фармакокинетические испытания проводят для препаратов системного действия, для которых возможно определить концентрации действующего вещества в биологических жидкостях Сравнительные клинические испытания проводят для препаратов, для которых невозможно определить фармакокинетические параметры или получить соответствующие фармакодинамические точки
Основні завдання Концепції спрямовані на організацію стабільної діяльності фармацевтичного сектору, який забезпечує рівень якості та ефективності фармакотерапії і профілактики захворювань населення і реалізуються у напрямках: 1. доступність ліків - рівний доступ населення до якісних лікарських засобів, як у фізичному, так і економічному аспектах; 2. якість ліків - у плані їх розробки за встановленими стандартами, доведення методами доказової медицини їх ефективності, безпечності та стабільності цих властивостей під час виробництва, реалізації та застосування; 3. раціонального використання ліків - створення умов, при яких призначення та споживання ліків здійснювалося б виключно за принципами клінічної доцільності та економічної раціональності; 4. формування менеджменту у фармацевтичному секторі, адекватного трансформації суспільства, який забезпечить розвиток прозорої системи його функціонування, поліпшення інформаційного забезпечення щодо функціонування галузі; 5. реформування системи наукового забезпечення та освіти, адекватної потребам галузі та сучасного стану реформування суспільства; 6. створення системи доведення інформації про лікарські засоби до медичних, фармацевтичних працівників та пацієнта, що є важливим фактором лікарської допомоги, зокрема втілення елементарних знань про лікарські засоби серед населення та протистояння агресивній рекламі.
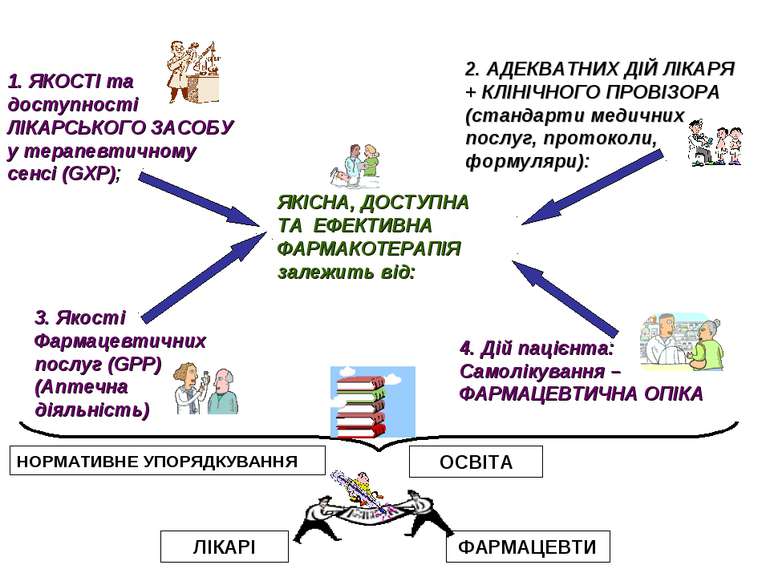
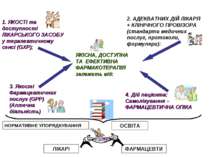
ЯКІСНА, ДОСТУПНА ТА ЕФЕКТИВНА ФАРМАКОТЕРАПІЯ залежить від: 1. ЯКОСТІ та доступності ЛІКАРСЬКОГО ЗАСОБУ у терапевтичному сенсі (GXP); 2. АДЕКВАТНИХ ДІЙ ЛІКАРЯ + КЛІНІЧНОГО ПРОВІЗОРА (стандарти медичних послуг, протоколи, формуляри): 3. Якості Фармацевтичних послуг (GPP) (Аптечна діяльність) 4. Дій пацієнта: Самолікування – ФАРМАЦЕВТИЧНА ОПІКА ОСВІТА НОРМАТИВНЕ УПОРЯДКУВАННЯ ЛІКАРІ ФАРМАЦЕВТИ
Гарантия качества - это постоянный процесс, который обеспечивает соответствие установленным стандартам Информация, полученная на постмаркетинговой стадии, т.е. после регистрации, может существенным образом повлиять на применение лекарственного препарата в клинике, в том числе и генерика, потому, что: результаты экспериментальных исследований на животных не всегда можно использовать применительно к человеку, малое количество больных, задействованных в клинических исследованиях, не позволяет сделать правильные выводы о безопасности и эффективности ЛС, в исследования не включаются группы больных, страдающих сопутствующими заболеваниями. Словом, объективную информацию о эффективности и развитии побочных эффектов можно получить только тогда, когда препарат принимают сотни тысяч пациентов. БЕЗОПАСНОСТЬ И ЭФФЕКТИВНОСТЬ ГЛС
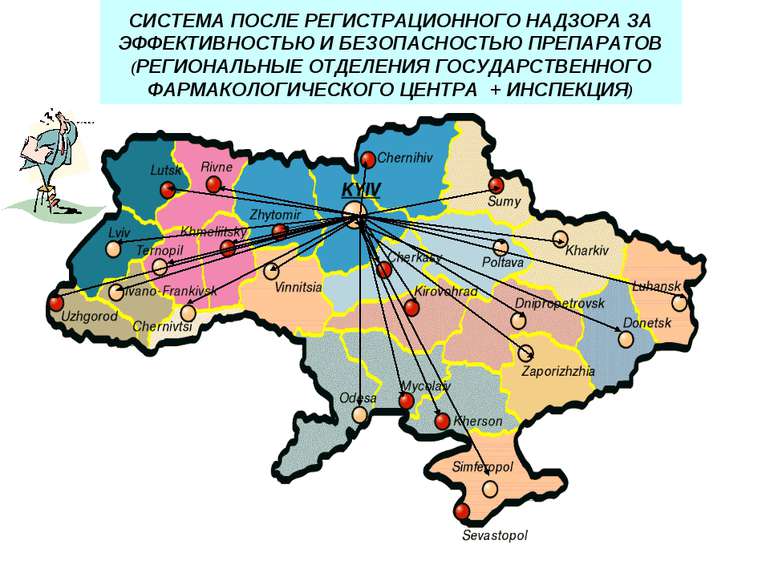
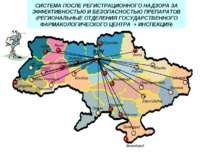
СИСТЕМА ПОСЛЕ РЕГИСТРАЦИОННОГО НАДЗОРА ЗА ЭФФЕКТИВНОСТЬЮ И БЕЗОПАСНОСТЬЮ ПРЕПАРАТОВ (РЕГИОНАЛЬНЫЕ ОТДЕЛЕНИЯ ГОСУДАРСТВЕННОГО ФАРМАКОЛОГИЧЕСКОГО ЦЕНТРА + ИНСПЕКЦИЯ)
Діюча система фармаконагляду в Україні Наказ МОЗ № 898 від 27.12.06 р. Міністерство охорони здоров’я України Державний фармакологічний центр Управління післяреєстраційного нагляду Регіональні відділення Управління післяреєстраційного нагляду Метод спонтанних повідомлень
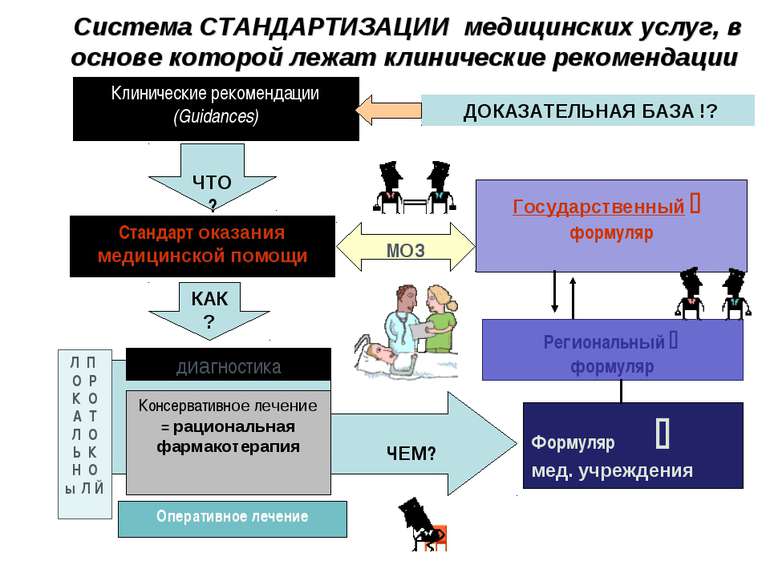
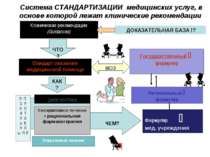
Система СТАНДАРТИЗАЦИИ медицинских услуг, в основе которой лежат клинические рекомендации Клинические рекомендации (Guidances) ЧТО? Стандарт оказания медицинской помощи КАК? диагностика Оперативное лечение ЧЕМ? Формуляр мед. учреждения Консервативное лечение = рациональная фармакотерапия Л П О Р К О А Т Л О Ь К Н О ы Л Й Региональный формуляр Государственный формуляр МОЗ ДОКАЗАТЕЛЬНАЯ БАЗА !?
Основні функції формулярної системи Медична – визначення й розробка методів раціональної фармакотерапії розповсюджених захворювань Фармакологічна – забезпечення контролю над правильним використанням ЛЗ і здійснення заходів щодо попередження та виправлення ятрогенних помилок Соціальна – забезпечення хворих якісним лікуванням Економічна - використання клінічно і економічно найбільш ефективних лікарських засобів Інформаційна - широке разповсюдження об’єктивної інформації, заснованої на принципах доказової медицини Професійно-освітня - позитивний вплив на підвищення кваліфікації лікарів у міжатестаціний період, передбачений вимогами МОЗ України
Державний формуляр лікарських засобів Наказ МОЗ України від 17.03.09 р. №173 «Про затвердження першого випуску Державного формуляру лікарських засобів та забезпечення його доступності» * Наказ МОЗ від 28.01.2010 № 58 "Про затвердження складу Центрального формулярного комітету МОЗ України" Наказ МОЗ України №59 від 28 січня 2010р. "Про затвердження другого випуску Державного формуляру лікарських засобів та забезпечення його доступності « Міністерство охорони здоров’я України Центральний формулярний комітет Державний фармакологічний центр ДЕРЖАВНИЙ ФОРМУЛЯР ЛІКАРСЬКИХ ЗАСОБІВ Випуск перший Київ 2009 Міністерство охорони здоров’я України Центральний формулярний комітет Державний фармакологічний центр ДЕРЖАВНИЙ ФОРМУЛЯР ЛІКАРСЬКИХ ЗАСОБІВ Випуск другий Київ 2010
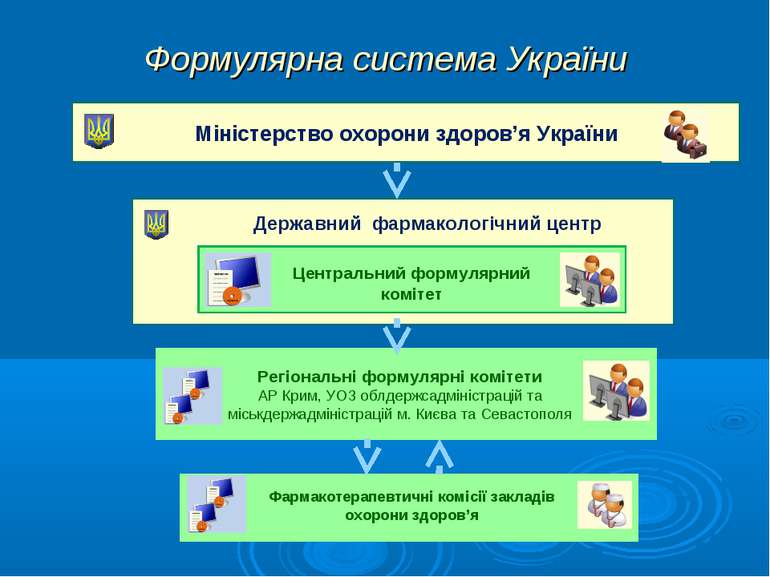
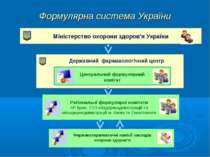
Формулярна система України Міністерство охорони здоров’я України Державний фармакологічний центр Центральний формулярний комітет Регіональні формулярні комітети АР Крим, УОЗ облдержсадміністрацій та міськдержадміністрацій м. Києва та Севастополя Фармакотерапевтичні комісії закладів охорони здоров’я
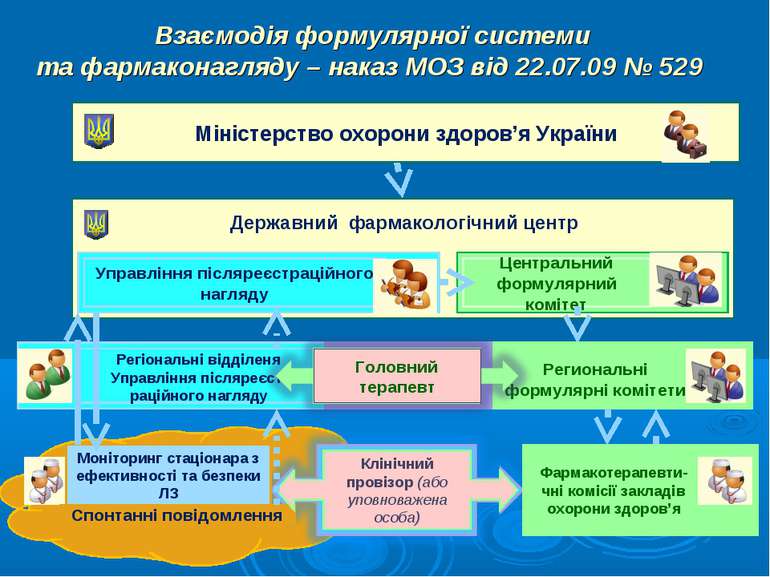
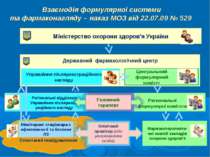
Взаємодія формулярної системи та фармаконагляду – наказ МОЗ від 22.07.09 № 529 Міністерство охорони здоров’я України Державний фармакологічний центр Управління післяреєстраційного нагляду Регіональні відділеня Управління післяреєст-раційного нагляду Центральний формулярний комітет Региональні формулярні комітети Моніторинг стаціонара з ефективності та безпеки ЛЗ Спонтанні повідомлення Клінічний провізор (або уповноважена особа) Фармакотерапевти-чні комісії закладів охорони здоров’я
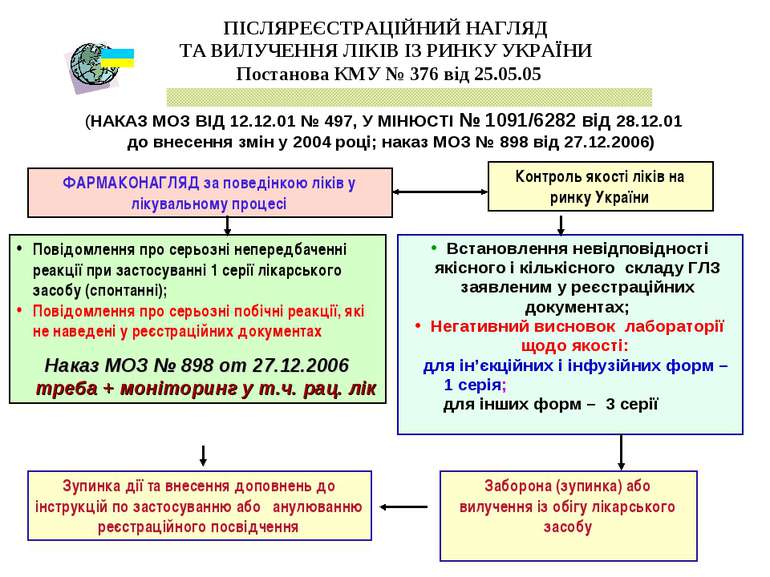
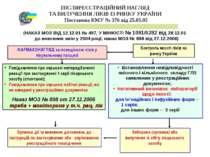
ПІСЛЯРЕЄСТРАЦІЙНИЙ НАГЛЯД ТА ВИЛУЧЕННЯ ЛІКІВ ІЗ РИНКУ УКРАЇНИ Постанова КМУ № 376 від 25.05.05 (НАКАЗ МОЗ ВІД 12.12.01 № 497, У МІНЮСТІ № 1091/6282 від 28.12.01 до внесення змін у 2004 році; наказ МОЗ № 898 від 27.12.2006) Встановлення невідповідності якісного і кількісного складу ГЛЗ заявленим у реєстраційних документах; Негативний висновок лабораторії щодо якості: для ін’єкційних і інфузійних форм – 1 серія; для інших форм – 3 серії ФАРМАКОНАГЛЯД за поведінкою ліків у лікувальному процесі Контроль якості ліків на ринку України Заборона (зупинка) або вилучення із обігу лікарського засобу Повідомлення про серьозні непередбаченні реакції при застосуванні 1 серії лікарського засобу (спонтанні); Повідомлення про серьозні побічні реакції, які не наведені у реєстраційних документах Наказ МОЗ № 898 от 27.12.2006 треба + моніторинг у т.ч. рац. лік Зупинка дії та внесення доповнень до інструкцій по застосуванню або анулюванню реєстраційного посвідчення
Инструменты влияния на качество медицинской помощи Общие инструменты: лицензия, аккредитация, сертификация, стандартизация, внешний контроль/аудит, внутренний контроль/аудит, мониторинг безопасности и эффективности лечения Украина Евросоюз Ретроспективна оценка качества медицинской помощи и «карательные» мероприятия Особенности Проспективная деятельность с управлением качества медицинской помощи 1.Медико-технологічні документы под названием «Стандарты», «Протоколы», «Алгоритмы», «Нормативы» и т.д. 2.Контроль результатов лечения отдельными экспертами 3.Рекомендований характер Государственного Формуляра 4.Нормирование деятельности фармацевтических учреждений Центральный уровень управления отраслью 1.Клинические рекомендации 2.Стандарты с критериями качества 3.Системи индикаторов для клинического аудита 4.Формулярная система 5. Надлежащая аптечная практика 1. Декларируемый отпуск лекарств по рецептами 2.Самолечение и полипрагмазия 3.Экспертная оценка результатов мед. Помощи относительно среднестатистического уровня Локальный уровень – оказания медицинской помощи 1.Фармацевт. Обслуживание; 2.Локальный протокол (клинический маршрут), интегрированный в медицинскую карточку пациента 3.Клинический аудит
Отличия механизмов обеспечения качества лечения В Украине Экспертиза оказания медицинской помощи (на 3-х уровнях) 1-й уровень: врач-пациент (индивидуальный); 2-й уровень: уровень ЛПУ (уровень учреждения) 3-й уровень: оценивается сеть учреждений здравоохранения (территориальный). В государствах ЕС профессиональный аудит Клинический аудит Организационный аудит Финансовый аудит
Принципиальная разница между контролем и профессиональным аудитом КОНТРОЛЬ ПРОФЕССИОНАЛЬНЫЙ АУДИТ 1. Установление соответствия по одному или нескольким параметрам 1. Сбор и анализ объективной информации относительно профессиональной деятельности 2. Формализованный процесс 2. Процесс, который требует неформального творческого подхода, однако не исключено использование формализованных критериев 3. Цель контроля – установление соответствия заранее установленному уровню 3. Цель аудиту – определение уровня, которого следует достигнуть 4. Как правило, внешняя процедура по отношению к исполнителям, не исключен самоконтроль 4. Как правило, составляющая деятельности медицинского работника, однако возможен и внешний аудит
Обеспечение качества фармакотерапии в части применения ЛС общие инструменты: лицензирование, аккредитация, сертификация, стандартизация, внешний контроль/аудит, внутренний контроль/аудит, мониторинг безопасности та эффективности лечения Украина Сфера деятельности Евросоюз 1.Фрагментарная деятельность в сфере финансовых механизмов фармацевтической практики; 2.Регулирование и контроль рецептурного сектора лекарственных средств и обслуживания льготных категорий населения Фармация 1.Системная деятельность по регулированию качества фармацевтической практики: 1.1. содействию улучшения состояния здоровья, с упреждением заболевания и достижения целей здравоохранения. 1.2. поставка и применение лекарственных средств и приспособлений для их использования или с иными аспектами лечения. 1.3. ответственное самолечение, в том числе консультации о лекарствах и, при необходимости, предложение лекарств или иных методов лечения пациентов с симптомами и расстройствами, которые допускается лечить амбулаторно 1.4. влияние на назначение и применение лекарственных средств. 1.Мониторинг эффективности и безопасности лекарств 2. Рекомендованный характер Государственного Формуляра 3. Медико-технологические документы содержат лекарства которых нет в Украине Медицинское применение лекарственных средств 1.Моніторинг эффективности и безопасности лекарственных средств 2. Обязательное выполнение формулярных списков (или их аналогов)
Для оптових структур необхідно: затвердити нормативно-технічні вимоги щодо прийому, обробки та зберігання продукції; скласти реєстр оптових компаній з вимогами щодо контролю за адресами їх місця діяльності та знаходження офісів; затвердити вимоги у вигляді обов'язкових нормативів, які випливають із правил належної практики дистрибуції, і затверджуються з врахуванням вимог цієї Концепції. В основу ліцензійних умов покласти спроможність виконувати вимоги, які визначені у цьому пункті. Для аптечної мережі, роздрібної реалізації ліків необхідно затвердити: 1. нормативно-технічні вимоги щодо обслуговування населення аптечними закладами, зокрема: 1.1 атлас фармацевтичної опіки затвердити як основу стандарту обслуговування пацієнта; 1.2 правила прийому, обробки та зберігання лікарських засобів в аптечних закладах; 1.3 доопрацювати порядок відпуску лікарських засобів. Розділ Концепції “Оптова та роздрібна реалізація лікарських засобів”, затвердженої наказом МОЗ від 18 грудня 2007 р. N 838
Просвещение и профилактика ухудшения здоровья населения – 4 стандарта Обеспечение правильного применения рецептурных препаратов і изделий мед. назначения – 6 стандартов; Самолечение – ФАРМАЦЕВТИЧЕСКАЯ ОПЕКА - 4 стандарта; Влияние на выписку и применение лекарств и изделий медицинского назначения – 9 стандартов РАЗОМ ТРЕБА РОЗРОБИТИ ТА ВТІЛИТИ 23 СТАНДАРТИ, щоб 24 тис. аптечних закладів перетворилися у заклади охорони здоров‘я “РУКОВОДСТВО ПО РАЗРАБОТКЕ И ВНЕДРЕНИЮ СТАНДАРТОВ ПО НАДЛЕЖАЩЕЙ АПТЕЧНОЙ ПРАКТИКЕ (ФАРМАЦЕВТИЧНИХ УСЛУГ) – GPP” ВОЗ, Копенгаген, Дания, май 2001 г. Статья 16. Заведения здравоохранения Закона “Основы законодательства Украины о здравоохранении” Непосредственно здравоохранение населения обеспечивают санитарно-профилактические, лечебно-профилактические, физкультурно-оздоровительные, санаторно-курортные, аптечные, научно-медицинские и другие заведения здравоохранения.
1. Предупреждение заболевания и поддержки лечения при ВІЛ/СНІД 2. Симптоматическое лечение алергии; 3. Формирование аптечки первой помощи для служебных помещений; 4. Формирование домашней аптечки первой помощи; 5. Формирование аптечки первой помощи для детей; 6. Формирование аптечки первой помощи для путешествий; 7. Симптоматическое лечение боли в горле; 8. Симптоматическое лечение дисбактериозу; 9. Симптоматическое лечение диареи; 10. Поддержка отказа от курения; 11. Симптоматическое лечение ушибов и синяков; 12. Симптоматическое лечение кашля; 13. Симптоматическое лечение ожогов; 14. Симптоматическое лечение царапин; 15. Симптоматическое лечение стреса; 16. Предупреждение заболевания и способствованию желания лечения туберкулеза Приказ МЗ, “Об утверждении протоколов фармацевтического обслуживания” № 158 от 22.02.2010 г.
Схожі презентації
Категорії