Презентація на тему:
Хронічне легеневе серце
Завантажити презентацію
Хронічне легеневе серце
Завантажити презентаціюПрезентація по слайдам:
Хронічне легеневе серце Професор кафедри терапії і сімейної медицини Тернопільського державного медичного університету Звершхановський Фелікс Андрійович
Актуальність проблеми хронічного легеневого серця ( ХЛС ) як важкого ускладнення хронічних обструктивних захворювань легень ( ХОЗЛ ) зумовлена неухильним збільшенням захворюваності та смертності від ХОЗЛ. Зокрема, захворюваність на ХОЗЛ за останнє десятиріччя в країнах Північної Європи склала 4–6 %.
Закономірність пошкодження серця при тривалих захворюваннях легень описана в 1838 році Б. Лаенеком. Термін ХЛС запропоновано П. Уайтом в 1935 році. До того часу легеневе серце розглядалося в рамках легенево-серцевої недостатності.
За визначенням Комітету експертів ВООЗ (1961), легеневе серце (cor pulmonale) — це гіпертрофія правого шлуночка на тлі захворювань, перебіг яких супроводжується порушенням структури чи функції легеневої тканини, за винятком випадків, коли зміни в легенях самі є результатом первинного ураження лівих відділів серця чи природжених вад серця або великих кровоносних судин.
Основою для визначення ХЛС є гіпертрофія правого шлуночка, зумовлена підвищенням легенево-судинного опору та розвитком легеневої гіпертензії (ЛГ).
Даний постулат розвинув Б.Є. Вотчал (1962) і запропонував таке визначення: легеневе серце — це патологічний стан, який характеризується гіпертрофією і (або) дилатацією правого шлуночка серця в результаті легеневої гіпертензії, зумовленої первинними захворюваннями бронхолегеневого апарату, судин легень або торакодіафрагмальними порушеннями [1, 3].
ЛЕГЕНЕВА АРТЕРІАЛЬНА ГІПЕРТЕНЗІЯ (ЛАГ) трактується як хвороба малих легеневих артерій, що характеризується судинною проліферацією та ремоделюванням. ЛАГ призводить до прогресуючого збільшення легеневого судинного опору та в результаті – до правошлуночкової недостатності та смерті. ЛАГ - це підвищення середнього тиску у легеневій артерії більше 25 мм рт. ст. в стані спокою або 30 мм рт. ст. при фізичному навантаженні
У 1865 році німецький дослідник Юліус Клоб (Julius Klob) звітував про знахідки при аутопсії пацієнта, що мав прогресуючі набряки, задишку та ціаноз, що в результаті призвело до його смерті у віці 59 років. Замість серцевої патології, Клоб знайшов виражене звуження дрібних гілок легеневої артерії, що були вражені атеросклерозом[3].
історія У 1891 році видатний німецький лікар Ернст фон Ромберґ (Ernst von Romberg) описав схожу клінічну картину у чоловіка 24 років. При аутопсії пацієнта окрім склерозу легеневих судин було виявлено виражену гіпертрофію правого шлуночку серця[4].
історія У 1897 році Віктор Ейзенменгер (Victor Eisenmenger) описав пацієнтку 32-х років, що з дитинства мала симптоми задишки та ціанозу. Згодом у пацієнтки розвинулась гостра серцева недостатність та масивна легенева кровотеча, що в результаті призвело до її загибелі. При аутопсії померлої виявлено великий вентрикулосептальний дефект та декстрапозицію аорти
історія До найчастіших причин розвитку синдрому ХЛС належать хронічний обструктивний бронхіт (ХОБ), бронхіальна астма (БА) та емфізема легень (ЕЛ). Так, за даними М.М. Бережницького та співавторів [2], бронхопульмональна форма ХЛС спостерігається в 92–96 % випадків, серед них перше місце займають ХОБ і БА (84–86 %), менш поширеною причиною ХЛС є туберкульоз легень (10–11 %).
історія У 1901 році Професор Медицини Університету Буенос-Айреса, Аргентина, Абель Аєрза (Abel Ayerza) вперше прочитав лекцію студентам з приводу синдрому, що включав в себе такі симтоми, як хронічний ціаноз, задишку та поліцитемію. Всі ці симптоми були асоційовані зі склерозом легеневих артерій.
Крім того, гіпертрофію правого шлуночка спричиняють захворювання серцевих судин (первинна легенева гіпертензія, тромбоемболія легеневої артерії, вузликовий поліартеріїт, а також раптова обтурація легеневих судин і резекція легені).
Історія Пізніше, один із його студентів Ф. Арріллага (F. Arrillaga) назвав цей синдром — «Синдром Аєрза».[6] Пізніше, цей синдром асоціювали з терміном Первинна ЛГ, який в подальшому класифікували в Ідіопатичну та Сімейну ЛГ
Історія У 1983 році американські лікарі С. Річ (Rich S) та В. Лем (Lam W) вперше виконали балонну передсердну атріосептостомію у пацієнта з ЛГ, у якого медикаментозне лікування виявилось неефективним.[7]
Легенева артеріальна гіпертензія, пов’язана з захворюваннями легень, гіпоксією або їх поєднанням: хронічні обструктивні захворювання легень; інтерстиціальна хвороба легень; апное у сні; альвеолярні гіповентиляційні порушення; гірська хвороба; дефекти розвитку.
Етіологія Мутація гена, що кодує скелет морфогенетичного протеїнового рецептору типу 2 (англ. BMPR2 – bone morphogenetic protein receptor type II), який знаходиться в хромосомі 2q33, виявляється майже у 50 % хворих на Сімейну ЛГ. Також вона виявлена у хворих на ЛГ, асоційовану з медикаментами (фенфлурамін). Насьогодні відомо понад 70 різновидів мутацій гену BMPR2.[8], [9]
Етіологія Також причинами ЛГ можуть бути ВІЛ-інфекція, склеродерма та інші аутоімунні захворювання, цироз печінки та портальна гіпертензія, фіброзуючий медіастиніт, вроджені вади серця, тромбоемболія легеневих артерій, прийом медикаментів та інші. У випадках, коли причину розвитку ЛГ не вдається встановити, тоді йде мова про Ідіопатичну ЛГ.
Також, порушують процеси вентиляції і зумовлюють розвиток легеневої гіпертензії й легеневого серця ботулізм, міастенія, поліомієліт, масивні плевральні шварти, клапанний пневмоторакс, кіфосколіоз (кіфосколіотичне легеневе серце), ожиріння (синдром Піквіка).
Залежно від стану компенсації (відсутність або наявність ознак застою у великому колі кровообігу) розрізняють компенсовану і декомпенсовану форми ХЛС. Існує три групи захворювань, які приводять до розвитку ХЛС [3].
1. Захворювання, які первинно уражають бронхи і паренхіму легень: хронічний обструктивний бронхіт, емфізема легень; туберкульоз, пневмоконіоз; фіброзуючі альвеоліти; бронхоектатична хвороба; саркоїдоз, ураження легень при дифузних захворюваннях сполучної тканини; полікістоз тощо.
2. Захворювання, які первинно уражають дихальний апарат: кіфосколіоз та інші деформації грудної клітки; стан після торакопластики; плевральний фіброз; хронічна нервово-м'язова слабкість; синдром Піквіка та ін. 3. Захворювання, які первинно уражають судини легень: первинна легенева гіпертензія (ПЛГ); вузликовий періартериїт та інші васкуліти; рецидивна тромбоемболія, амніотична, жирова та інші види повторних емболій гілок легеневої артерії.
Патофізіологічні особливості ЛАГ: вазоконстрикція; трансформація стінки легеневих судин; ендотеліальна дисфункція.
Функціональні механізми: виникнення рефлексу Савіцького-Ейлера-Лільєстранда; збільшення хвилинного об’єму крові в наслідок подразнення хеморецепторів аортальнокаротидної зони; вплив біологічно активних судинозвужуючих речовин (гістаміну, серотоніну, молочної кислоти); недостатня активність вазодилатуючих факторів (азоту оксида, простацикліну);
Функціональні механізми: підвищення внутрішньогрудного тиску та тиску в бронхах; збільшення внутрішньогрудного тиску до 4, 5 – 6 мм рт. ст. (в нормі – 3-4 мм рт. ст.), що сприяє екстракорпоральному депонуванню крові; розвиток бронхо-пульмональних анастомозів та розширення бронхіальних судин; підвищення в’язкості крові; часті загострення бронхопульмональної інфекції.
Анатомічні механізми розвитку легеневої артеріальної гіпертензії Анатомічний механізм розвитку легеневої гіпертензії-це редукція судинного русла легеневої артерії
Геодинаміка при ЛАГ Середній тиск в легеневій артерії (СТЛА) залежить від легеневого судинного опору (ЛСО), хвилинного об’єму (ХО) і тиску в лівому передсерді (Рлп), що витікає із рівняння: СТЛА=ЛСО*ХО +Рлп.
Ендотеліальна дисфункція Зміни функції ендотелію при ЛАГ проявляються порушеннями співвідношення вазоконстрикторних і вазодилятуючих субстанцій. Плазменний рівень NO у пацієнтів з ЛАГ суттєво нижчий, ніж в нормі та значно знижується при підвищенні СТЛА. При розвитку ЛАГ плазменна концентрація ендотеліїну – 1 збільшується і позитивно корелює з показниками СТЛА та негативно – із сатурацією кисню.
ЗМІНИ МІОКАРДУ Патоморфологічні зміни в серці при ХОЗЛ та ЛАГ характеризуються двома типами: При першому типі (гіпертрофічно-гіперпластичному) має місце не стільки дилятація, як гіпертрофія правого шлуночка (ПШ). При другому типі ремодулювання міокарда спостерігається поєднання міогенної дилятації правого шлуночка з його гіпертрофією, рідше – з розширенням порожнини ПШ.
Нові дані в патогенезі синдрому хронічного легеневого серця Основним патогенетичним чинником формування ХЛС є легенева гіпертензія. Як правило, вона зумовлена поєднанням анатомічних змін судинного русла (тромбоз, облітерація, склероз), функціональною вазоконстрикцією (унаслідок гіпоксії, підвищення внутрішньобронхіального тиску) і змінами реологічних властивостей крові.
Певну роль відіграє надходження в кровоносне русло вазопресорних речовин. Так, при тромбоемболії легеневої артерії із зруйнованих тромбоцитів виділяється серотонін, при бронхіальній астмі — деякі види простагландинів. Кінцевим результатом цих процесів є легенева артеріальна гіпертензія і перевантаження тиском і об'ємом правого шлуночка.
Суттєвий вплив на формування легеневого серця має порушення біомеханіки дихання при захворюваннях легень і грудної клітки.
Загострення інфекційного процесу в легенях, порушення кислотно-основного стану, вживання адреноміметичних засобів, безсоння, емоційні та фізичні навантаження є також важливими патогенетичними чинниками в розвитку легеневого серця.
Останнім часом увагу дослідників привертають такі нейрогуморальні механізми формування синдрому ХЛС, як активація симпатичної частини вегетативної нервової системи (САС) та ренін-ангіотензин-альдостеронової системи (РААС) [1], стимуляція в умовах прогресування гіпоксії процесів гіперплазії сполучнотканинних елементів (еластину, колагену) в міокарді та в гладеньких м'язах легеневих судин [10].
Патоморфологія У фазі компенсації хронічне легеневе серце характеризується концентричною гіпертрофією міокарда правого шлуночка з тоногенним його розширенням. При декомпенсації спостерігається ексцентрична гіпертрофія або нерівномірна міогенна дилатація порожнини правого шлуночка гіпертрофованими трабекулами з витонченням його стінки.
Клінічні прояви і діагностика Kлінічна картина ХЛС залежить від стану компенсаторних механізмів, перебігу основного захворювання та ступеня вираженості клінічних проявів, характерних для ЛГ і гіпертрофії правих відділів серця [1–3, 8]. Оскільки ЛГ із змінами в легеневих судинах і ПШ розвиваються раніше, ніж клінічні ознаки захворювання, її раннє виявлення (посилення І тону в проекції трикуспідального клапана) дає можливість діагностувати початкову стадію ХЛС.
Клінічні прояви і діагностика Ознаками ЛГ збільшення зони судинної тупості в ІІ міжребір’ї за рахунок розширення легеневої артерії; акцент ІІ тону та його розщеплення в ІІ міжребір’ї зліва; є також підсилення і розщеплення ІІ тону над ЛА, що з'являється згодом — після появи посиленого І тону в проєкції трикуспідального клапана. поява венозної сітки в ділянці грудини; поява діастолічного шуму над легеневою артерією (симптом Грехема-Стілла).
Клінічні прояви і діагностика Іноді визначається роздвоєння І тону в результаті запізнення трикуспідального компоненту І тону при скороченні правого шлуночка в умовах легеневої гіпертензії. Від здавлення лівого поворотного нерва розширеною легеневою артерією можлива захриплість голосу.
У разі прогресування ЛГ виникають клінічні прояви: прогресуюча задишка, дифузний теплий ціаноз, кровохаркання, гіпертензивні кризи в малому колі кровообігу.
Ознаками гіпертрофії ПШ є короткий, резистентний серцевий поштовх у прекардіальній або надчеревній ділянці, розширення площі абсолютної або відносної тупості серця, підсилення І тону в ділянці мечоподібного відростка.
розширення правої межі серця (не завжди); зміщення лівої границі серця назовні від середньоключичної лінії (за рахунок зміщення збільшеним правим шлуночком); наявність серцевого поштовху вздовж лівої границі серця; пульсація та краща аускультація тонів серця в епігастральній ділянці;
поява систолічного шуму в ділянці мечовидного відрістка, що підсилюється при вдиху (симптом Риверо-Корвалло) – ознака відносної недостатності трьохстулкового клапана.
У стадії декомпенсації виявляються симптоми венозного застою у великому колі кровообігу. До дифузного гіпоксемічного теплого ціанозу приєднується акроціаноз — синьо-багряне забарвлення носа, губ, в основному за рахунок розвитку капілярної сітки, задишка в разі незначного фізичного навантаження, сонливість (унаслідок гіпоксемії й гіперкапнії). Набрякають вени шиї, з'являються набряки на ногах з поступовим розвитком асциту.
При бронхопульмональному легеневому серці хворі скаржаться на тупий або стискаючий біль у ділянці серця без іррадіації. У частини хворих можливі напади так званої легеневої грудної жаби Катча (аngina hypercyanotica), які не залежать від фізичного навантаження, не купуються вживанням нітрогліцерину, усуваються під час вдихання кисню і пов'язані зазвичай з розширенням легеневої артерії та ЛГ.
Синхронні напади бронхоспазму і стенокардії називають ангінальною астмою (астмою навантаження або холодовою астмою), яка усувається вживанням нітратів і антагоністів кальцію (дигідропіридинового ряду). Вона виникає внаслідок рефлекторного спазму коронарних артерій і бронхіол у разі вдихання холодного повітря або гіпервентиляції у відповідь на фізичне навантаження.
При значній декомпенсації серцевої діяльності виникає гепатоюгулярний рефлюкс, унаслідок чого помітно збільшуються розміри печінки (іноді важко визначити у зв'язку з низьким рівнем діафрагми).
Клінічні ознаки декомпенсованого легеневого серця: ортопное; холодний акроціаноз; набухання шийних вен, що не зменшується на вдосі; збільшення печінки; симптом Плеша; при серцевій декомпенсації виникнення набряків, асциту, гідротораксу.
Загальний аналіз крові. Здебільшого у хворих на ХЛС виявляється еритроцитемія, збільшення показника гематокриту і вмісту гемоглобіну в еритроцитах, що є дуже характерним для хронічної артеріальної гіпоксемії. У важких випадках розвивається поліцитемія із значним збільшенням кількості еритроцитів, тромбоцитів і лейкоцитів. Збільшення швидкості осідання еритроцитів часто асоціюється з підвищенням в'язкості крові, що також закономірно спостерігається у більшості хворих з ЛН.
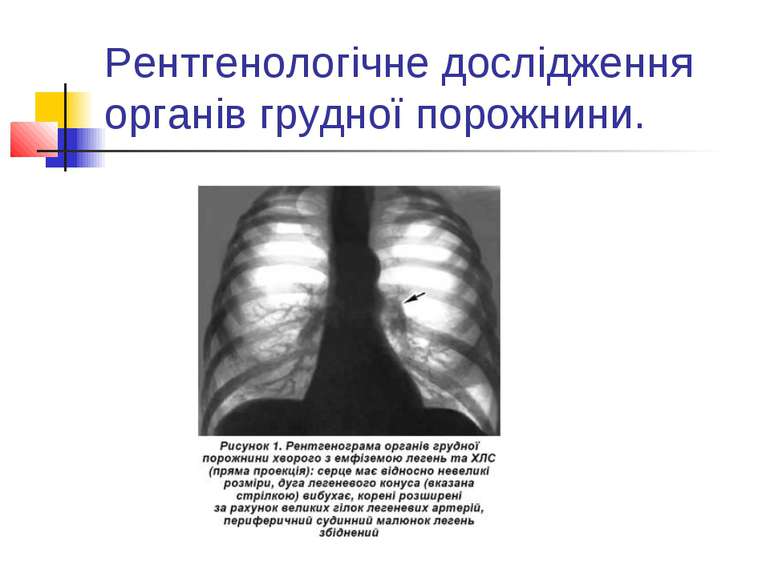
Рентгенографія грудної клітки За допомогою рентгенологічного обстеження визначають: збільшення правого шлуночка та передсердя; вибухання конусу і стовбура легеневої артерії; значне розширення прикореневих судин при збідненому периферійному судинному малюнку;
Рентгенографія грудної клітки “обрубленість” коренів легень; збільшення діаметру низхідної гілки легеневої артерії (в нормі 19 мм); збільшення індексу Мура (в нормі 30+0,8 %); збільшення відстані між гілками легеневої артерії(в нормі 7-10,5 см).
При вираженій емфіземі легень спостерігається мале висяче серце з ознаками гіпертрофії і дилатації правого шлуночка, а також збільшення тіні коренів легень. У прямій і правій косій проекціях визначається випинання конусу легеневої артерії за рахунок згладження талії серця, що імітує «мітральну конфігурацію серця». При цьому тінь стовбура легеневої артерії розширена, збільшується діаметр легеневої артерії, з'являються ознаки ампутації її гілок.
Прогресування захворювання характеризується збільшенням правого шлуночка, який відтісняє лівий шлуночок дозаду. У стадії декомпенсації серце розширене вправо за рахунок розширеного правого передсердя.
Магнітно-резонансна томографія дозволяє визначити об’єм порожнини ПШ та фракцію викиду. Катетерезація правих відділів серця дозволяє аизначити тиск в правих відділах серця, змішану венозну сатурацію кисню, хвилинний об’єм та гостру пробу з вазодилятаторами. Гостра медикаментозна проба з вазодилятаторасми дозволяє визначити групу хворих, у яких тривале лікування оральними вазодилятаторами буде ефективним.
Дослідження функції зовнішнього дихання. Знаходять зміни зумовлені основним захворюванням: при хронічному обструктивному бронхіті ознаки обструктивної дихальної недостатності; при важкій емфіземі легень ознаки рестриктивного типу дихальної недостатності. Тест з 6-хвилинною хотьбою дозволяє визначити ступінь важкості ЛАГ. Тест виконується відповідно до стандартного протоколу (Enright &
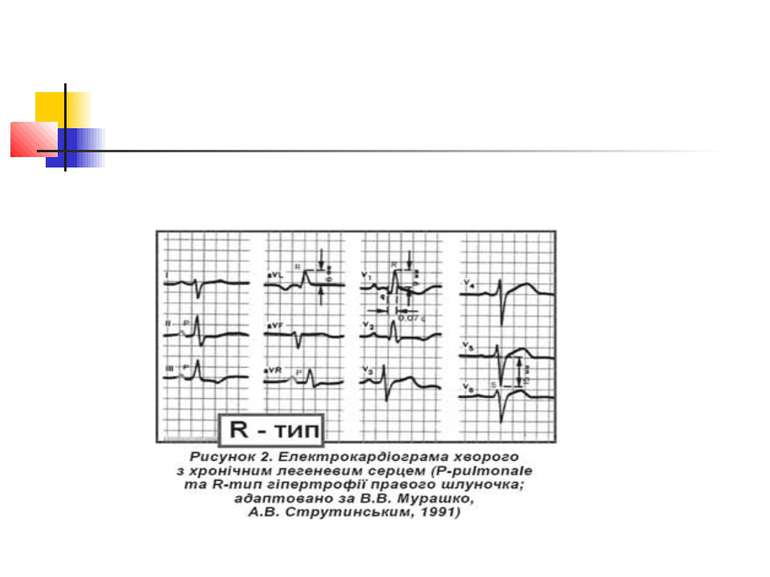
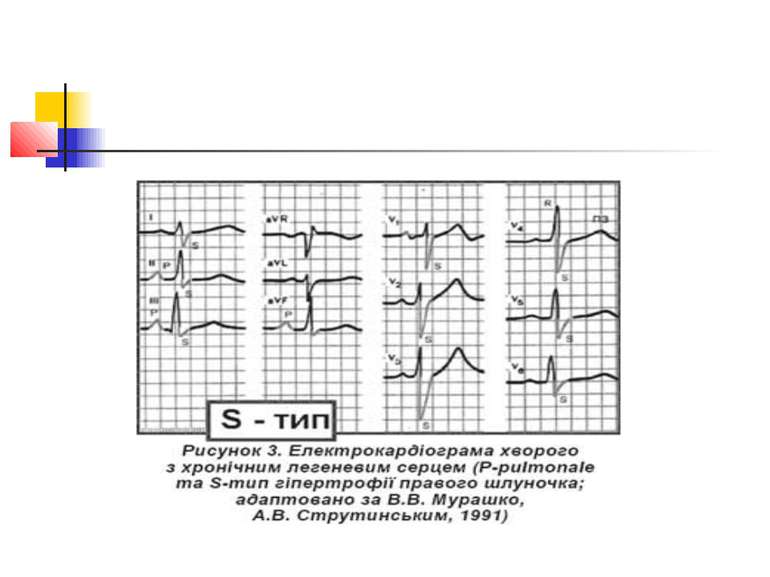
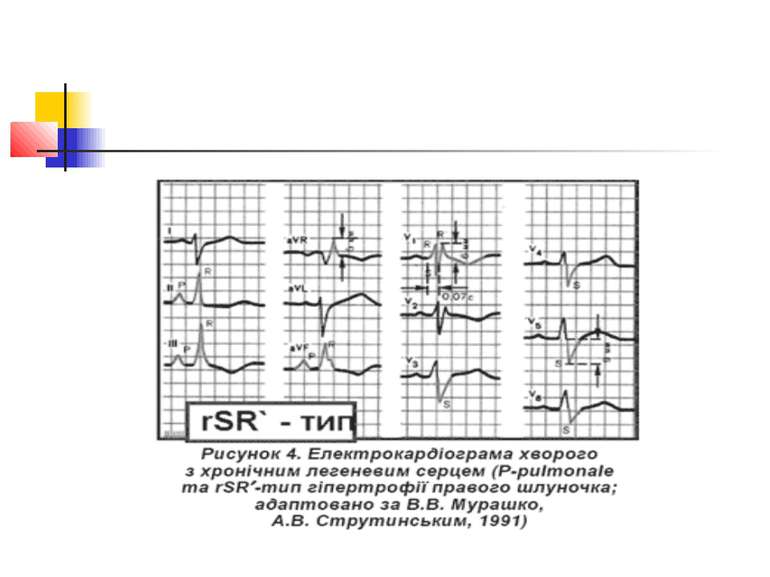
Електрокардіографічне дослідження Електрокардіографічна (ЕКГ) діагностика легеневого серця характеризується ознаками, пов'язаними: 1) з ротацією серця; 2) дифузними змінами в міокарді; 3) формуванням «P-pulmonale»; 4) гіпертрофією правого шлуночка.
Основними прямими ознаками є: висота зубця RV1 ≥ 7 мм; R / S у V1 ≥ 1; RV1 + Sv5 = 10,5 мм; ознаки систолічного перевантаження правого шлуночка у V1 і V2; основними непрямими ознаками є: Rv5 < 5мм; Sv5 < 5 мм; R / S у V5 < 1; негативні зубці Т у V1–V3; SV1 < 2 мм; P-pulmonale.
Поєднання двох прямих ознак вказує на гіпертрофію правого шлуночка; однієї прямої і однієї або двох непрямих — на можливу гіпертрофію правого шлуночка, за однією ознакою діагностика сумнівна.
ЕКГ-ознаками легеневої гіпертензії є такі три критерії: 1) негативний зубець Т у V1– V3; 2) кут відхилення електричної вісі серця > 90°; 3) амплітуда зубця Р у ІІ відведенні > 2 мм.
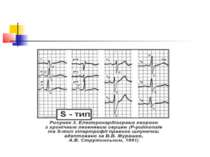
Розрізняють 3 форми гіпертрофії правого шлуночка: R-; S- і rSR'-типи (рис. 2–4). Для R-типу характерне переважання зубця R в правих грудних відведеннях, для S-типу притаманне домінування зубця S в лівих грудних відведеннях. При rSR'-типі на ЕКГ домінують ознаки блокади правої ніжки пучка Гіса.
Найважливішим і раннім критерієм розвитку легеневого серця є підвищення тиску в легеневій артерії.
Крім вимірювання тиску у легеневій артерії інвазивним шляхом (методом катетеризації), існують неінвазивні методи. Так, наявність легеневої гіпертензії можна встановити під час ультразвукового дослідження серцево-судинної системи: (ЕхоКГ та доплерехокардіографічного дослідження). Для цього визначають максимальну швидкість транстрикуспідальної регургітації.
Систолічний тиск у легеневій артерії визначають за величиною систолічного транстрикуспідального градієнта тиску (ΔP, мм рт.ст.) за формулою: СТЛА = ΔP + Тиск в ПП (мм рт.ст.), де ΔP = 4 VТ2, а VТ — максимальна швидкість транстрикуспідальної регургітації в м.с-1. Тиск у ПП вираховують залежно від значення градієнта тиску ΔP та ступеня колабування нижньої порожнистої вени під час вдиху.
Визначити величину тиску в легеневій артерії можна за допомогою “легеневої” реограми за формулою: Систолічний тиск в легеневій артерії = 702*Т-52,8 мм рт.ст. Діастолічний тиск в легеневій артерії=345,4*Т-26,7ммрт.ст. Т-період напруження правого шлуночка.
За величиною СТЛА в легеневій артерії легенева гіпертензія за М.М. Амосовим (1971) має чотири ступені: І ступінь — 25–50 мм рт.ст.; ІІ ступінь — 51–75 мм рт.ст; ІІІ ступінь — 76–110 мм рт.ст.; ІV ступінь — понад 110 мм рт.ст.
ФУНКЦІОНАЛЬНА КЛАСИФІКАЦІЯ ЛАГ КЛАС І - ЛАГ без результуючого обмеження фізичної активності. Звичайна фізична активність не викликає задишки або втоми, болю в грудній клітці або передсинкопального стану; КЛАС ІІ – ЛАГ з наявністю деякого обмеження фізичної активності. Пацієнт відчуває себе комфортно у стані спокою, але звичайна фізична активність викликає неадекватну задишку або втому, біль у грудній клітці або передсинкопальний стан;
ФУНКЦІОНАЛЬНА КЛАСИФІКАЦІЯ ЛАГ КЛАС ІІІ – ЛАГ з наявністю вираженого обмеження фізичної активності. Пацієнт відчуває себе комфортно у стані спокою, але менше ніж звичайна фізична активність викликає неадекватну задишку або втому, біль у грудній клітці або передсинкопальний стан; КЛАС ІV – ЛАГ з неможливістю виконувати будь-яке фізичне навантаження без виникнення симптомів. Пацієнти мають симптоми правошлуночкової недостатності. Задишка, втома або їх поєднання можуть бути присутні навіть у спокої. Дискомфорт підвищується за будь-якої фізичної активності.
КЛІНІЧНА КЛАСИФІКАЦІЯ ЛГ (ВЕНЕЦІЯ, 2003) Легенева артеріальна гіпертензія Ідіопатична Сімейна Асоційована з: колаген-васкулярними захворюваннями вродженими системно-легеневими шунтами* портальною гіпертензією ВІЛ інфекцією медикаментами/токсинами інші (захворювання щитоподібної залози, глікогенози, хвороба Gaucher, вроджена геморагічна телеангіектазія, гемоглобінопатії, мієлопроліферативні захворювання, спленектомія)
КЛІНІЧНА КЛАСИФІКАЦІЯ ЛГ (ВЕНЕЦІЯ, 2003) Асоційована з затрудненням венозного або капілярного току Персистуюча легенева гіпертензія новонароджених
КЛІНІЧНА КЛАСИФІКАЦІЯ ЛГ (ВЕНЕЦІЯ, 2003) Легенева гіпертензія, пов'язана із захворюваннями лівих відділів серця Ураження лівого передсердя та/або лівого шлуночку Ураження аортального та/або мітрального клапану
КЛІНІЧНА КЛАСИФІКАЦІЯ ЛГ (ВЕНЕЦІЯ, 2003) Легенева гіпертензія, зумовлена захворюваннями дихальної системи та/або гіпоксемією Хронічні обструктивні легеневі захворювання Захворювання інтерстицію легенів Розлади дихання під час сну Розлади дихання, пов'язані з альвеолярною гіповентиляцією Хронічне перебування в умовах висотної місцевості Аномалії розвитку
КЛІНІЧНА КЛАСИФІКАЦІЯ ЛГ (ВЕНЕЦІЯ, 2003) Легенева гіпертензія внаслідок хронічних тромботичних та/або емболічних захворювань Тромбоемболічна обструкція проксимальних легеневих артерій Тромбоемболічна обструкція дистальних легеневих артерій Легеневі емболії нетромботичного генезу (пухлина, гельмінти, сторонні тіла) Різне Саркоїдоз, гістіоцитоз, лімфонгіоматоз, компресія легеневих судин (аденопатії, пухлина, фіброзуючий медіастиніт)
Лікування Лікування хворих на ХЛС полягає у спрямуванні зусиль лікаря на якнайшвидше і найефективніше зниження тиску в легеневій артерії для зменшення перед- і післянавантаження на ПШ. Лікування складається з терапії основного захворювання або його загострень, усунення дихальної недостатності і порушень газообміну, дренажу бронхіального дерева, зниження тиску в легеневій артерії і ліквідації ознак серцевої недостатності тощо [1–3, 8].
ЗАГАЛЬНІ ПРИНЦИПИ ЛІКУВАННЯ ЛЕГЕНЕВОЇ АРТЕРІАЛЬНОЇ ГІПЕРТЕНЗІЇ Терапевтичні підходи до лікування поділяються на: вплив на альвеолярну гіпоксію; розширення просвіту легеневих судин; зниження в’язкості крові; стимуляцію інотропної функції серця. Вплив на альвеолярну гіпоксію здійснюється за допомогою тривалої (не менше 15 год на добу) оксигенотерапії. Для розширення судин малого кола кровообігу використовуються переважно антагоністи кальцію (дігідроперідінового та бензодіазепінового ряду).
Антибіотикотерапія є важливою складовою лікування хворих на ХОЗЛ. У періоди загострень ХОЗЛ призначають препарати групи пеніциліну (амоксицилін / клавуланова кислота) і макроліди, що легко проникають в бронхіальний секрет. Найефективнішими є цефалоспорини II-IV поколінь і хіноліни.
Усуненню клінічних проявів дихальної недостатності, покращанню дренажу бронхів і газообміну сприяють бронходилататори — препарати, що відновлюють бронхіальну прохідність. Можливі різні шляхи введення в організм бронходилататорів, серед них найбільш вигідний і безпечний інгаляційний.
Антихолінергічні засоби є препаратами вибору при ХОЗЛ. Тіотропіум бромід — лікарський засіб, який не має спорідненості до М2-холінорецепторів. Це перший і поки що єдиний у світі селективний холіноблокатор пролонгованої дії. Дисоціація його з М1- та М3-холінорецепторами відбувається значно довше, ніж з рецепторами підтипу М2, що й обумовлює збереження бронходилатаційного ефекту протягом 24–32 годин.
В.З. Нетяженко [5] рекомендує при ХОЗЛ призначення інгаляційних глюкокортикостероїдів, які мають виражений протизапальний і протиалергійний впливи на стінку бронха. Глюкокортикостероїди пригнічують проліферацію клітин, вивільнення медіаторів запалення, утворення циркулюючих імунних комплексів, активність фосфоліпази А2, продукцію протизапальних метаболітів арахідонової кислоти (тромбоксану А2, лейкотрієнів), знижують судинну проникність.
Найширше широко застосовують такі інгаляційні глюкокортикостероїди: бекотид, беклофорт, фліксотид по 1-2 інгаляції тричі на добу.
За відсутності або недостатній ефективності інгаляцій призначають пероральні глюкокортикостероїди системної дії (преднізолон по 40–60 мг на добу або полькортолон по 32–40 мг на добу) за редукованою схемою з урахуванням добової циркадності виділення гормонів наднирниковими залозами, чим досягається їх найвища ефективність під час проведення замісної гормонотерапії. У разі недостатньої ефективності антихолінергійних засобів та глюкокортикостероїдів рекомендується застосування β2-агоністів: сальбутамолу, сальметеролу.
Теофілін займає особливе місце серед бронходилататорів. Він безпосередньо діє на гладенькі м'язи бронхів, пригнічує фосфодіестеразу, сприяє накопиченню у гладеньких м'язових клітинах цАМФу, посилює синтез і вивільнення катехоламінів з наднирникових залоз, впливає на внутрішньоклітинний розподіл іонів кальцію, є антагоністом простагландинів. З метилксантинів використовують теофіліни пролонгованої дії, що дозволяє зберегти концентрацію препарату в крові на терапевтичному рівні при дво- чи навіть одноразовому режимі дозування.
Певну роль у звуженні просвіту бронхів відіграє надмірне утворення бронхіального секрету підвищеної в'язкості, що не лише посилює обструкцію дихальних шляхів, а й призводить до утворення мікроателектазів та пригнічення кашльового рефлексу. Тому в комплексне лікування слід включати відхаркувальні засоби. Новим поколінням є мукорегулятори, похідні алкалоїду відіцину: бромгексин (по 8 мг 3–4 рази на добу) і амброксол (по 30 мг 3 рази на добу перорально чи по 15 мг 2 рази на добу, в/м або в/в). Ці препарати збільшують утворення сурфактанту в альвеолах, який підтримує поверхневий натяг альвеол, їх еластичність, а також посилює мукоциліарний кліренс.
Згідно із сучасними уявленнями найбільшу роль у розвитку хронічного легеневого серця відіграють гіпоксія й ацидоз, зумовлені порушенням газообміну. Це є показаннями для проведення інтенсивної оксигенотерапії (до 15 год на добу, особливо в нічні години), що дає змогу зменшити тиск у легеневій артерії. Інгаляції кисню доцільно поєднувати з дихальними аналептиками (кордіамін, етимізол). Доцільно призначити альмітрин по 25 мг 2 рази на добу протягом місяця з 2-місячними перервами, що підвищує насичення артеріальної крові киснем.
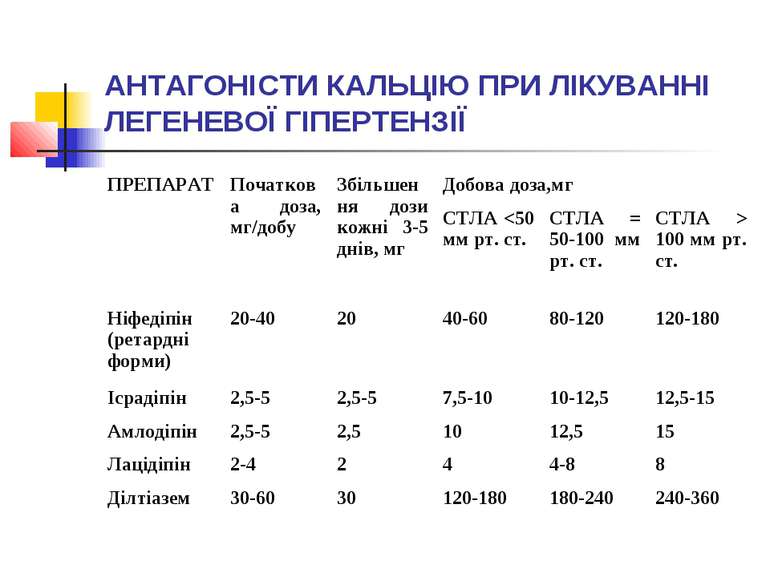
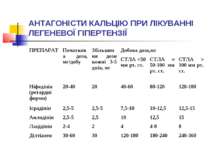
З метою зниження тиску в легеневій артерії призначаються антагоністи кальцію (АК), причому перевагу надають дигідропіридиновим АК ІІІ покоління (амлодипін, лерканідипін). Під час застосування АК хворим з ЛГ необхідно «титрувати» дозу, починаючи з низької і поступово збільшуючи її до максимально переносимої. Так, для пролонгованого ніфедипіну початкова доза становить 20–40 мг на добу, її кожний тиждень підвищують на 20 мг.
Подальше збільшення дози залежить від рівня ЛГ: при СТЛА менше ніж 50 мм рт.ст. максимальні дози ніфедипіну становлять 40–60 мг на добу, амлодипіну, фелодипіну, ісрадипіну чи лерканідипіну — 7,5–10 мг на добу, дилтіазему — 120–180 мг на добу; при рівні СТЛА від 50 до 100 мм рт. ст. — відповідно 80–120 мг на добу, 10–12,5 мг на добу і 180–240 мг на добу; при СТЛА понад 100 мм рт.ст. — 120–180 мг на добу, 12,5–15 мг на добу і 240–360 мг на добу відповідно.
При поєднанні ЛГ з легенево-серцевою недостатністю широко застосовуються нітропрепарати та сидноніміни.
Вплив цих засобів на легеневу гемодинаміку схожий з ефектами нітрогліцерину: зниження тиску в легеневій артерії, розширення периферійних венозних судин, гемодинамічне розвантаження правих відділів серця. До переваг нітропрепаратів належить посилення коронарного кровотоку.
ВАЗОДИЛАТАТОРИ «Віагра®» насьогодні є одним з найефективніших вазодилататорів, що використовуються в лікуванні ЛГ
Силденафіл (Viagra®) — ц-ГМФ специфічний інгібітор фосфодіестерази типу 5 (англ. cGMP PDE5-inhibitor).[21] Був остаточно апробований у 2005 році. Застосування Сілденафілу в поєднанні з довгостроковою терапією з простациклінами у пацієнтів з вираженою ЛГ забезпечує тривалу клінічну стабілізацію стану хворого та покращення його дієздатності, що підтверджується ехокардіографічними показниками функції правого шлуночка. Ефект достовірно триває більше 24 місяців.[22] Інший інгібітор ФДЕ-5 — Тадалафіл знаходиться у III фазі клінічних випробувань.
Потужні вазодилатувальні властивості мають простагландини (Е1, простациклін). Нині їх також застосовують з метою зниження тиску в легеневій артерії. Водночас простациклін впливає на систему згортання крові шляхом пригнічення дезагрегації тромбоцитів.
Призначаються хворим із зниженням серцевого індексу < 2,1 л/хв/м2 або із сатурацією венозної крові < 63% та/або тиском в правому передсерді > 10 мм рт. ст. Лікування простогландинами не поєднується з антагоністами кальцію. Використовується епопростенол (в/в), терпростиніл (в/в, п/ш), ілопрост (в/в, інгаляційно) та берапрост (per os). Препарати не зареєстровані в Україні
Його застосовують у дозі 2–24 мг/кг/хв з можливим підвищенням у процесі лікування до максимально переносимої. З цією ж метою в Україні застосовують також препарат простагландин Е1 (вазопростан, алпростадил). Його призначають шляхом внутрішньовенної інфузії для підтримання вазодилатації. Доза простагландину Е1 коливається від 5 до 100 нг/кг/хв. Початкова доза зазвичай становить 5–10 нг/кг/хв. В подальшому її збільшують до 30 нг/кг/хв.
Простациклін (англ. Prostacyclin) також відомий як Простагландин I2 (англ. Prostaglandin I2 - PGI2) та його синтетичний аналог Ілопрост (Ilomedin®, Ventavis®).
Має вазодилатуючу та антипроліферативну дію. Викликає внутрішньоклітинне підвищення цАМФ, призводячи тим самим до зниження легеневого судинного опору за рахунок вазодилатації, та зниження проліферації гладких м'язових клітин легеневих судин. Є потужним інгібітором тромбоксану, за рахунок чого зменшує його вазоконстриктивну, мітогенну та прокоагулянтну активність.
Інгаляційний NO використовується у перед- та післяопераційній терапії при операціях на легенях і серці: у дітей після хірургічної корекції вродженої вади серця й у дорослих після трасплантації комплексу серце-легені. У цих випадках використання NO дозволяє проводити корекцію гемодинамічного стану пацієнта, знижуючи легеневий судинний опір. [20]
Антагоністи рецепторів ендотеліїну-1 Антагоністи рецепторів ендотеліїну-1: бозентан призначається по 62,5 мг двічі на день перших 4 тижні, в подальшому – по 125 мг двічі на день. Тривалість лікування 12 тижнів; ситаксентан використовуються по 100 – 300 мг двічі на день протягом 12 тижнів. Препарати не зареєстровані в Україні. Дигоксин збільшує інотропну функцію серця, зменшує вираженість клінічної симптоматики та частоту госпіталізації, однак його ефективність при тривалому використанні не доказана.
Бозентан (Tracleer®) — пероральний антагоніст рецепторів ендотеліну (ETA and ETB). Був апробований у 2001 році. Застосування Бозентану є терапією вибору у пацієнтів з Ідіопатичною ЛГ класу NYHA III. Також виявляє свою ефективність у пацієнтів з ЛГ, що асоційована з вродженими вадами серця, класу NYHA III—IV .[23],[24]
Сітаксентан (Thelin®) — селективний антагоніст рецепторів ендотеліну (ETA), був апробований для застосування у Канаді та Європейському Союзі.[25] Він знаходиться також на фінальній стадії клінічних випробувань у США.
При ХЛС широко застосовуються низькі дози інгібіторів ангіотензинперетворювального ферменту (каптоприл, еналаприл, лізиноприл), котрі зумовлюють не лише дилатацію артеріол і вен, але й легеневої артерії. Каптоприл застосовують у дозах 25–150 мг на добу, а еналаприл чи лізиноприл — 5–40 мг на добу залежно від ступеня ЛГ.
При ЛН, незважаючи на нормальний серцевий викид, зменшується нирковий кровотік, що призводить до посиленого утворення альдостерону; це обгрунтовує доцільність застосування сечогінних засобів, які зменшують об'єм перед і постнавантаження на серце, а також ступінь вираженості набрякового синдрому. Під час проведення сечогінної терапії не слід збільшувати діурез понад 2–2,5 л. Призначення фуросеміду зменшує ЛГ, але в разі значної декомпенсації його слід використовувати обережно через можливе зниження серцевого викиду і розширення периферійних судин. При ХЛС фуросемід застосовують у дозах 20–80–120 мг на добу, в/в чи per os.
Заслуговує на увагу новий потужний петлевий діуретик торасемід (по 10–40 мг на добу, в/в чи per os), який має більш виражений, ніж у фуросеміду діуретичний ефект і має 90 % біодоступності. Верошпірон (50 мг в 2 прийоми) збільшує альвеолярну дифузію, зменшує виведення іонів калію і посилює діуретичний ефект. Проте застосування салуретиків може підвищувати в'язкість крові, тому перспективним є застосування гіперосмолярних розчинів шестиатомних спиртів на основі сорбітолу (сорбілакт і реосорбілакт), які спричинюють активну дегідратацію тканин за рахунок підвищення осмотичного тиску крові й одночасно покращують її реологічні властивості.
За останні 10–15 років змінились погляди на застосування серцевих глікозидів при серцевій недостатності. Для запобігання серцевої недостатності їх не використовують, хіба у разі хронічної недостатності кровообігу ХНК ІІ-ІІІ стадій з лівошлуночковою недостатністю або фібриляцією передсердь. Поряд з цим вважають, що дигоксин можна використовувати і без ознак дисфункції лівого шлуночка, поскільки він посилює скоротливість діафрагми, не впливаючи на інші групи поперечнопосмугастих м'язів.
При аритміях, що виникають на тлі хронічного легеневого серця, використання антиаритмічних препаратів обмежене через їх вплив на скоротливість міокарда. Найдоцільнішим при синусовій тахікардії є призначення івабрадину, спочатку в дозі 5 мг 2 рази на добу, з поступовим збільшенням дози до 7,5 мг 2 рази на добу.
У дослідженнях Я.А. Дзюблик і соавт. [4] показано, що у хворих на ХОЗЛ, особливо віком понад 60 років, спостерігаються порушення показників плазмової ланки гемостазу, які свідчать про наявність синдрому гіперкоагуляції. Саме з огляду на такі особливості гемостазу при ХОЗЛ в комплексній терапії ХЛС широко застосовують антикоагулянти і дезагреганти.
За наявності високого ризику тромбоемболічних ускладнень доцільні антикоагулянти — низькі дози гепарину чи низькомолекулярних гепаринів (надропарину, еноксапарину), які зменшують частоту тромбоемболічних ускладнень, покращують вентиляційно-перфузійне співвідношення в легенях. З дезагрегантів найширше використовують аспірин по 75–150 мг на добу, тиклопідин по 250 мг 2 рази на добу або клопідогрель по 75 мг 1 раз на добу.
Антикоагуляційна терапія може знизити ризик тромбозу та розвитку захворювання у пацієнтів з ЛГ внаслідок хронічних тромботичних та/або емболічних захворювань, асоційованої з дефектами фібринолізу та порушеннями гемостазу. [17] Варфарін (Coumadin®) ч
Актуальною також є кардіопротекторна терапія в умовах гіпоксії та ішемії міокарда шляхом застосування інгібіторів 3-кетоацилтиполази (триметазидин по 35 мг 2 р/добу, per os) та інгібіторів ліпооксигенази (1-ша–3-тя доба госпіталізації у дозі 500 мг 10 % розчину препарату, розчиненого в 50 мл ізотонічного розчину натрію хлориду, упродовж 30–45 хв, потім інфузію повторюють через 12 год в такій самій дозі; 4-та та 5-та доба — одноразово в дозі 250 мг).
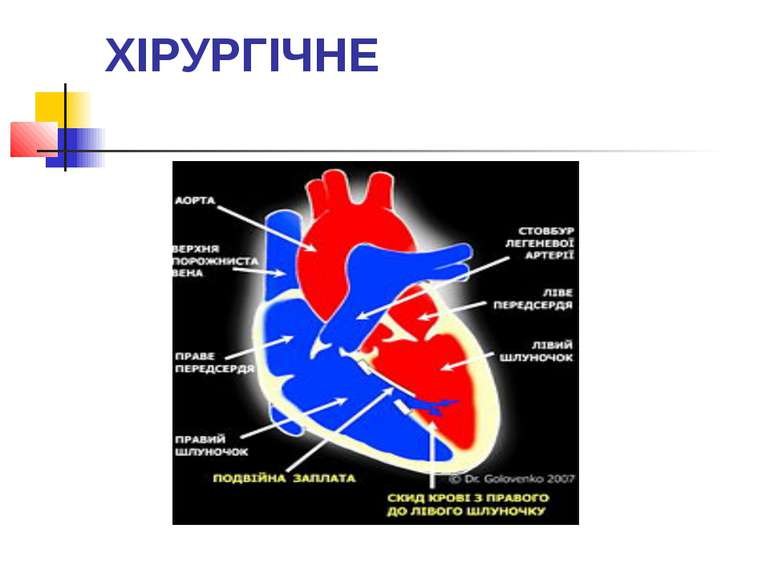
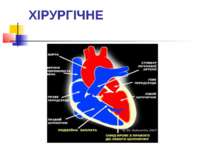
ХІРУРГІЧНЕ Подвійна заплата при закритті ВСД виконує простий фізіологічний механізм для розвантаження правого шлуночку під час виникнення легеневих гіпертензійних кризів. При цьому кров у правому шлуночку за рахунок підвищеного тиску в правих відділах серця потрапляє до лівого шлуночку через подвійну заплату, що в цей момент відкривається.
Передсердна атріосептостомія. Операція показана пацієнтам з ЛГ у випадках рефрактерності до терапії простагландинами, а також, частково, у випадках частих синкопе. Вона не показана при критичному стані пацієнта, зумовленого правошлуночковою недостатністю, або у пацієнтів зі зниженими показниками роботи лівого шлуночку. [26]
Легенева тромбоендартеректомія Показана пацієнтам з ЛГ внаслідок тромбоемболічної обструкції проксимальних легеневих артерій.
Імплантація лівошлуночкового допоміжного пристрою. Дозволяє підготовити пацієнтів з легеневою гіпертензією, яка рефрактерна до медикаментозної терапії, до трансплантації серця
При хірургічній корекції вроджених вад серця, що супроводжуються легеневою гіпертензією застосовують наступні оперативні втручання :
Закриття ВСД подвійною заплатою Операція використовується у пацієнтів з ВСД, що супроводжуються гіпертензією в легеневій артерії. На даний час найбільша кількість таких операцій в світі виконана в Національному Інституті Серцево-судинної хірургії ім. М. М. Амосова, Україна та в Клініці Університету Теннессі, США.[30],[31]
Звуження легеневої артерії Перший етап при двоетапній корекції вродженої вади серця, що супроводжується гіпертензією в легеневій артерії. Вважається, що завдяки цій операції фактично відбувається ремоделювання судинного русла легенів і стає можливим проведення другого етапу — радикальної корекції (закриття ВСД).
Висновки 1. У формуванні синдрому ХЛС беруть участь різноманітні гемодинамічні, нейрогуморальні, імунні, ендотеліальні, метаболічні, фізіологічні та анатомічні механізми. Необхідними є розробка та впровадження диференційованих підходів до ефективної медикаментозної корекції патогенетичних ланок розвитку і перебігу ХЛС на основі результатів багатоцентрових досліджень.
Висновки 2. Синдром ХЛС є водночас пульмонологічною, кардіологічною, загальнотерапевтичною проблемою і навіть судинно-хірургічною проблемою. У кожному окремому випадку при декомпенсації ХЛС лікар-інтерніст має вирішувати питання щодо надання невідкладної допомоги і подальшого «постдекомпенсаційного» лікування. Останнє, очевидно, має проводитись у стаціонарах загальнотерапевтичного профілю, а в період декомпенсації хворий повинен лікуватись у відділеннях інтенсивної терапії, де є умови для цілодобової оксигенотерапії (через маску, носові катетери тощо).
Висновки 3. В Україні необхідний консенсус з питань термінології і класифікації, клінічних проявів, діагностики та лікування ХЛС за участю пульмонологів, кардіологів, лікарів загальної практики / сімейної медицини, судинних хірургів та реаніматологів.
Литература 1. Амосова Е.Н., Коноплева Л.Ф. Хроническое легочное сердце: сущность понятия и гетерогенность патогенеза, морфофункциональное состояние сердца и сосудов, клинического течения различных форм // Укр. пульм. журн. — 2002. — № 1. — С. 29-33. 2. Бережницкий М.Н., Киселева А.Ф., Бигарь В.П. Хроническое легочное сердце. — К.: Здоров'я, 1991. — 152 с. 3. Гаврисюк В.К. Современные классификационные, диагностические и лечебные подходы // Мистецтво лікування. — 2004. — № 1. — С. 42-50. 4. Дзюблик Я.А., Морозова Н.А., Яхница Т.В., Мор ская Н.Д., Дяченко А.П. Особенности нарушений системы гемостаза у больных пожилого возраста, страдающих хроническими воспалительными заболеваниями легких // Укр. пульм. журн. — 2002. — № 4. — С. 58-61. 5. Нетяженко В.З. Лікування бронхіальної астми в практиці лікаря-інтерніста // Укр. пульм. журн. — 2000. — № 2, додаток. — С. 27-28. 6. Перцева Т.О., Конопкіна. Л.І., Мироненко О.В. Досвід застосування Спіриви (тіотропію броміду) у хворих на хронічне обструктивне захворювання легень // Укр. пульм. журн. — 2005. — № 3. — С. 32-34. 7. Середюк В.Н. Оцінка діастолічної і систолічної функції міокарда правого шлуночка у хворих на хронічне легеневе серце в стадії декомпенсації // Архів клін. мед. — 2005. — № 1. — С. 58-62. 8. Середюк Н.М., Нейко Є.М., Вакалюк І.П. та ін. Госпітальна терапія / За ред. академіка України Є.М. Нейка — К.: Здоров'я, 2003. — С. 644-660. 9. Фещенко Ю.І. Хронічні обструктивні захворювання легень: проблемні питання // Нова медицина. — 2005. — № 1 (18). — С. 18-20. 10. Auger W. Pulmonary hypertension and cor pulmonale // Cur. Opin. in Pulmonary Medicine. — 1995. — Vol. 1. — P. 303-312.
В лекції використані матеріали статтіН.М. СЕРЕДЮК, д.м.н., професор, В.Н. СЕРЕДЮК, к.м.н., доцент; Івано-Франківський державний медичний університет, кафедра госпітальної терапії № 1 з курсом клінічної імунології Синдром хронічного легеневого серця — це кардіологічна, пульмонологічна проблема чи проблема лікаря-інтерніста? Н.М. СЕРЕДЮК, д.м.н., професо
Схожі презентації
Категорії













































































![В.З. Нетяженко [5] рекомендує при ХОЗЛ призначення інгаляційних глюкокортикос... В.З. Нетяженко [5] рекомендує при ХОЗЛ призначення інгаляційних глюкокортикос...](https://svitppt.com.ua/images/8/7560/770/img80.jpg)

























![У дослідженнях Я.А. Дзюблик і соавт. [4] показано, що у хворих на ХОЗЛ, особл... У дослідженнях Я.А. Дзюблик і соавт. [4] показано, що у хворих на ХОЗЛ, особл...](https://svitppt.com.ua/images/8/7560/770/img107.jpg)







![Трансплантація легенів[28], Трансплантація комплексу серце-легені Трансплантація легенів[28], Трансплантація комплексу серце-легені](https://svitppt.com.ua/images/8/7560/770/img116.jpg)























































































![В.З. Нетяженко [5] рекомендує при ХОЗЛ призначення інгаляційних глюкокортикос... В.З. Нетяженко [5] рекомендує при ХОЗЛ призначення інгаляційних глюкокортикос...](https://svitppt.com.ua/images/8/7560/210/img80.jpg)

























![У дослідженнях Я.А. Дзюблик і соавт. [4] показано, що у хворих на ХОЗЛ, особл... У дослідженнях Я.А. Дзюблик і соавт. [4] показано, що у хворих на ХОЗЛ, особл...](https://svitppt.com.ua/images/8/7560/210/img107.jpg)







![Трансплантація легенів[28], Трансплантація комплексу серце-легені Трансплантація легенів[28], Трансплантація комплексу серце-легені](https://svitppt.com.ua/images/8/7560/210/img116.jpg)































