Презентація на тему:
Узагальнення й систематизація знань з теми «Розчини»
Завантажити презентацію
Узагальнення й систематизація знань з теми «Розчини»
Завантажити презентаціюПрезентація по слайдам:
Лот 1 Однорідна система, що складається з двох і більше компонентів. Електроліт, у процесі дисоціації якого в розчині утворюється один вид катіонів — H+. Розчин, у якому кількість речовини за певної температури більше не розчиняється. Процес розпаду електроліту на йони в розчині або розплаві. Реакції взаємодії йонів у розчинах електролітів. Процес взаємодії молекул розчиненої речовини з молекулами розчинника.
Речовини, до складу яких входять молекули води, з’єднані з йонами металів. Електроліт, у результаті дисоціації якого в розчині утворюється один вид йонів — гідроксигрупи. Дисперсна система, у якій дрібні часточки твердої речовини рівномірно розподілені в рідині. Дисоціація слабких електролітів у розчині відбувається… Відношення числа молекул, що продисоціювали, до загального числа молекул розчиненої речовини. Дисперсна система, у якій часточки розчиненої речовини не помітні неозброєним оком, але які можна побачити з допомогою приладів.
Процес розподілу молекул розчиненої речовини серед молекул розчинника. Реакція взаємодії між розчинами кислот і основ. Розчинник — це компонент розчину, що перебуває… Розчин з малим умістом розчиненої речовини. Дисперсна система, у якій часточки рідини рівномірно розподілені в рідкому розчиннику. Розчинність твердої речовини у воді підвищується… Електроліти, у процесі дисоціації яких утворюються катіони металів і аніони кислотних залишків. Дисперсні системи, у яких газоподібна речовина рівномірно розподілена в рідині.
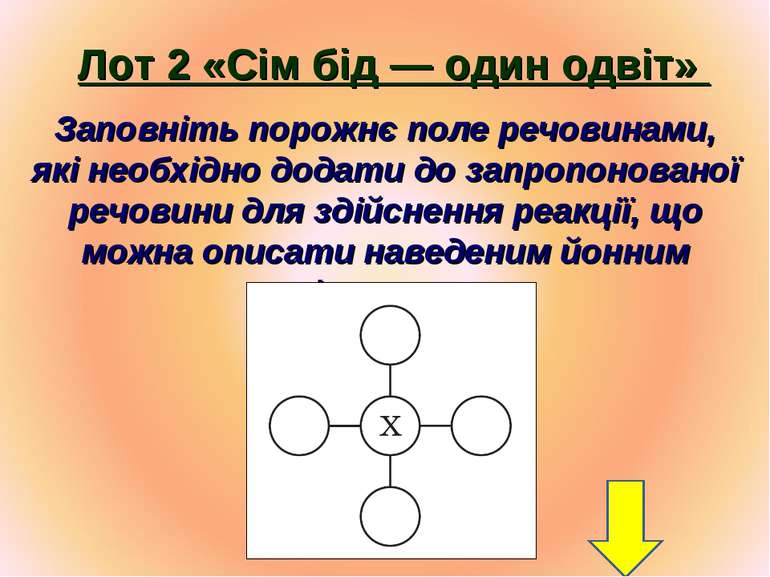
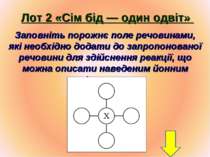
Лот 2 «Сім бід — один одвіт» Заповніть порожнє поле речовинами, які необхідно додати до запропонованої речовини для здійснення реакції, що можна описати наведеним йонним рівнянням.
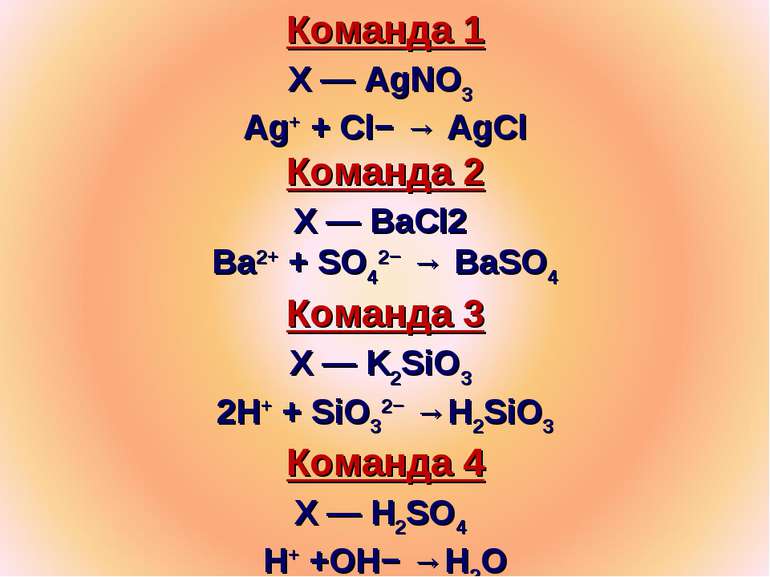
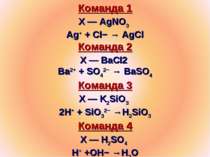
Команда 1 Х — AgNO3 Ag+ + Cl− → AgCl Команда 2 Х — BaCl2 Ba2+ + SO42− → BaSO4 Команда 3 Х — K2SiO3 2H+ + SiO32− →H2SiO3 Команда 4 Х — H2SO4 H+ +OH− →H2O
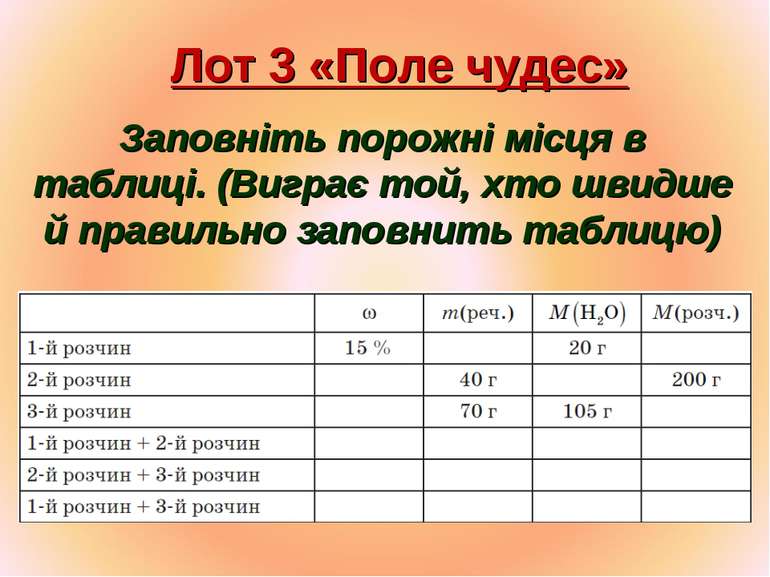
Лот 3 «Поле чудес» Заповніть порожні місця в таблиці. (Виграє той, хто швидше й правильно заповнить таблицю)
Лот 4 «Один за всіх» Розв’яжіть задачі На розчин натрій гідроксиду об’ємом 30 мл (ρ = 1,17 г/мл) з масовою часткою речовини 39,9 % подіяли надлишком розчину купрум (ІІ) хлориду. Обчисліть масу осаду. На розчин нітратної кислоти об’ємом 40 мл (ρ = 1,12 г/мл) з масовою часткою кислоти 56,25 % подіяли надлишком розчину барій гідроксиду. Обчисліть масу солі.
Приготували насичений розчин калій нітрату масою 420 г (t = 60 °C). Обчисліть масу солі, що випаде в осад, якщо розчин остудити до 40 °С. Розчинність калій нітрату за температури 60°C — 110 г, за 40 °C — 60 г. Насичений за температури 100 °C розчин калій сульфату має масу 300 г. Обчисліть масу солі, що випаде в осад унаслідок охолодження до 45 °C. Розчинність калій сульфату за температури 100°C — 25 г, за 45 °C — 20 г.
Лот 5 «Гонка за лідером» Напишіть рівняння в йонній формі Команда 1 CuCl2 + NaOH → HCl + Na2 SO3 → K2 SO4 + NaOH → NaOH + H2 SO4 → Команда 2 AgNO3 + CaCl2 → CaCl2 + KNO3 → HCl +Ca(OH)2 → K2 CO3 + H2 SO4 → Команда 3 Al2(SO4)3 + KOH → KOH + HNO3 → NaCl + K2 SO4 → Na2 S + H2SO4 → Команда 4 ZnSO4 + Na2S → KOH + H3 PO4 → Na2 SO4 + KOH → Na2 CO3 + HCl →
Індивідуальний рейтинг кожного учня переводиться в оцінки за схемою: 1–4 Au — 3 бали 5–7 Au — 4 бали 8–10 Au — 5 балів 11–12 Au — 6 балів 13–14 Au — 7 балів 15–16 Au — 8 балів 17–18 Au — 9 балів 19 Au — 10 балів Понад 19 Au — 11–12 балів
Домашнє завдання Повторити матеріал теми, підготуватися до тематичного оцінювання з теми «Розчини».
Схожі презентації
Категорії