Презентація на тему:
Поняття про оксиди
Завантажити презентацію
Поняття про оксиди
Завантажити презентаціюПрезентація по слайдам:
Познайомтесь, ми — оксиди, Складні, важливі речовини. Без оксидів вам не жити, Вам без нас води не пити, По пісочку не ходити І багаття не палити. Родичів багато маєм, Радо ми їх всіх вітаєм, Ой, чи живі, чи здорові, Родичі всі оксидові? Адже знаєш, що кислоти — Оксидові дяді й тьоті, Вони з оксидів утворились, Як водиці ті напились. І основи теж нам рідні, Всі нащадки то оксидні. Солі — внуки оксидові, Речовини вам знайомі. Пилипенко Леся Анатоліївна, вчитель хімії та інформатики Хлистунівського НВК Городищенської районної ради Черкаської області
Оксиди - складні речовини (бінарні сполуки) до складу яких обов’язково входить Оксиген з валентністю II
II Загальна формула оксидів: ЕхОу х і у змінюються в залежності від валентності елемента. Наприклад: Валентність Формула оксиду Е – І Е2О Е – ІІ ЕО Е – ІІІ Е2О3 Е – ІV ЕО2 Е – V Е2О5 Е – VІ ЕО3 Е - VІІ Е2О7
Наприклад: H2O – гідроген оксид Na2O - натрій оксид MgO – магній оксид Назви оксидів назва хімічного елемента оксид валентність елемента (якщо змінна, вказується римськими цифрами) + +
Якщо елемент виявляє змінні валентності, то в назві оксиду після назви елемента вказують значення його валентності римською цифрою в дужках Наприклад: II II СО – карбон (ІІ) оксид IV II СО2 – карбон (ІV) оксид I II Сu2O – купрум (I) оксид V II P2O5 – фосфор (V) оксид
1. Добування з простих речовин (взаємодія простих речовин з киснем) S + O2 = SO2 2Mg +O2 = 2MgO
2. Добування із складних речовин (реакції горіння) СH4 + 2O2 = CO2 + 2H2O 4FeS + 7O2 = 2Fe2O3 + 4SO2
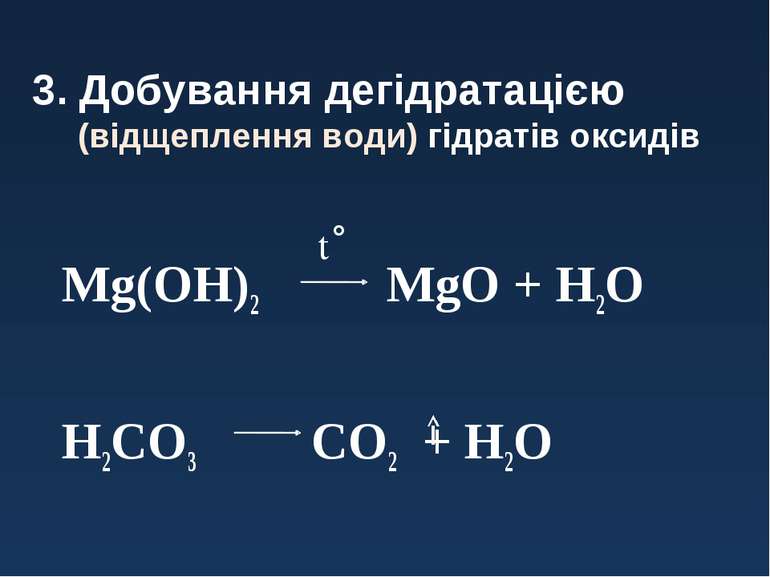
3. Добування дегідратацією (відщеплення води) гідратів оксидів Mg(OH)2 MgO + H2O H2CO3 CO2 + H2O t˚
4. Добування термічним розкладом солей CaCO3 CaO + CO2 такі реакції протікають за умови, що один з продуктів реакції є летким t˚
Хімічні властивості оксидів Na2O + H2O = 2NaOH MgO + SO2 = MgSO3 CaO + 2HCl = CaCl2 +H2O SO2 + Mg (OH)2 = MgSO3 + H2O SO2 + H2O = H2SO3
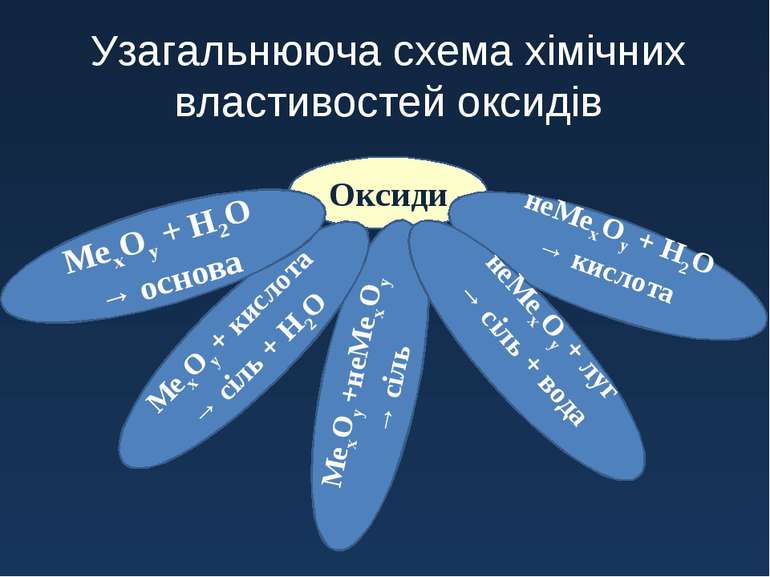
Оксиди МехОу +неМехОу → сіль МехОу + кислота → сіль + Н2О МехОу + Н2О → основа неМехОу + Н2О → кислота неМехОу + луг → сіль + вода Узагальнююча схема хімічних властивостей оксидів
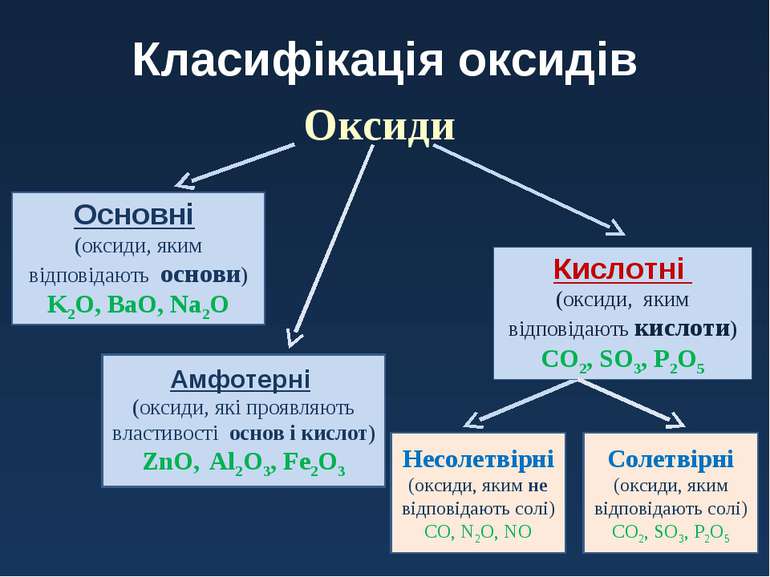
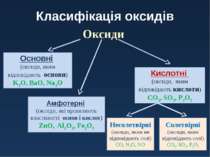
Класифікація оксидів Оксиди Кислотні (оксиди, яким відповідають кислоти) CO2, SO3, P2O5 Основні (оксиди, яким відповідають основи) K2O, BaO, Na2O Несолетвірні (оксиди, яким не відповідають солі) CO, N2O, NO Солетвірні (оксиди, яким відповідають солі) CO2, SO3, P2O5 Амфотерні (оксиди, які проявляють властивості основ і кислот) ZnO, Al2O3, Fe2O3
Завдання учням З наведених формул оксидів випишіть в окремі стовпчики основні, кислотні і несолетвірні оксиди: Na2O, P2O5, CO, BaO, SO3, CrO, SiO2, N2O, FeO, CaO Заповніть прогалини в наведених схемах реакцій: А) K2O + H2O → … Б) Fe(OH)2 → H2O + … В) … + H2O → Zn(OH)2 Г) SO2 + H2O → … Д) … → CO=2 + H2O Е) H2SiO3 → SiO2 + H2O
Схожі презентації
Категорії