Презентація на тему:
Поняття про кислоти
Завантажити презентацію
Поняття про кислоти
Завантажити презентаціюПрезентація по слайдам:
Тема уроку: «КИСЛОТИ» 8 клас Учитель хімії Верховцевського НВК Кукса Наталія Миколаївна Україна. Дніпропетровська область
Мета уроку: Знати: визначення,склад, класифікацію,формули, номенклатуру ,фізичні та хімічні властивості кислот Вміти: Визначати кислоти, складати їх формули Записувати рівняння хімічних властивостей Развивати: Увагу,пам’ять,абстрактне мислення
Цілі: Склад,класифікація кислот Номенклатура,формули Фізичні властивості Хімічні властивості Добування Застосування Дія на організм.Поводження з кислотами.
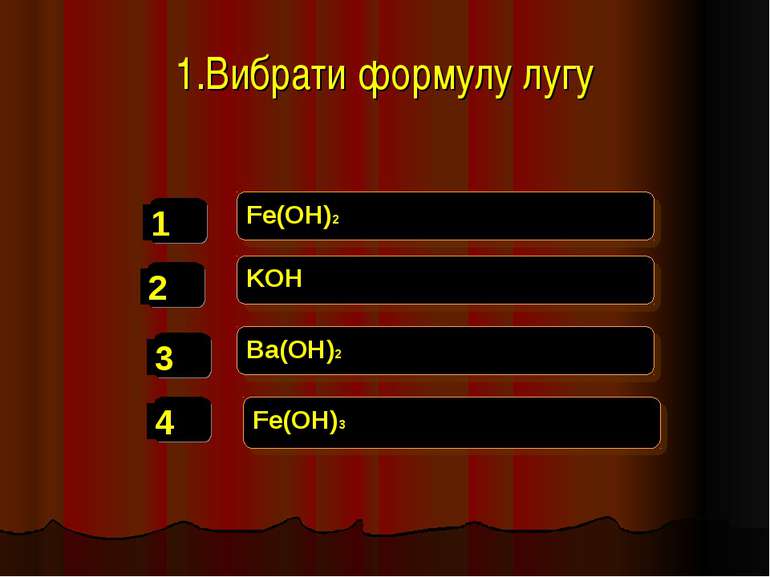
8.Де застосовується Ca(OH)2 ? Як миючий засіб В будівництві В металургії У виробництві ліків
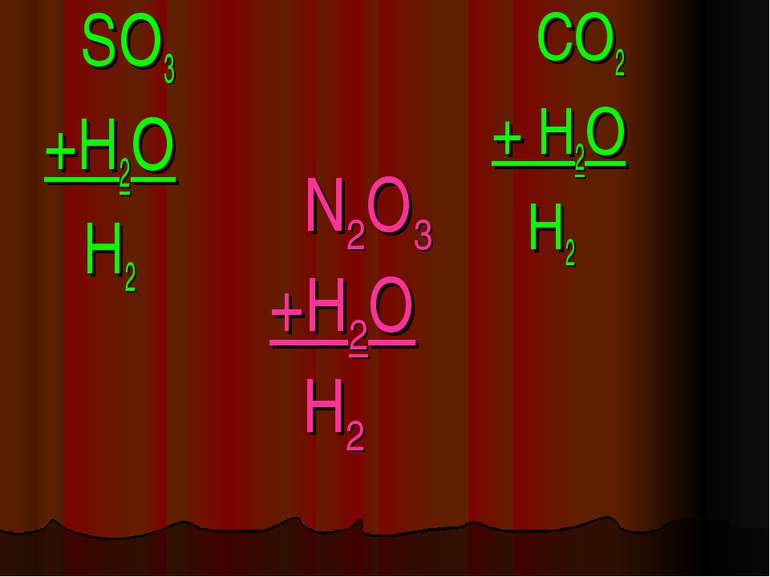
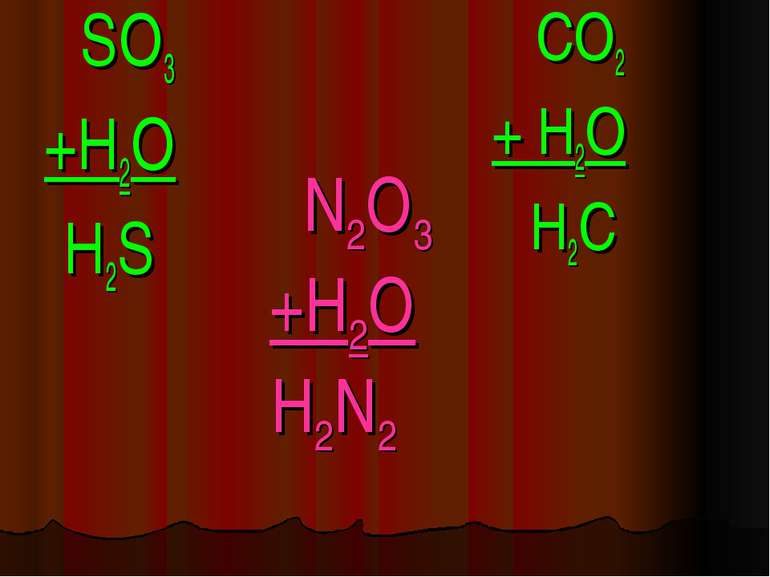
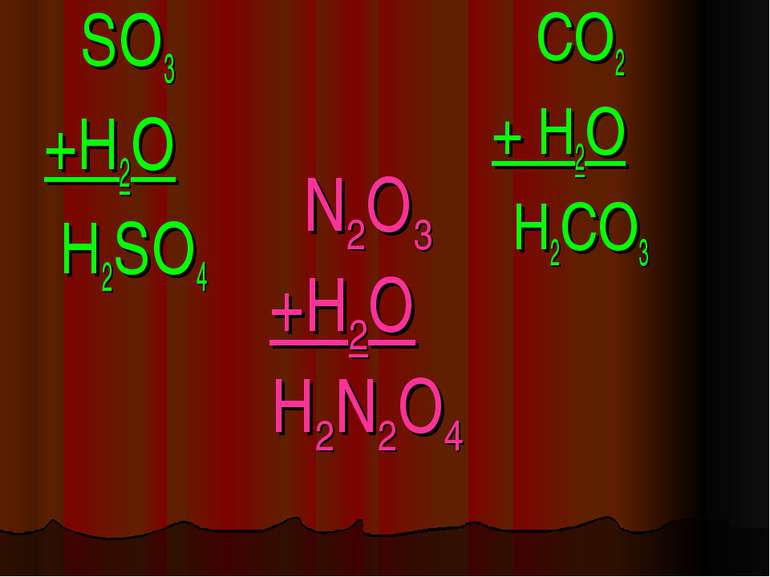
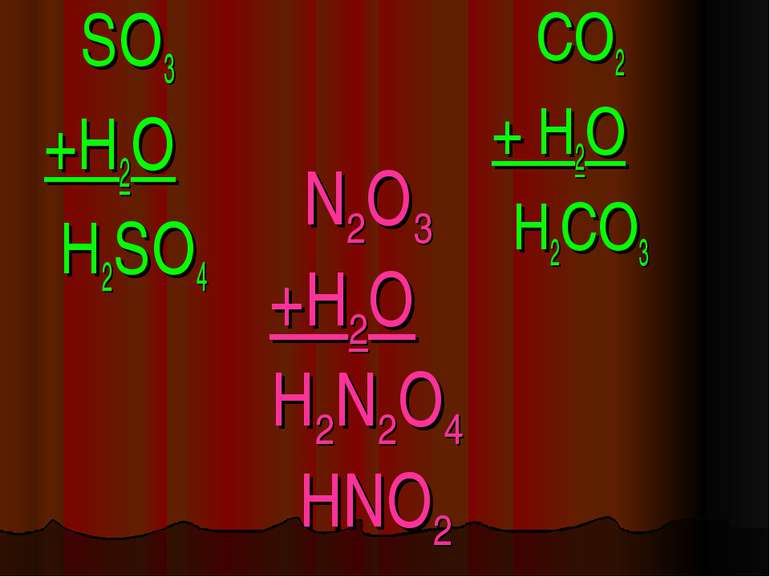
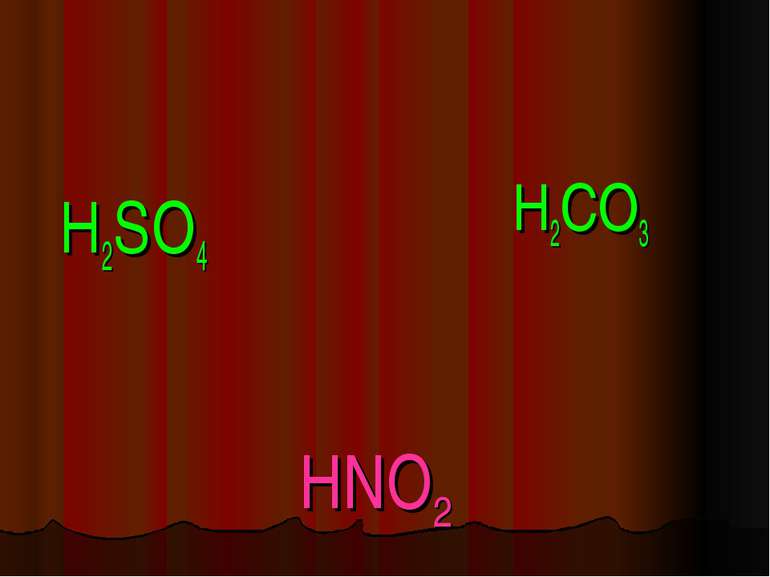
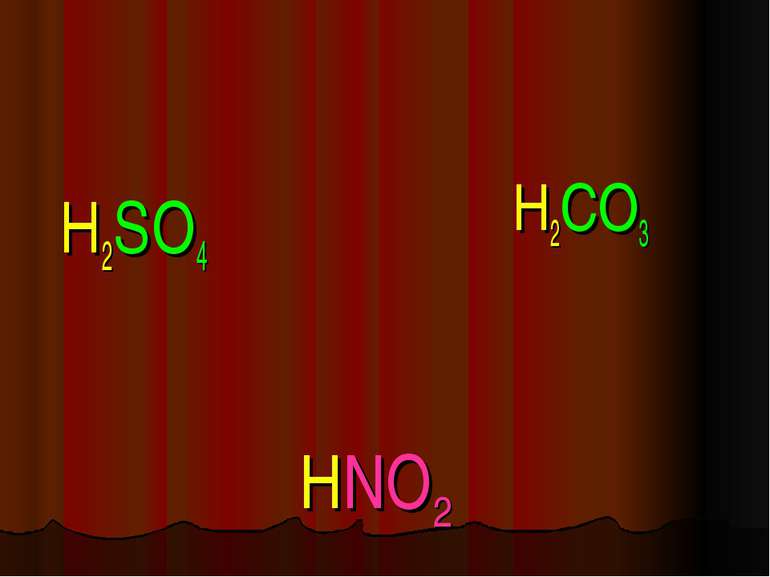
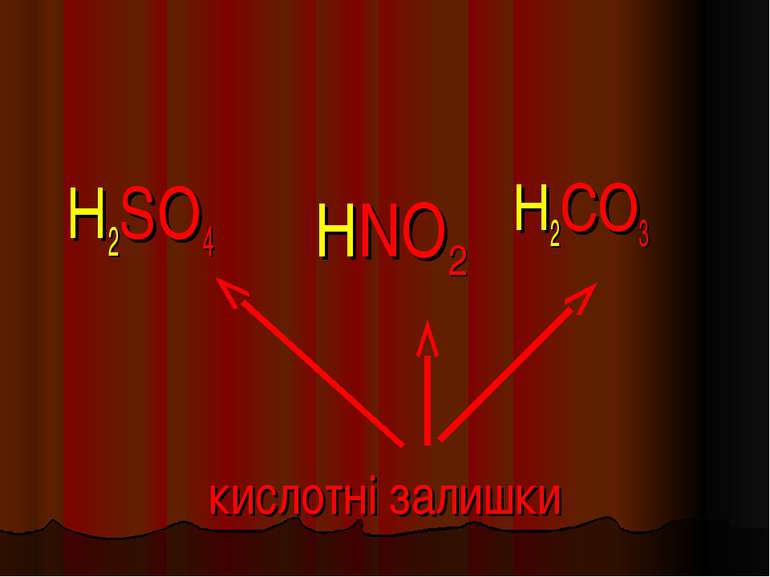
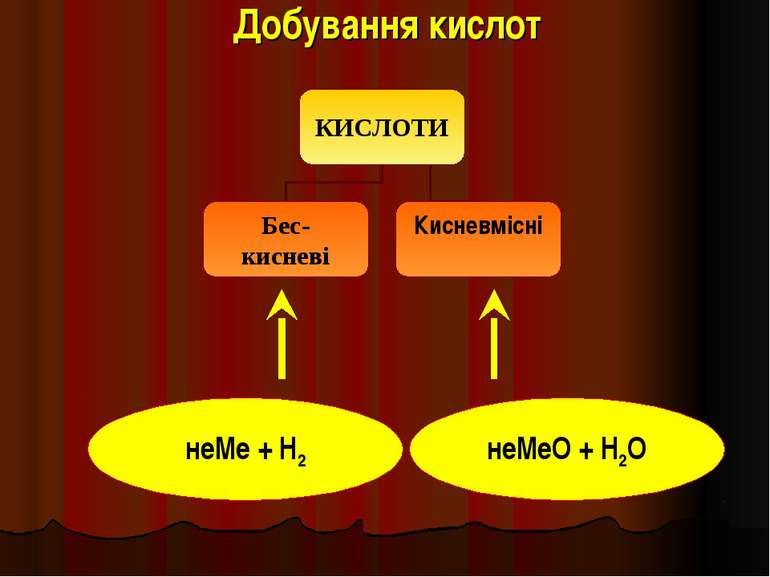
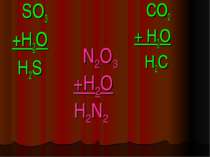
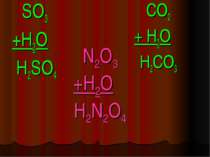
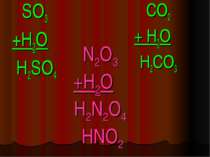
Кислоти - це складні речовини, які складаються з одного або декількох атомів гідрогену та кислотного залишку HxR
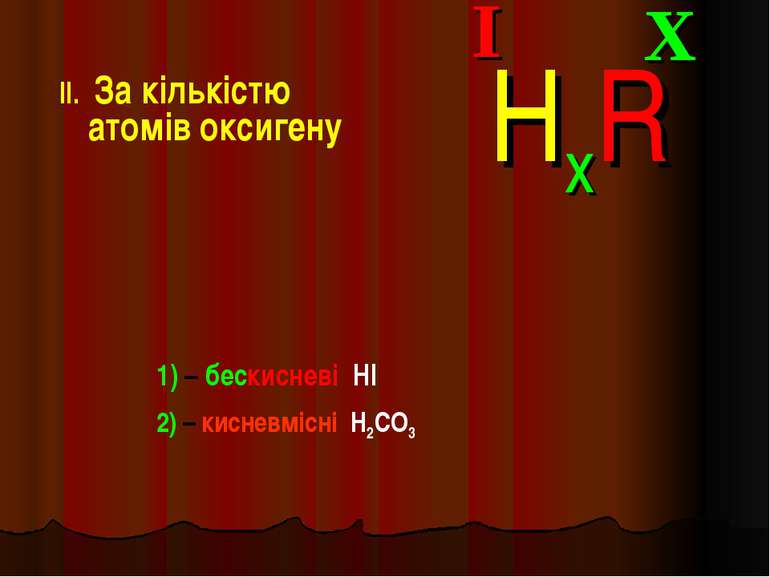
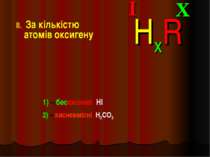
Класифікація кислот I. За кількістю атомів гідрогену: X I HxR x = 1 – одноосновна HNO3 x = 2 – двохосновна H2CO3 x = 3 – трьохосновна H3PO4
Пікресліть кислотні залишки в молекулах кислот H2SO4; H2CO3; HNO3; H2SiO3; H3PO4 _______ ________ _________ __________ _____ X I HxR
Визначте валентність кислотних залишків H2SO4; H2CO3; HNO3; H2SiO3; H3PO4 _______ ________ _________ __________ _____ X I HxR II III I II II
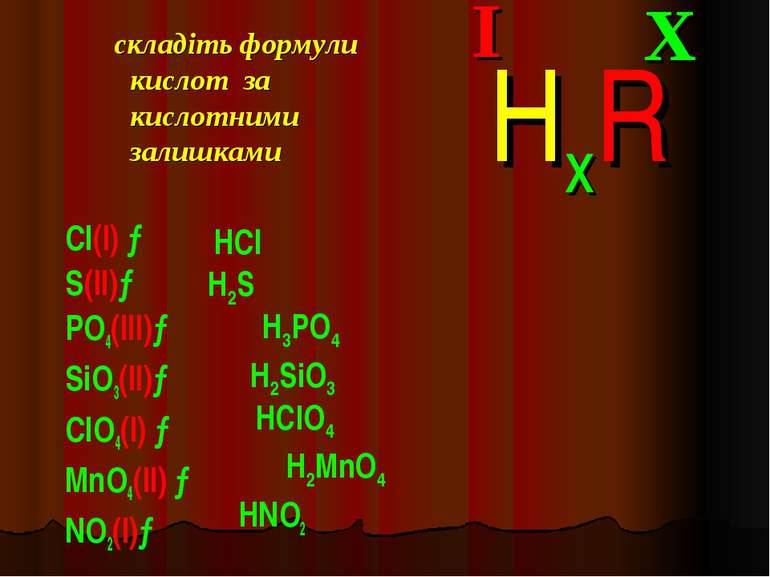
складіть формули кислот за кислотними залишками Cl(I) → S(II)→ PO4(III)→ SiO3(II)→ ClO4(I) → MnO4(II) → NO2(I)→ X I HxR HCl H2S H3PO4 H2SiO3 HClO4 H2MnO4 HNO2
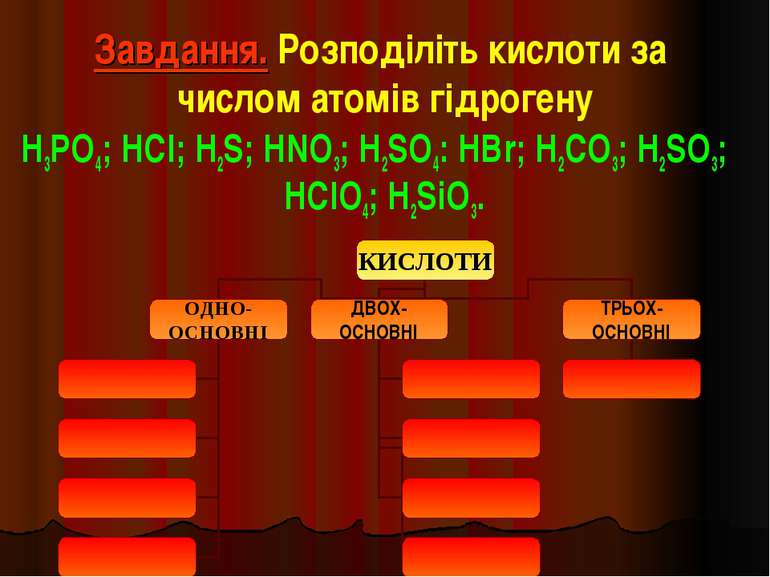
Завдання. Розподіліть кислоти за числом атомів гідрогену H3PO4; HCl; H2S; HNO3; H2SO4: HBr; H2CO3; H2SO3; HClO4; H2SiO3.
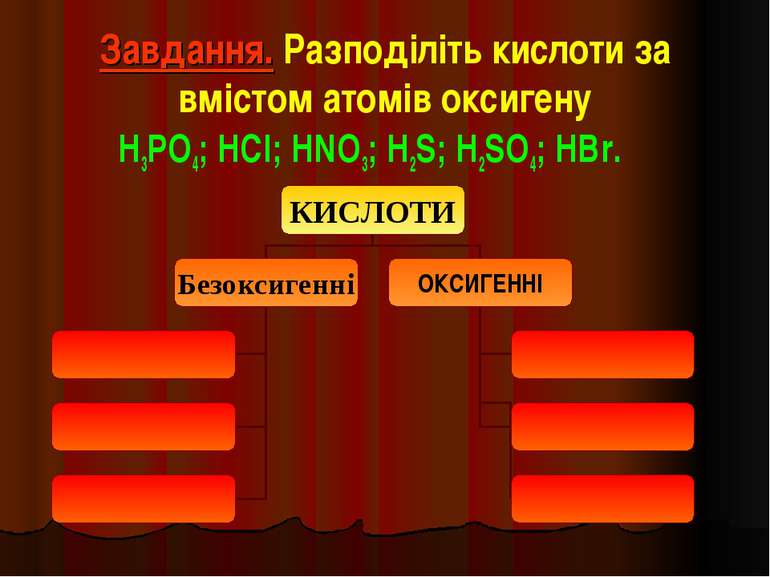
Завдання. Разподіліть кислоти за вмістом атомів оксигену H3PO4; HCl; HNO3; H2S; H2SO4; HBr.
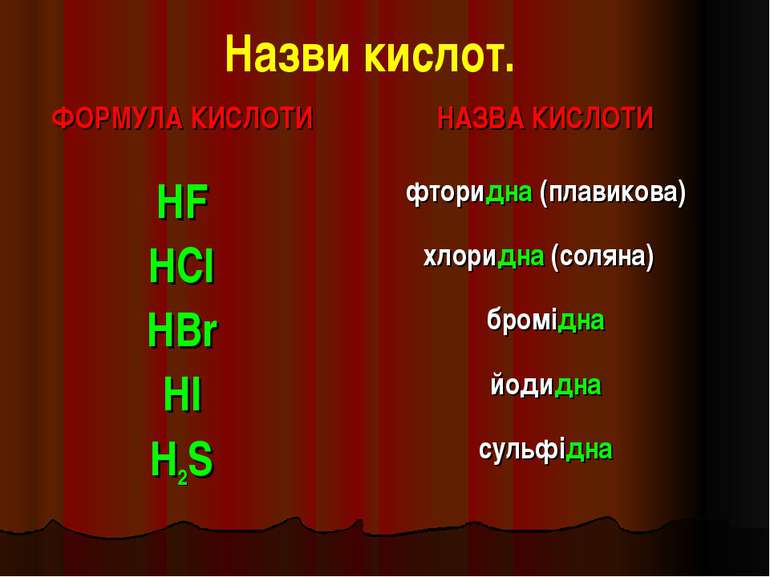
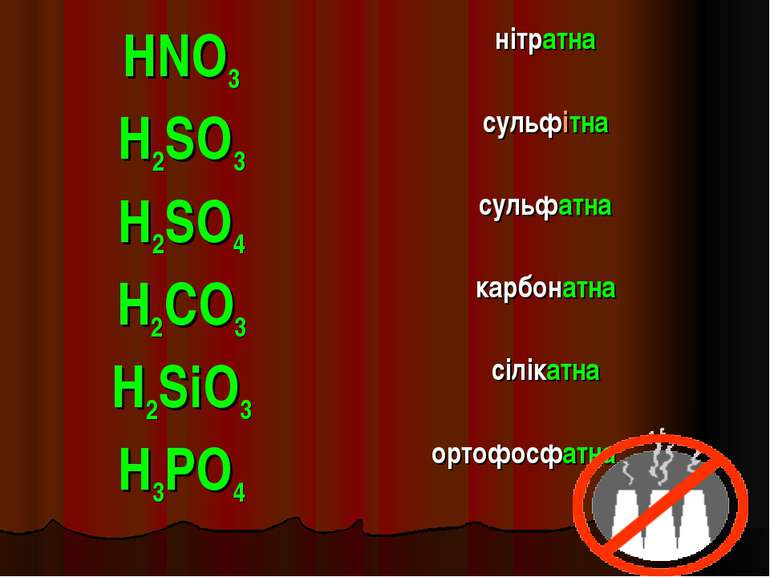
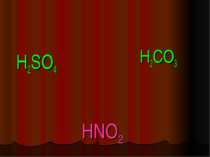
Назви кислот. ФОРМУЛА КИСЛОТИ НАЗВА КИСЛОТИ HF фторидна (плавикова) HCl хлоридна (соляна) HBr бромідна HI йодидна H2S сульфідна
HNO3 нітратна H2SO3 сульфітна H2SO4 сульфатна H2CO3 карбонатна H2SiO3 сілікатна H3PO4 ортофосфатна
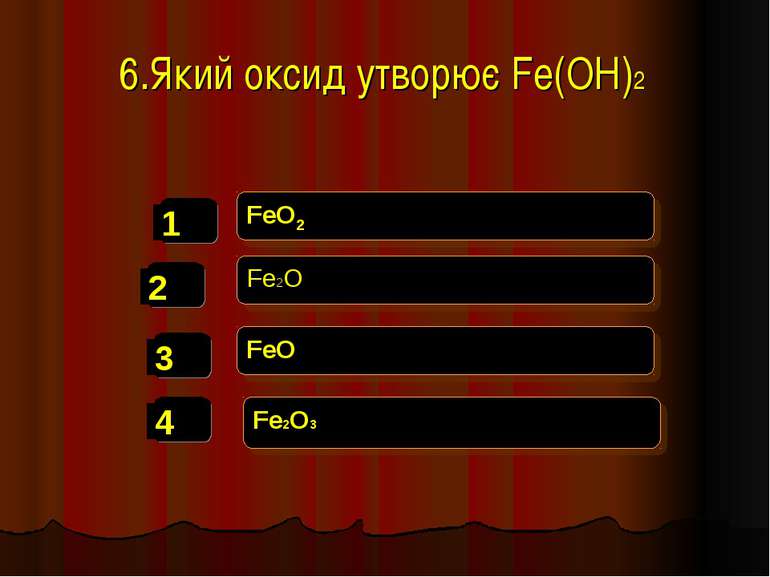
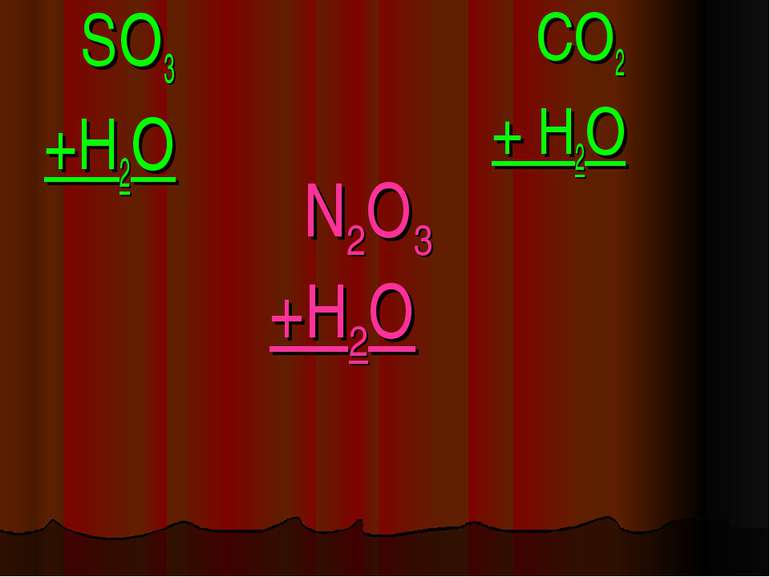
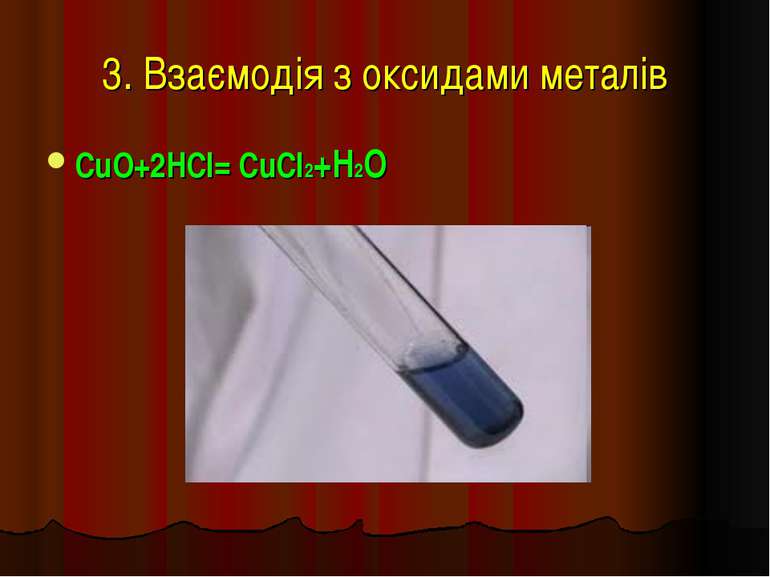
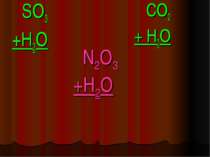
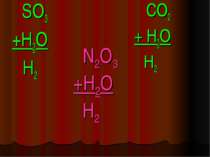
Фізичні властивості кислот H2 CO3 = CO2↑ +H2O – карбонатна кислота H2SO3 = SO2↑ + H2O – сульфітна кислота у вільному вигляді не існують, розпадаються на газ та воду. HCl -хлоридна кислота H2SO4 -сульфатна кислота рідкі HNO3 -нітратна кислота H2SiO3 - сілікатна кислота драглиста
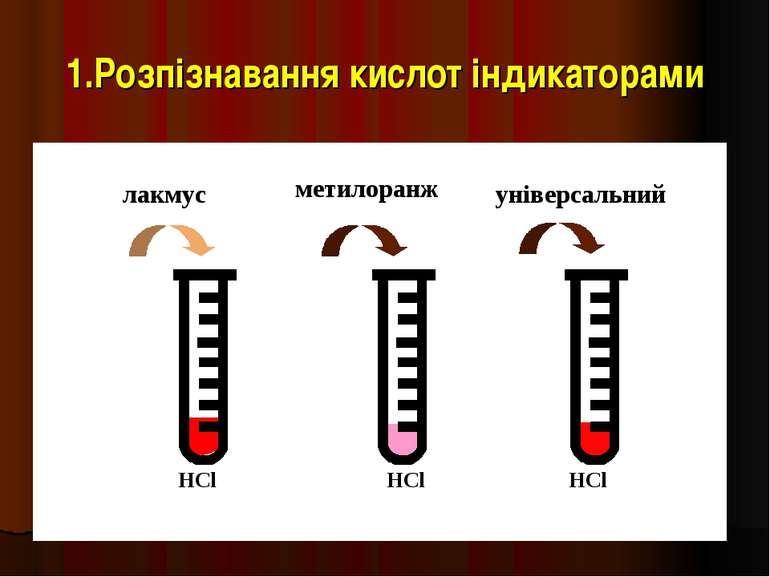
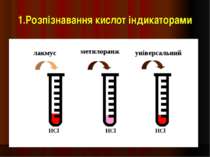
Індикатори речовини, які змінюють колір в залежності від середовища розчину Лакмус Метилоранж Фенолфталеин
КИСЛОТИ МІСТЯТЬСЯ В ОРГАНІЗМАХ ТВАРИН Хлоридна кислота знаходиться у шлунку, допомога перетравлювати їжу. Молочна кислота утворюється у м’язах при физичному навантаженні.
1. Де написані тільки кислоти: а) NH3 HCl H2 SO4 б) H2S HNO3 HBr в) HCl KCl H3PO4 Закріплення 2. Яка речовина лишня: а) HCl H2SO4 K2O б) HNO3 H2O H2CO3 в) H2S H2SO4 NaOH
CuO, NaOH, H3PO4, CO2, CaCO3, HCl, Cu(OH)2, HNO3, BaO, H2S, K2SO3, H2SO4, Al(OH)3, AgNO3, H2CO3, NaSiO3, SO3, Al2(SO4)3 Виберіть кислоти; Прокласифікуйте їх Визначте валентність кислотних залишків
Схожі презентації
Категорії