Презентація на тему:
"Оксиди неметалічних елементів"
Завантажити презентацію
"Оксиди неметалічних елементів"
Завантажити презентаціюПрезентація по слайдам:
Оксиди―бінарні сполуки Оксигену, в яких цей елемент виявляє ступінь окиснення -2. Загальна формула оксидів―ЕmОn Майже всі неметалічні елементи утворюють оксиди. Винятками є Флуор і три інертні гази –Гелій, Неон, Аргон. Для більшості елементів існує по кілька оксидів, а для Бору та Гідрогену – по одному.
Формули важливих оксидів неметалічних елементів (крім води) Періоди Групи IV V VI 2 CO, CO2 NO, NO2 3 SiO2 P2O5 SO2,SO3
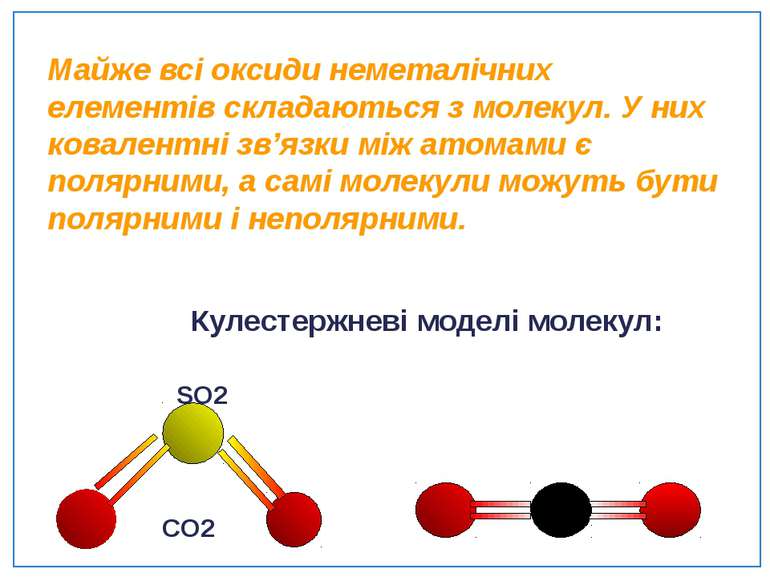
Майже всі оксиди неметалічних елементів складаються з молекул. У них ковалентні зв’язки між атомами є полярними, а самі молекули можуть бути полярними і неполярними. Кулестержневі моделі молекул: SO2 CO2
Фізичні властивості: Оксиди неметалічних елементів за звичайних умов перебувають у різних агрегатних станах. Так, сполуки SO2, NO2, NO, CO2, CO є газами, N2O4–рідина, а оксиди P2O5, SiO2–тверді речовини. Сполуки SO2, SO3, NO2, CO2, P2O5 і багато інших оксидів неметалічних елементів розчиняються у воді, взаємодіючи з нею і перетворюючись на кислоти.
Хімічні властивості оксидів неметалічних елементів Кислотні властивості вищих оксидів неметалічних елементів у кожному періоді посилюються з ліва на право. У такому самому напрямку збільшується і сила відповідних кислот. Чим вища валентність неметалічного елемента в оксиді, тим більшою мірою виражені властивості в оксиду і відповідної кислоти.
Реакція з водою: * SO2+H2O=H2SO3 * 2NO2+H2O=HNO3+HNO2 (окисно-відновна реакція) * SiO2 +H2O= Реакції з основними й амфотерними оксидами, основами, амфотерними гідроксидами: При взаємодії кислотних оксидів зі сполуками основної або амфотерної природи утворюються солі: * 2NO2+2NaOH=NaNO3+NaNO2 +H2O
Деякі оксиди можуть взамодіяти з киснем або розкладатися з утворенням інших оксидів: * 2CO+O2 =t 2CO2 * 2SO3 =t 2SO2+O2 * K2CO3+SiO2 =t K2SiO3+CO2
Застосування неметалічних оксидів:* Сучасні вогнегасники містять зріджений карбон(IV) оксид.* Добавлення вуглекислого газу в повітря теплиць прискорює ріст і достигання ранніх овочів.* Вуглекислий газ застосовують для приготування газованих напоїв.* Пісок, який складається переважно з силіцій(IV) оксиду, застосовують для виробництва скла та бетону.
Оксиди NO і NO2 є проміжними продуктами у виробництві нітратної кислоти, а SO2–сульфатної. * Карбон(ІІ) оксид входить до складу горючих газових сумішей і слугує вихідною речовиною для синтезу метанолу. * Із фосфор(V) оксиду виробяють частину ортофосфатної кислоти.
Парниковий ефект. Нагріта Сонцем поверхня нашої планети віддає в космічний простір частину отриманої теплової енергії у вигляді інфрачервоних променів. Вуглекислий газ здатен поглинати ці промені і затримує частину теплоти на Землі. Таке явище називають парниковим ефектом. Учені припускають, що на планеті скоро може потеплішати на кілька градусів, що призведе до танення льодовиків та затоплення великих територій.
Фізіологічна дія оксидів Більшість оксидів неметалічних елементів токсичні. Чадний газ СО дуже отруйний. Він не має запаху і людина його не відчуває. Вуглекислий газ не вважають токсичною речовиною. Однак якщо об’ємна частка цього газу в повітрі досягає 0,25%, то людина починає відчувати задуху. Висока концентрація СО2 може спричинити смерть через зупинку дихання.
Схожі презентації
Категорії