Презентація на тему:
Класифікація оксидів. Оксиди в природі, їх використання та фізичні властивості.
Завантажити презентацію
Класифікація оксидів. Оксиди в природі, їх використання та фізичні властивості.
Завантажити презентаціюПрезентація по слайдам:
Мета. Познайомити з класифікацією оксидів, закріпити навички складання формул оксидів та їх назв. Розглянути поширення оксидів у природі, їх фізичні властивості та використання.
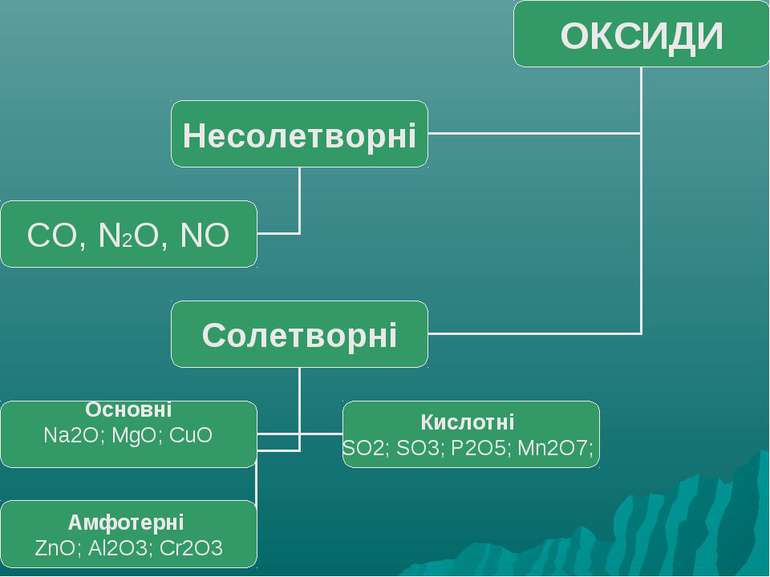
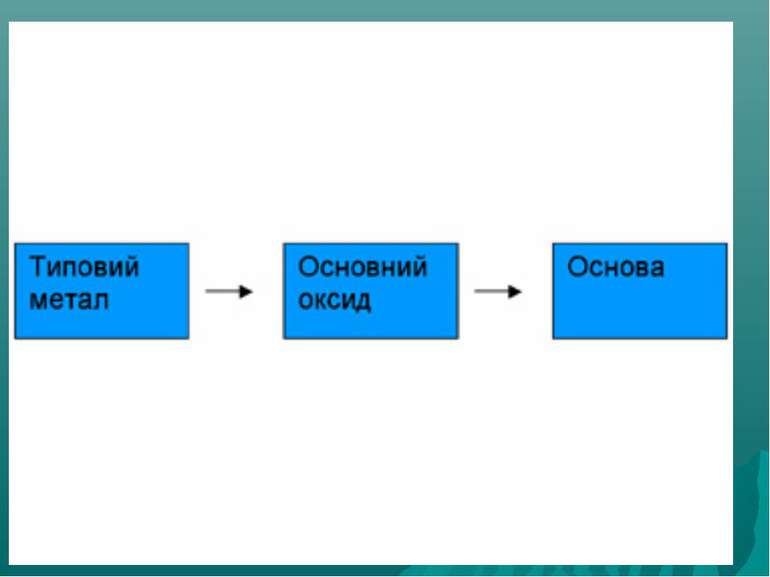
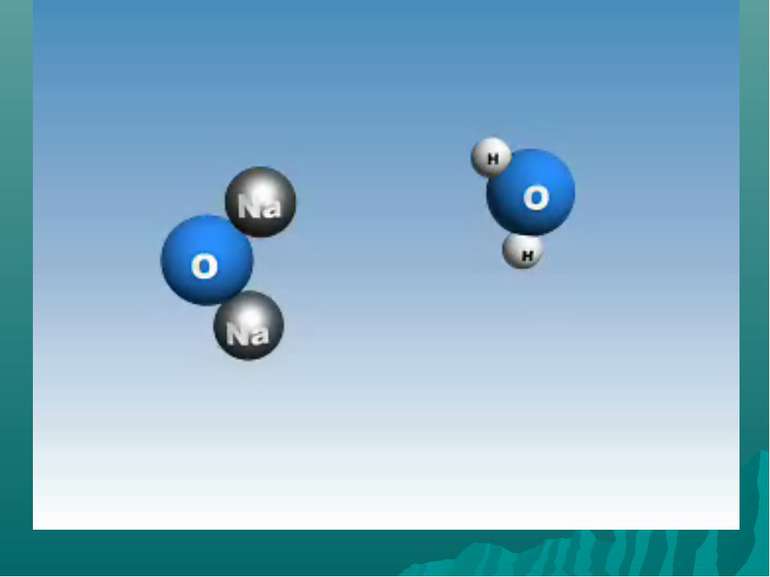
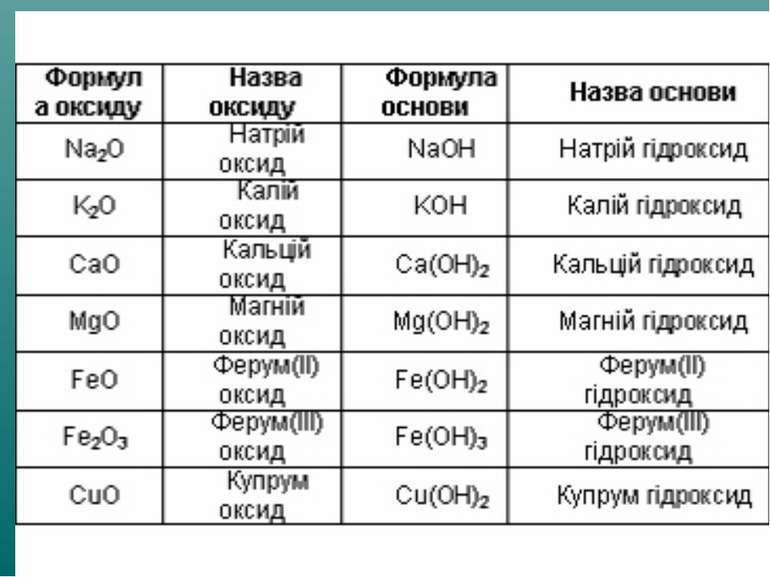
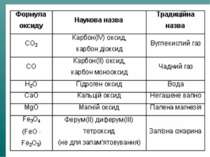
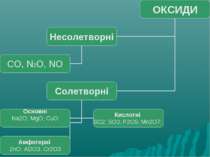
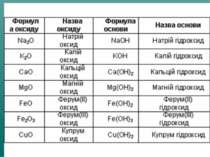
Оксиди, яким відповідають основи (незалежно від того, чи реагують вони з водою чи ні), називають основними Це оксиди які утворені металом CaO + H2О = Ca(OH)2 Na2O + H2О = 2 NaOH
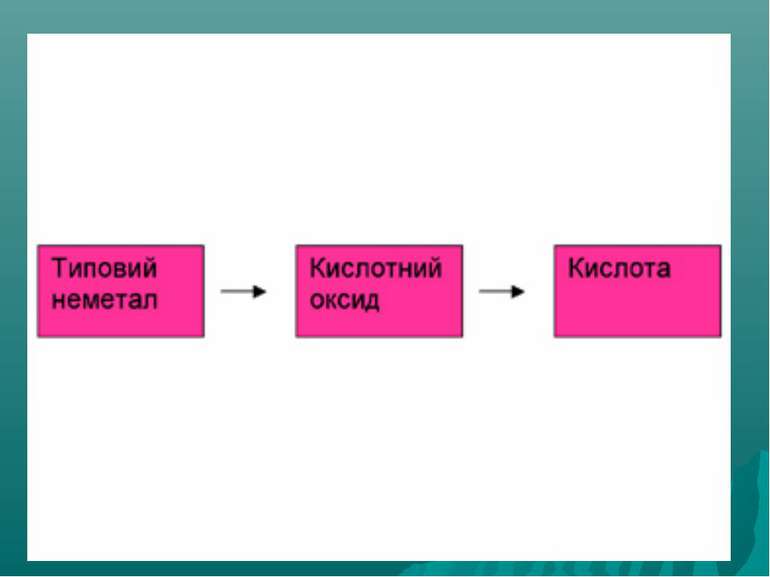
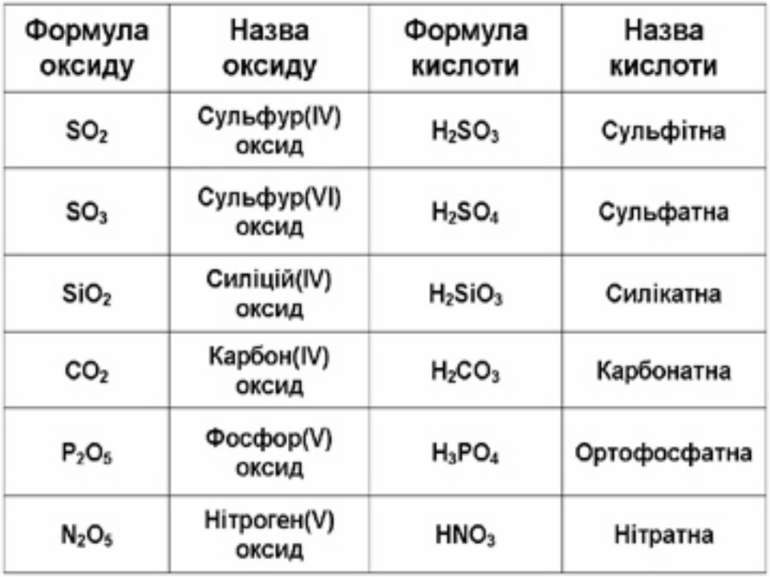
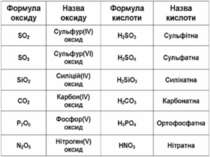
Оксиди, яким відповідають кислоти (незалежно від того, реагують вони з водою чи ні), називаються кислотними. Оксиди утворені неметалом CO2 + H2O = H2CO3 SO2 + H2O = H2SO3 (спрощено) P2O5 + ЗН2О = 2H3PO4
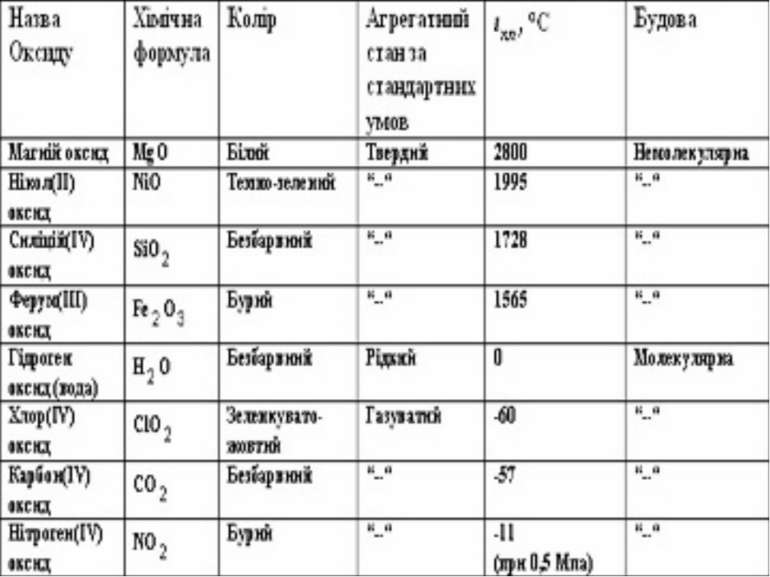
Поширення у природі Оксиди багатьох елементів дуже поширені в природі. Як ти гадаєш, чому? Наприклад, така добре відома сполука, як звичайний річковий пісок (з деякими домішками) є оксидом з формулою SiO2 – силіцій(IV) оксид (кремнезем). Майже чистим кремнеземом є гірський кришталь. Цей оксид разом з алюміній оксидом Al2O3 входить до складу глин та багатьох інших мінералів. З руд, які містять алюміній оксид Al2O3, виплавляють алюміній. Звичайний наждак – це також алюміній оксид з домішками. Алюміній оксид з невеликим вмістом різних домішок може бути і коштовним каменем (рубін, сапфір). Дуже поширені в природі й оксиди Феруму – це різні залізні руди. Україна має великі запаси залізних руд (Криворізьке та Керченське родовища). До складу повітря входить карбон(IV) оксид СО2 (вуглекислий газ), об’ємна частка якого в повітрі становить 0,3 %. Однак найпоширенішим оксидом у природі є гідроген оксид Н2О (вода).
Вода – це найдивовижніша, найпоширеніша і найнеобхідніша речовина на нашій планеті. Багато води перебуває у газуватому стані в атмосфері. У вигляді великих мас снігу і криги лежить вода цілорічно на вершинах високих гір і в полярних країнах. У надрах Землі також є вода, що просочує грунт і гірські породи. Воді належить найважливіша роль у геологічній історії нашої планети. Вода має велике значення у промисловості, вона незамінний компонент практично всіх технологічних процесів. На виробництво 1 т сталі, наприклад, витрачається 300 м3 води, 1 т паперу – 900 м3, 1 т хімічного волокна – понад 2000 м3. У всякому організмі вода є середовищем, в якому відбуваються хімічні процеси, що забезпечують життєдіяльність організму, і сама вода бере участь у багатьох біохімічних реакціях. Відомо, що масова частка води в організмі людини становить 65 %.
Більшість оксидів, а саме оксиди елементів-металів, має немолекулярну будову і дуже високу температуру плавлення. Такі оксиди – тверді речовини. Деякі оксиди (оксиди елементів-неметалів) мають молекулярну будову і за стандартних умов перебувають в рідкому або газуватому стані.
Одержання оксидів Взаємодія простих і складних речовин з киснем: 2Mg + O2 2MgО 4P + 5O2 2P2O5 S + O2 SO2 2CO + O2 2CO2 2CuS + 3O2 2CuO + 2SO2 CH4 + 2O2 CO2 + 2H2O 4NH3 + 5O2 –кат. 4NO + 6H2O Розкладання деяких кислородсодержащих речовин (основ, кислот, солей) при нагріванні: Cu(OH)2 –t CuO+ H2O (CuОН)2CO3 –t 2Cuo + CO2 + H2O 2Pb(NO3)2 –t 2PbO + 4NO2 + O2 2HMnO4 –t ;H2SO4(конц.) Mn2O7 + H2O
Поэтому важнейшим применением оксидов металлов является их восстановление. Например, в доменной печи происходит восстановление оксидов железа с образованием металлического железа: Fe3O4 + CO = 3FeO + CO2 FeO + CO = Fe + CO2 Химические свойства оксидов далеко не исчерпываются приведенными примерами. Более подробно с их свойствами мы познакомимся в последней главе – при изучении основных классов соединений. ** Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения: SO3 + H2O = H2SO4 CaO + H2O = H2CaO2 или Ca(OH)2 В результате часто получаются очень нужные и полезные соединения. Например, H2SO4 – серная кислота, Са(ОН)2 – гашеная известь и т.д. Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения. Такими же ценными свойствами обладает оксид титана (IV) – TiO2. Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды. Оксид хрома (III) – Cr2O3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr2O3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле. Благодаря нерастворимости и прочности оксида хрома (III) его используют и в полиграфических красках (например, для окраски денежных купюр). Вообще, оксиды многих металлов применяются в качестве пигментов для самых разнообразных красок, хотя это – далеко не единственное их применение.
Висновки Оксиди – це складні речовини, що складаються з двох хімічних елементів, одним з яких є Оксиген. За складом оксиди поділяють на оксиди металів і оксиди неметалів. Оксиди дуже поширені в природі, оскільки кисень є однією з найактивніших речовин. Найважливішим природним оксидом є вода – джерело життя на Землі, сировина для промисловості, джерело енергії, чинник, що визначає погоду, клімат Землі. Основні джерела води – моря й океани, річки й озера. Для усіх господарських потреб використовується прісна природна вода після її очищення. Прісної води на Землі мало. Воду потрібно берегти.
Задачі для самостійного розв’язування Задача 1 Обчисли масу натрій оксиду, що може взаємодіяти з водою кількістю речовини 0,4 моль Задача 2 Обчисли об’єм водню, що утвориться при взаємодії калію масою 1,56 г з водою. Задача 3 Фосфор масою 248 г спалили в кисні. Утворений оксид прокип’ятили з водою. Яка кількість речовини ортофосфатної кислоти утворилася при цьому? Задача 4. У зерносховищах для звільнення приміщення від шкідників зерна часто спалюють сірку з розрахунку, аби кожний кубічний метр повітря містив не менше, як 50 г сульфур(IV) оксиду SO2. Обчисли масу сірки, яку потрібно спалити в приміщенні об’ємом 5000 м3.
Схожі презентації
Категорії