Презентація на тему:
"Хімічні реакції"
Завантажити презентацію
"Хімічні реакції"
Завантажити презентаціюПрезентація по слайдам:
Мета Дати визначення типів хімічних реакцій; Навчити визначати тип реакцій за ознаками; Дати поняття окисно-відновних реакцій та теплового ефекту реакції *
Цілі: Класифікація хімічних реакцій; Енергетичний ефект хімічних реакцій; Окисно-відновні реакції; Швидкість хімічних реакцій; Хімічна рівновага *
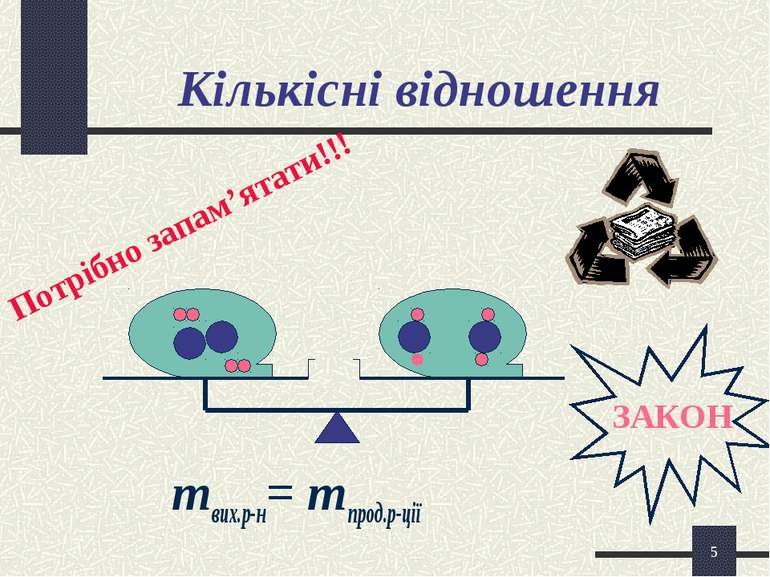
* Хімічне рівняння - це умовне зображення реакції за допомогою хімічних формул і, в разі потреби, коефіцієнтів Н Н ОО + Н Н = Н О Н Н О Н О2+2Н2=2Н2О Хімічні рівняння
* Типи хімічних реакцій СПОЛУЧЕННЯ РОЗКЛАДУ ЗАМІЩЕННЯ ОБМІНУ ЕКЗОТЕРМІЧНІ ЕНДОТЕРМІЧНІ ОКИСНО-ВІДНОВНІ
* Реакції сполучення ПРИКЛАДИ: 3Fe + 2O2 = Fe3O4 BaО + H2O = Ba(OH)2 2Al + 3Br2 = 2AlBr3 CaO + SiO2 = CaSiO3 ЗАВДАННЯ 1: Записати рівняння реакції і назвати продукти: ? + H2O KOH + ? CAO + ? Ca(OH)2 MgO + ? MgCl2 + ?
* Реакції розкладу ПРИКЛАДИ: 2KClO3 = 2KCl + 3O2 2KMnO4 = K2MnO4 + MnO2 + O2 2H2O2 = 2H2O + O2 ЗАВДАННЯ 2: В якому рівнянні невірно розставлені коефіцієнти? CaCO3 = CaO + CO2 2NH3 =N2 + 2H2 Cu(OH)2 =t CuO + H2O NH4Cl = NH3 + 2HCL
* Реакції заміщення ПРИКЛАДИ: 2Na + 2H2O = 2NaOH + H2 Fe + 2HCl = FeCl2 + H2 8Al =3Fe3O4 = 4Al2O3 + 9Fe 2KBr + Cl2 = 2KCl + Br2 Завдання 3: Закінчити рівняння реакції Fe2O3 + H2 = ? Fe2O3 + C = ? Al2O3 + H2 = ? MnO2 + Al = ?
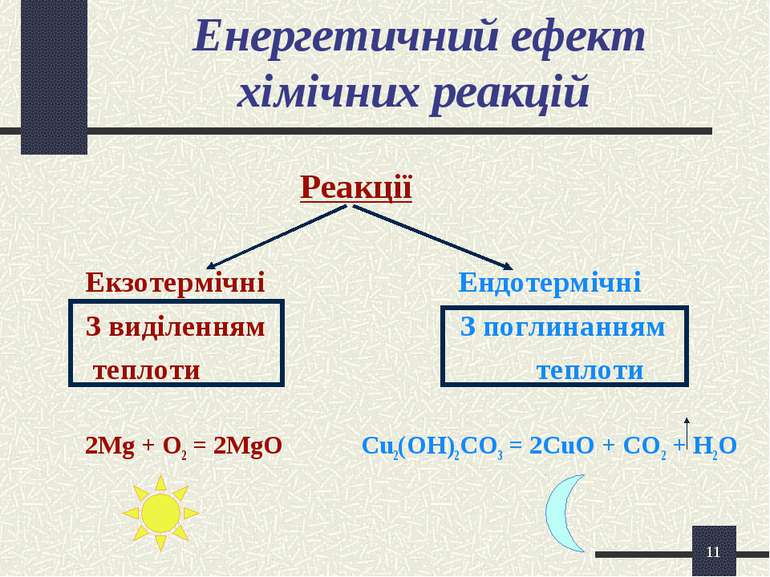
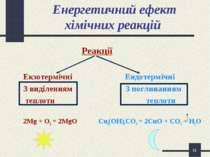
* Енергетичний ефект хімічних реакцій Реакції Екзотермічні Ендотермічні З виділенням З поглинанням теплоти теплоти 2Mg + O2 = 2MgO Cu2(OH)2CO3 = 2CuO + CO2 + H2O
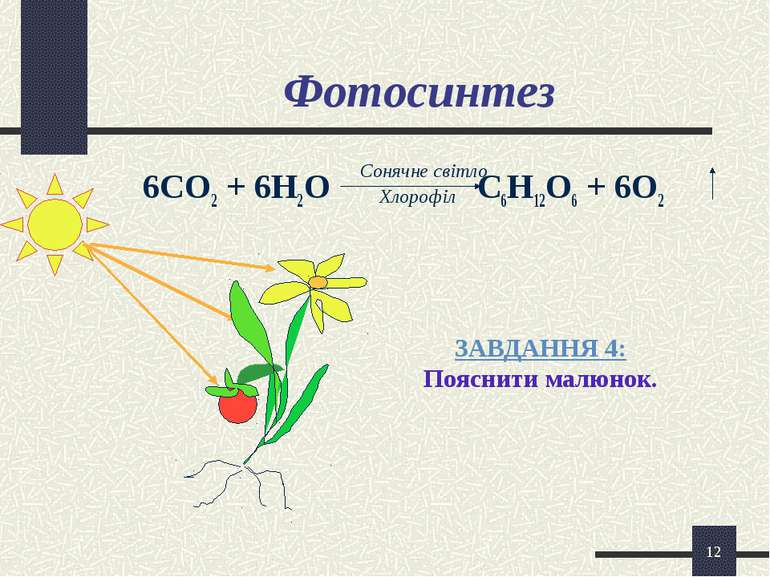
* Фотосинтез 6СО2 + 6Н2О С6Н12О6 + 6О2 Сонячне світло Хлорофіл ЗАВДАННЯ 4: Пояснити малюнок.
* Тепловий ефект Теплота, що виділяється або поглинається під час хімічної реакції, називається тепловим ефектом реакції. Тепловий ефект реакції Н – це різниця між вмістом енергії у вихідних речовинах і кінцевих продутах реакції. 3 2 1 1 4 2 Н + Н 1 - енергія вихідних речовин; 2 - енергія продуктів реакції; 3 - поглинання теплоти; 4 – виділення теплоти. а б а – реакція ендотермічна, величина Н позитивна б – реакція екзотермічна, величина Н негативна Система Система Енергія Енегрія
* Завдання для самоконтролю (1) З наведених параметрів під час перебігу хімічної реакції завжди залишається незмінним (незмінною) (1) маса; (2) об’єм; ( 3) тиск; (4) концентрація. Рівнянням реакції Н2SO4 + 2NaOH = Na2SO4 + 2H2O подано процес (1) розкладу; (2) сполучення; (3) нейтралізація; (4) заміщення. Тепловий ефект реакції Н (кДж) перетворення речовини А на речовину В дорівнює (1) +50; (2) –100; (3) +150; (4) –200; (5) +100; (6) –50. А В Перебіг реакції Енергія системи кДж 50 100 150 200 250
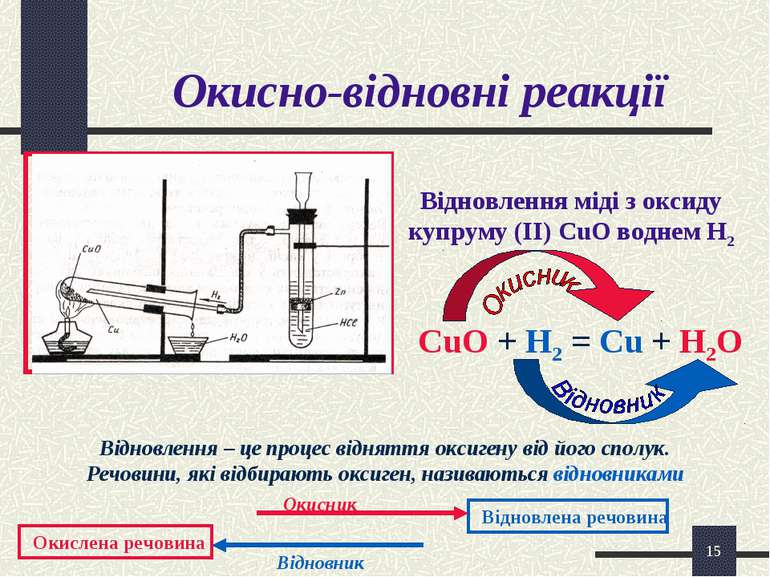
* Окисно-відновні реакції Відновлення міді з оксиду купруму (ІІ) CuO воднем Н2 CuO + H2 = Cu + H2O Відновлення – це процес відняття оксигену від його сполук. Речовини, які відбирають оксиген, називаються відновниками Окислена речовина Відновлена речовина Окисник Відновник
* Завдання для самоконтролю(2) Скласти рівняння реакцій водню з такими речовинами: а) оксидом феруму(ІІІ); б)оксидом меркурію(ІІ); оксидом вольфраму(VІ). Яка хімічна властивість водню виявляється в цих реакціях? До якого типу реакцій вони належать?
* Швидкість хімічних реакцій Хімічні реакції відбуваються з різною швидкістю + = Кислота + Луг = Нейтральна речовина МИТТЄВО!!! + Глина Пісок Протягом століть
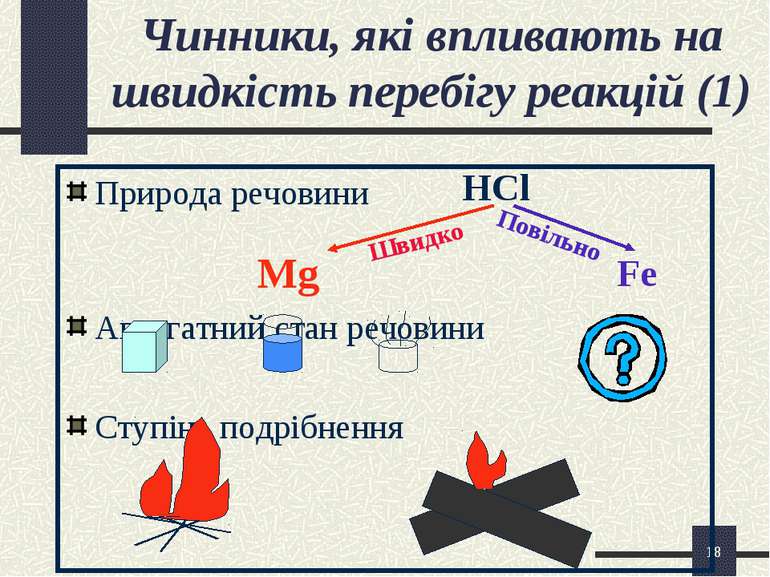
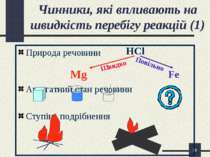
* Чинники, які впливають на швидкість перебігу реакцій (1) Природа речовини Mg Агрегатний стан речовини Ступінь подрібнення HCl Fe Повільно Швидко
* Чинники, які впливають на швидкість перебігу реакцій (2) Концентрація реагуючих речовин Температура Каталіз 2H2O2 = 2H2O + O2 Кисень Повітря 2H2 + O2 = 2H2O + Н t MnO2 Пригадай, яке явище називають отруєнням каталізатора
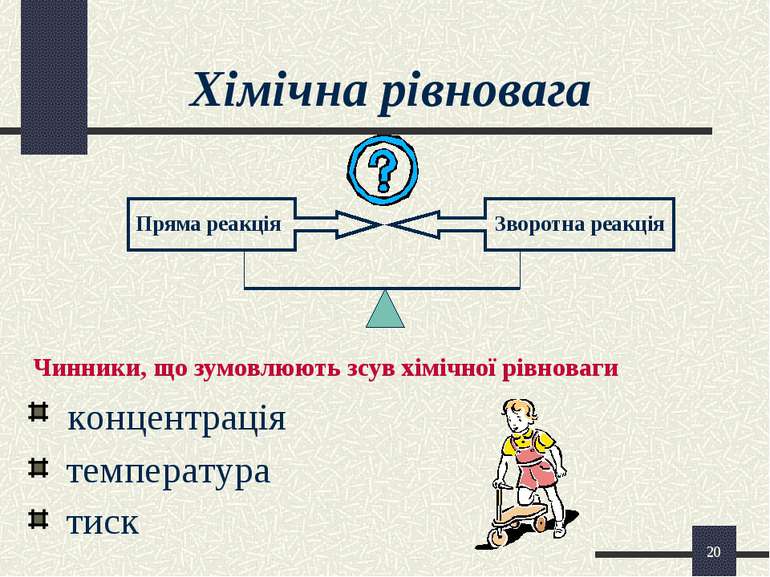
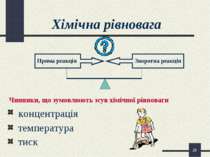
* Хімічна рівновага концентрація температура тиск Чинники, що зумовлюють зсув хімічної рівноваги Пряма реакція Зворотна реакція
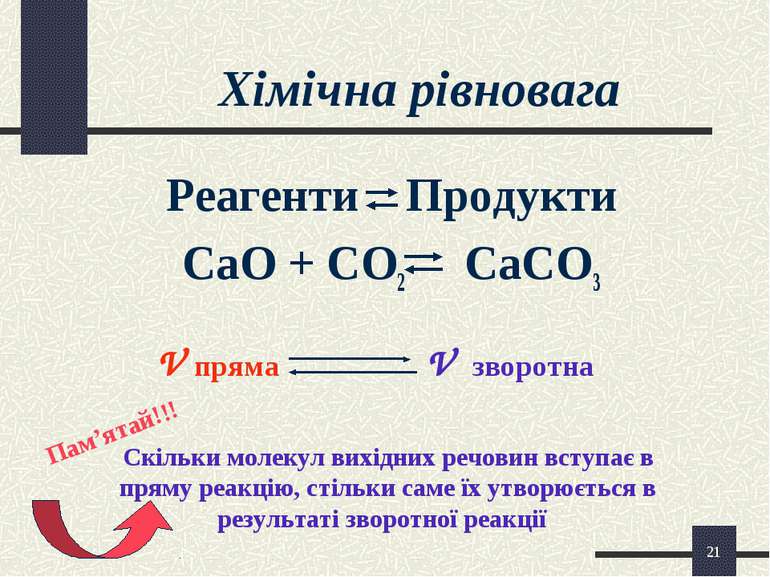
* Хімічна рівновага Реагенти Продукти CaO + CO2 CaCO3 V пряма V зворотна Скільки молекул вихідних речовин вступає в пряму реакцію, стільки саме їх утворюється в результаті зворотної реакції Пам’ятай!!!
* Завдання для самоконтролю(3) Що таке хімічна рівновага й чому вона називається динамічною? Написати рівняння і зазначити, що оборотною буде реакція між: а) Na2SiO3 і H2SO4; б) CaO і HCl; в) NaOH і Al(OH)3; г) Na і O2 Із названих нижче чинників на стан хімічної рівноваги не впливає а) температура; б) тиск; в) концентрація реагуючих речовин; г) збільшення площі поверхні реагуючих речовин.
Схожі презентації
Категорії