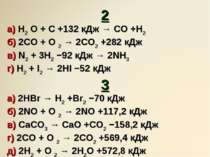Презентація на тему:
Тепловий ефект реакції. Екзотермічні й ендотермічні реакції. Термохімічні рівняння
Завантажити презентацію
Тепловий ефект реакції. Екзотермічні й ендотермічні реакції. Термохімічні рівняння
Завантажити презентаціюПрезентація по слайдам:
Запитання: Які типи хімічних реакцій ви знаєте? За якими ознаками класифікують хімічні реакції? Які реакції називаються реакціями сполучення? Що відбувається під час реакції розкладу? Які реакції називаються реакціями заміщення?
Що відбувається під час реакцій обміну? Які типи хімічних реакцій включає класифікація за тепловим ефектом? Що таке швидкість хімічної реакції? Які фактори впливають на швидкість хімічної реакції? У чому полягає вплив природи реагентів на швидкість хімічних реакцій? Як пояснити вплив концентрації реагентів на швидкість реакції?
Тепловий ефект хімічних реакцій. Термохімічні рівняння Завдання 1 Визначте тип хімічної реакції за тепловим ефектом хімічної реакції N2 + O 2 = 2NO − 180 кДж 2HI + Cl2 = I2 + 2HCl + Q N2 + 3H2 = 2NH3 + 83 кДж H2 S + H2 = S − 40,2 кДж CO + H2O = CO2 + H2 + Q 2CO + O2 = 2CO2 + 570 кДж
Термохімічні рівняння Які реакції називаються екзотермічними? Екзотермічними є реакції, що протікають із виділенням тепла. Які реакції називаються ендотермічними? Ендотермічними є реакції, що протікають із поглинанням тепла. Теплота, що поглинається або виділяється в процесі хімічної реакції, називається тепловим ефектом реакції.
Тепловий ефект показує різницю між умістом внутрішньої енергії вихідних речовин і продуктів реакції. Умовно можна записати: ∆Q = −∆H = ∑Hвих − ∑Hпрод. Хімічне рівняння, у якому визначено тепловий ефект хімічної реакції, називається термохімічним рівнянням.
Завдання 2 Укажіть тип хімічних реакцій. Які з цих реакцій — екзотермічні? 1 а) 4KClO3 → 3KClO4 +KCl; ∆H = −297 кДж б) C2 H4 + H 2 → C2H6; ∆H = −137,8 кДж в) MnO2 + 2C → Mn +2CO; ∆H = +293 кДж г) 2NaOH + H2 SO4 → Na2 SO4 +2H2O; ∆H = −290 кДж
2 а) H2 O + C +132 кДж → CO +H2 б) 2CO + O 2 → 2CO2 +282 кДж в) N2 + 3H2 −92 кДж → 2NH3 г) H2 + I2 → 2HI −52 кДж 3 а) 2HBr → H2 +Br2 −70 кДж б) 2NO + O 2 → 2NO +117,2 кДж в) CaCO3 → CaO +CO2 −158,2 кДж г) 2CO + O 2 → 2CO2 +569,4 кДж д) 2H2 + O 2 → 2H2O +572,8 кДж е) N2 + O 2 +180 кДж → 2NO
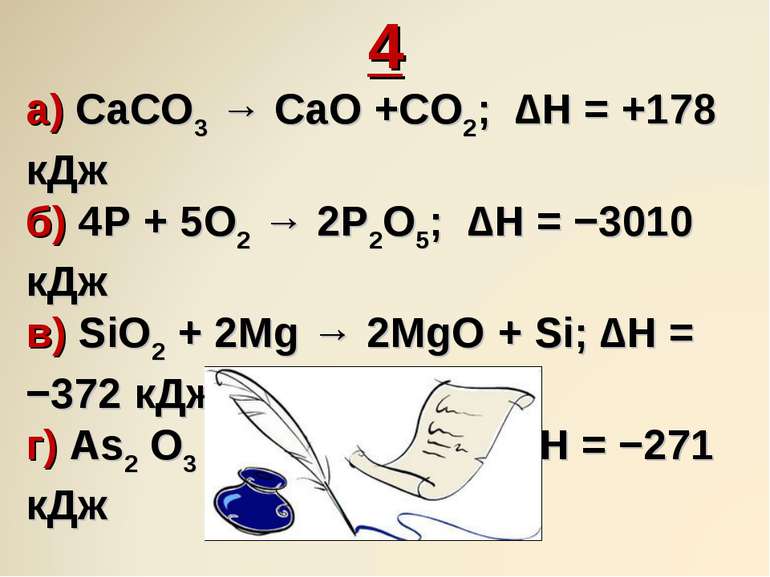
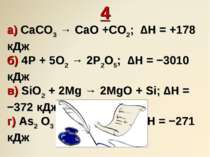
4 а) CaCO3 → CaO +CO2; ∆H = +178 кДж б) 4P + 5O2 → 2P2O5; ∆H = −3010 кДж в) SiO2 + 2Mg → 2MgO + Si; ∆H = −372 кДж г) As2 O3 + O 2 → As2O5; ∆H = −271 кДж
Завдання 1 У процесі згоряння 12 г вуглецю виділяється 393 кДж тепла. Запишіть термохімічне рівняння. C + O 2 → CO2 +393 кДж/моль або C + O 2 → CO2 ; ∆H = −393 кДж.
Завдання 2 Для взаємодії азоту з киснем необхідно 180,5 кДж тепла. Запишіть термохімічне рівняння. N2 + O 2 → 2NO −180,5 кДж/моль або N2 + O 2 → 2NO; ∆H = +180,5 кДж
Завдання 3 Обчисліть, яка кількість тепла виділиться внаслідок спалювання 1 м3 метану, якщо термохімічне рівняння горіння метану: CH4 + 2O2 → CO2 + 2H2O +891 кДж/моль ν (CH4) = V/ Vm = 1000 л/22,4 л/моль = 44,6 моль Q = 891 кДж/моль ·44,6 моль = 39776 кДж. Відповідь: 39 776 кДж.
Завдання 4 Обчисліть, яка маса цинку окиснилася, якщо в результаті реакції поглинулося 174,5 кДж/моль тепла. Термохімічне рівняння: 2Zn + O2 → 2ZnO; ∆H = +34,9 кДж ν(Zn) = 174,5/34,9 = 5 (моль). m(Zn) = 5·64 = 320 (г). Відповідь: 320 г цинку.
Завдання 5 Уявіть себе хіміком-технологом на заводі й охарактеризуйте хімічну реакцію за всіма відомими вам ознаками. Запропонуйте умови, за яких швидкість реакції буде максимальною. а) N2 + 3H2 → 2NH3; ∆H < 0 б) SO2 + O 2 → 2SO3; ∆H < 0
Завдання 6 Учень спалює однакову кількість сірки на повітрі й у циліндрі з киснем. Де реакція протікатиме швидше? Чому?
Домашнє завдання Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи. Творче завдання. Підготуйте розповідь про значення каталітичних реакцій, про ферменти та їх значення для людини.
Схожі презентації
Категорії