Презентація на тему:
Фізичні властивості етилену
Завантажити презентацію
Фізичні властивості етилену
Завантажити презентаціюПрезентація по слайдам:
Фізичні властивості етилену й ацетилену. Отримання алкенів та алкінів. Хімічні властивості: відношення до розчинів кислот, лугів, калій перманганату, повне і часткове окиснення, термічний розклад, галогенування, приєднання водню.
Мета. Ознайомити з основними хімічними властивостями вуглеводнів: відношення до розчинів кислот, лугів, окисників, повними і частковим окисненням, термічним розкладом, галогенуванням. Формувати уміння складати рівняння реакцій, що характеризують хімічні властивості насичених вуглеводнів, називати галогенопохідні згідно до їх формул.
Фізичні властивості АЛКЕНІВ ТА АЛКІНІВ Алкени погано розчиняються у воді, а добре в органічних розчинниках. Алкіни краще розчиняються у водіта мають специфічний аромат Із зростанням карбонового ланцюа збільшується температура кіпіння та плавлення, а такаж густина С2– С4 - гази С5– С16 - рідини С17… - тверді речовини
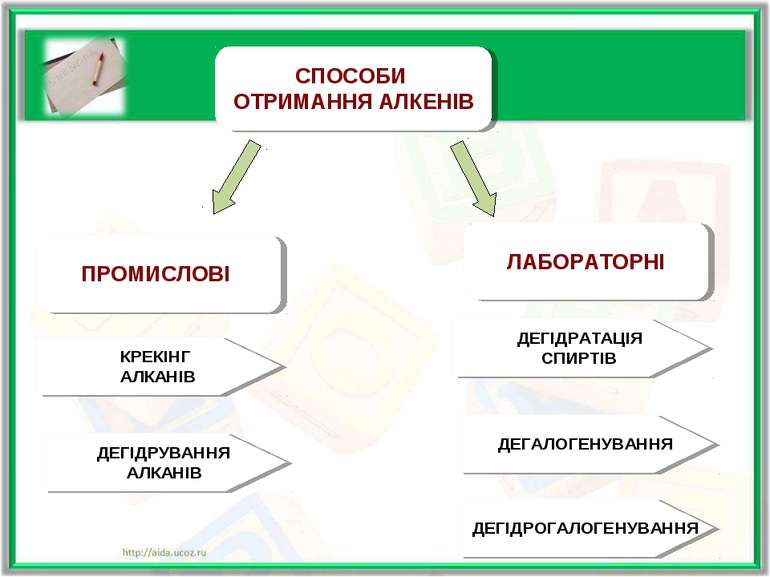
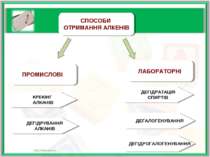
ПРОМИСЛОВІ СПОСОБИ ОТРИМАННЯ АЛКЕНІВ ЛАБОРАТОРНІ КРЕКІНГ АЛКАНІВ ДЕГІДРУВАННЯ АЛКАНІВ ДЕГІДРАТАЦІЯ СПИРТІВ ДЕГАЛОГЕНУВАННЯ ДЕГІДРОГАЛОГЕНУВАННЯ
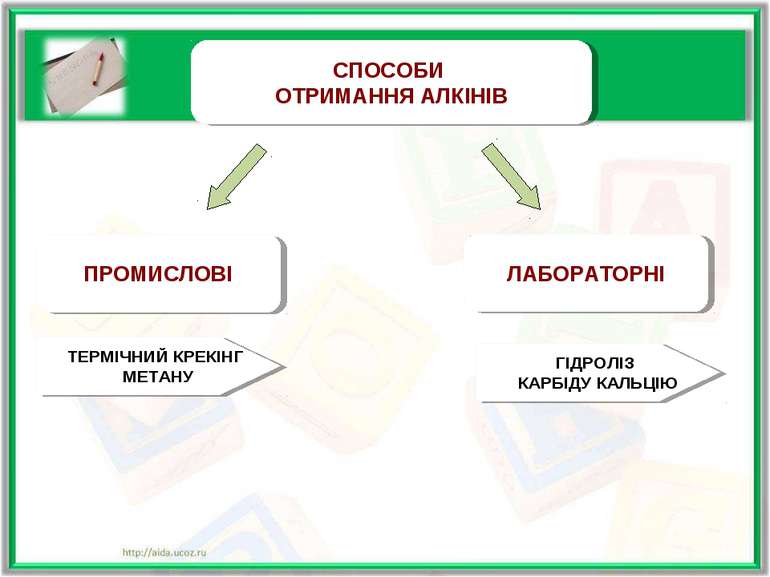
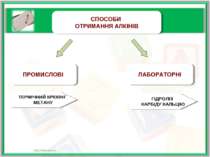
ПРОМИСЛОВІ СПОСОБИ ОТРИМАННЯ АЛКІНІВ ЛАБОРАТОРНІ ТЕРМІЧНИЙ КРЕКІНГ МЕТАНУ ГІДРОЛІЗ КАРБІДУ КАЛЬЦІЮ
Хімічні властивості: відношення до розчинів кислот, лугів, калій перманганату, повне і часткове окиснення, термічний розклад, галогенування, приєднання водню.
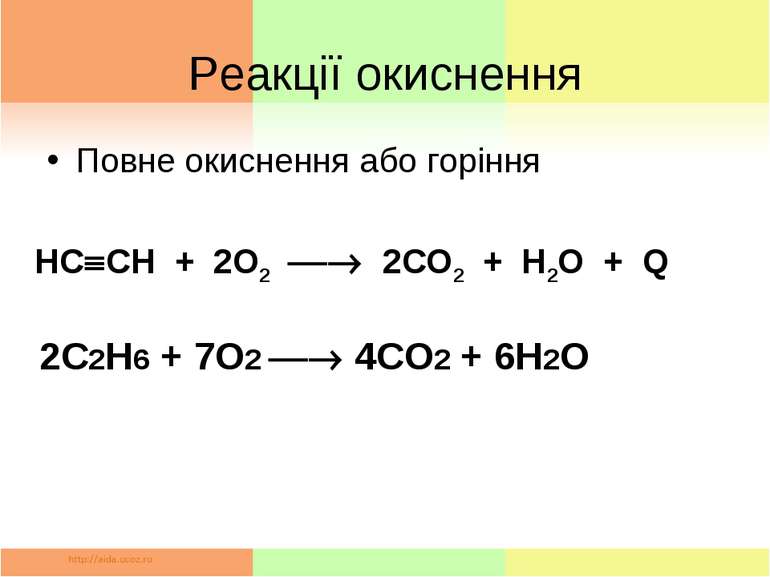
Реакції окиснення Повне окиснення або горіння HC CH + 2О2 2СО2 + Н2О + Q 2С2Н6 + 7О2 4СО2 + 6Н2О
Реакції окиснення Часткове реакція Вагнера Алкени- взаємодія з розчином ПЕРМАНАГАНАТУ КАЛІЮ Н2С=СН2 + [O] + H2O H2C - CH2 OH OH этиленгліколь (этандиол-1,2) ! Якісна реакція Алкіни- взаємодія з розчином ПЕРМАНАГАНАТУ КАЛІЮ з утворенням карбонових кислот: R C C R’ + 3[O] + H2O R COOH + R’ COOH ! Якісна реакція
Реакції заміщення Взаємодія з аміачним розчином гідроксиду срібла HC CH+2[Ag(NH3)2]OH AgC CAg +4NH3+2H2O
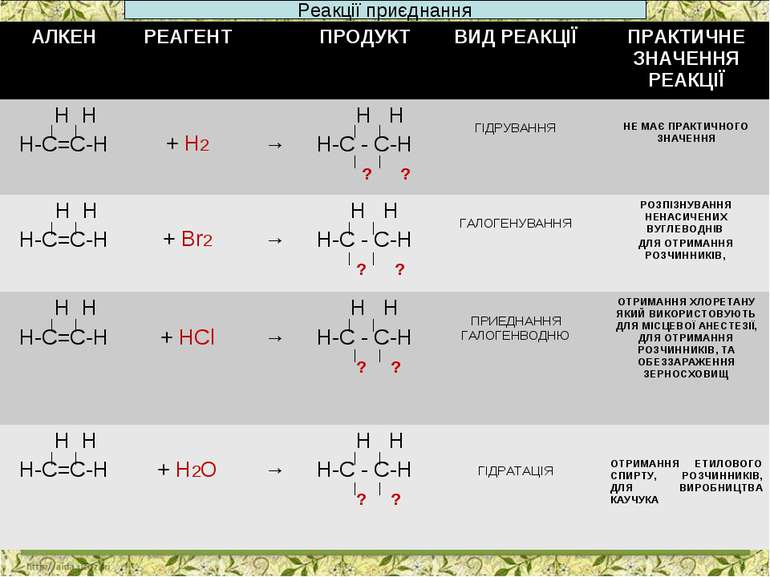
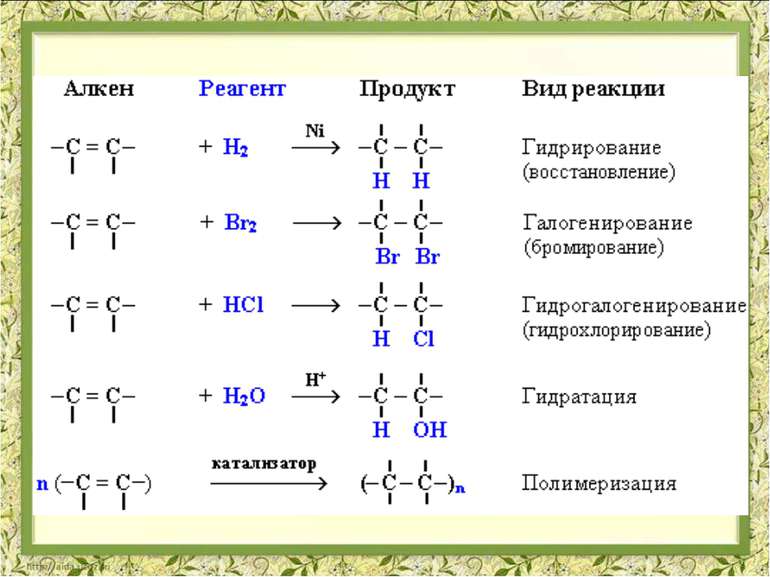
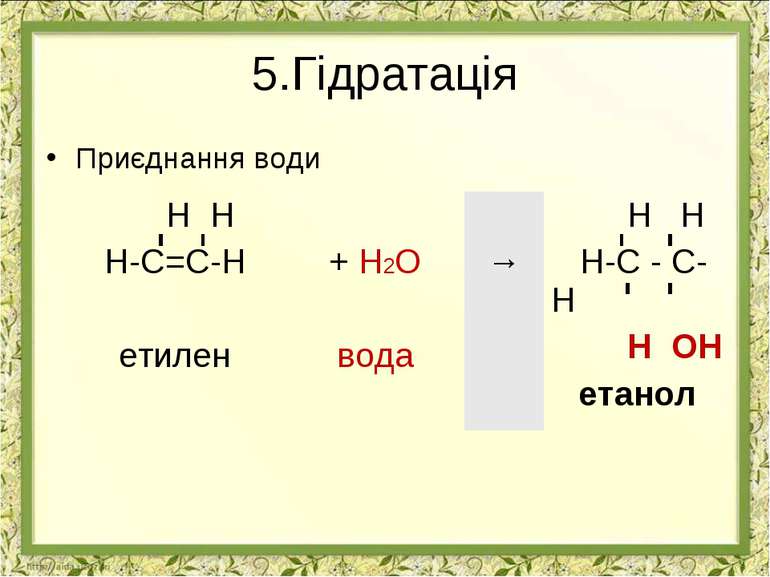
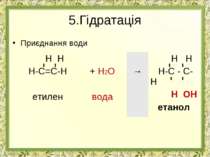
Реакції приєднання АЛКЕН РЕАГЕНТ ПРОДУКТ ВИД РЕАКЦІЇ ПРАКТИЧНЕ ЗНАЧЕННЯ РЕАКЦІЇ Н Н Н-С=С-Н + Н2 → Н Н Н-С - С-Н ? ? ГІДРУВАННЯ НЕ МАЄ ПРАКТИЧНОГО ЗНАЧЕННЯ Н Н Н-С=С-Н + Br2 → Н Н Н-С - С-Н ? ? ГАЛОГЕНУВАННЯ РОЗПІЗНУВАННЯ НЕНАСИЧЕНИХ ВУГЛЕВОДНІВ ДЛЯ ОТРИМАННЯ РОЗЧИННИКІВ, Н Н Н-С=С-Н + HCl → Н Н Н-С - С-Н ? ? ПРИЕДНАННЯ ГАЛОГЕНВОДНЮ ОТРИМАННЯ ХЛОРЕТАНУ ЯКИЙ ВИКОРИСТОВУЮТЬ ДЛЯ МІСЦЕВОЇ АНЕСТЕЗІЇ, ДЛЯ ОТРИМАННЯ РОЗЧИННИКІВ, ТА ОБЕЗЗАРАЖЕННЯ ЗЕРНОСХОВИЩ Н Н Н-С=С-Н + H2O → Н Н Н-С - С-Н ? ? ГІДРАТАЦІЯ ОТРИМАННЯ ЕТИЛОВОГО СПИРТУ, РОЗЧИННИКІВ, ДЛЯ ВИРОБНИЦТВА КАУЧУКА
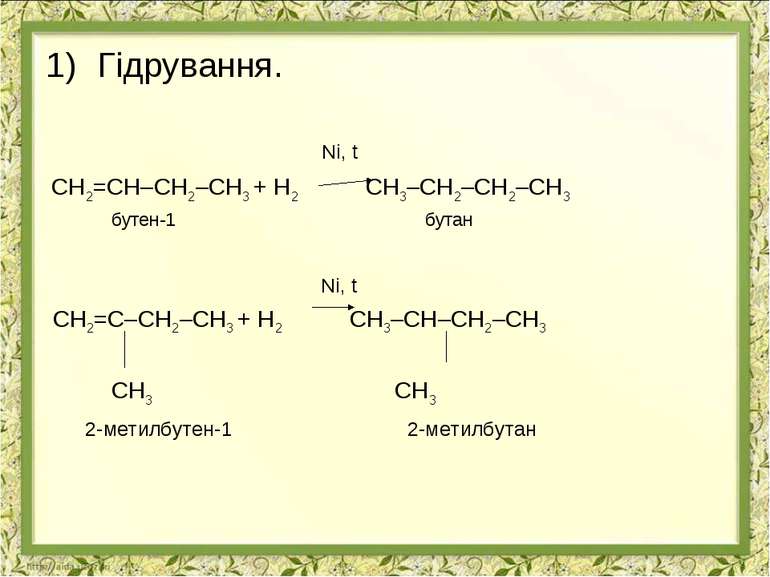
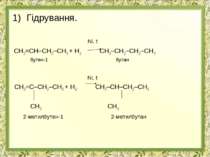
Гідрування. Ni, t СН2=СН–СН2–СН3 + Н2 СН3–СН2–СН2–СН3 бутен-1 бутан Ni, t СН2=С–СН2–СН3 + Н2 СН3–СН–СН2–СН3 СН3 СН3 2-метилбутен-1 2-метилбутан
4.Гідрогенгалогенування Правило Марковнікова Російський хімік-органік. В реакціях приеднання полярних молекул до несиметричних алкенів, водень приеднуеться до більш гідрогенізованого атому карбону при подвійному звязку . *
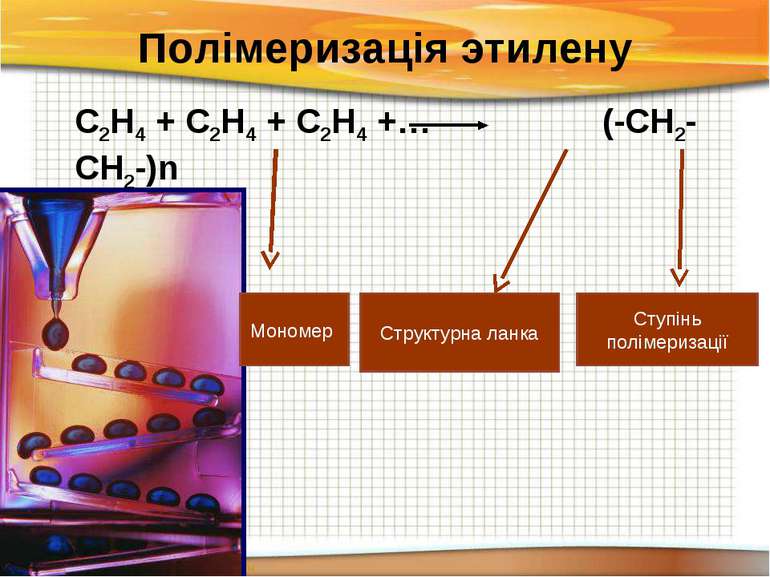
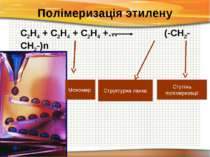
Полімеризація этилену С2Н4 + С2Н4 + С2Н4 +… (-СН2-СН2-)n Структурна ланка Ступінь полімеризації Мономер
Схожі презентації
Категорії