Презентація на тему:
Біогенні р елементи
Завантажити презентацію
Біогенні р елементи
Завантажити презентаціюПрезентація по слайдам:
БОР Бор очолює третю групу періодичної системи і є “типовим” для неї. Проте властивості бору відрізняються від його важких аналогів. Хімічні і фізичні властивості бору і його складних сполук, в склад яких він входить, зближують його не з алюмінієм, а з силіцієм (діагональна подібність). Тут діє правило діагоналі – спостерігається подібність у властивостях простих і складних сполук бору, який має менший розмір атома і менший ступінь окиснення (+3), і силіцію, який має більші розміри, але і більший ступінь окиснення (+4). Електронна оболонка бору має таку будову: 1s22s22p1. Як неметал, бор схильний утворювати ковалентні зв’язки. Для не збудженого атома бору характерна така електронна структура:
При утворенні хімічних сполук у атома бору проходять такі зміни – один електрон з 2s-енергетичного підрівня переходить на 2р-підрівень: В природі бор знаходиться в літосфері. Мінерал тинкал Na2B4O7 10H2O (бура) міститься у відкладах деяких озерах. Ортоборна кислота Н3ВО3 (летка) присутня в парах водяних джерел біля місць виверження вулканів. Відомі також мінерали, які містять різні поліборати: CaB4O7 4H2O – борокальцит; CaНBSiO5 – датоліт; Ca2B6O11 13H2O – інвоїт та інші.
Сполуки бору відомі з часів алхіміків. В ті часи застосування знаходила бура, яку, можливо, добували з озерних відкладів. Бор вперше отримав Гей-Люссак і Генар в 1808р. В залежності від умов синтезу одержують аморфний або кристалічний бор. Аморфний бор має вигляд коричневого порошку, кристалічний бор – сіро-чорний, з металічним блиском. Твердість кристалічного бору майже така як у алмазу. Аморфний бор отримують за реакціями: B2O3 + 3Mg 3MgO + 2B Na2B4O7 + 12Na 4B + 7Na2O Кристалічний бор отримують піролізом ВJ3, термолізом або відновленням BBr3 воднем на танталовій нитці при 1300-15000С, а також кристалізацією розплаву аморфного бору (наприклад, із розплаву Al) У промисловості бор добувають із природних боратів. Переробка колеманіту або інвоїту проводять лужним методом з видобутком бури:
2Ca2B6O11 + 4Na2CO3 + H2O 3Na2B4O7 + 4CaCO3 + 2NaOH Кислотний спосіб (переробки борациту) дає в якості кінцевого продукту ортоборну кислоту: Mg3B8O15 + 6HCl + 9H2O 8H3BO3 + 3MgCl2 Бор хімічно інертний. З киснем він реагує при температурі вищій за 7000С з утворенням борного ангідриду: 4В + 3О2 2В2О3. При ще вищій температурі бор реагує з азотом: 2B + N2 2BN, з хлором: 2B + 3Cl2 2BCl3. При високих температурах В відновлює різні оксиди (СО2, Р2О5), з металами взаємодіє з утворенням боридів. Розбавлені кислоти на бор не діють. Нітратна кислота окиснює бор до ортоборної кислоти. Сплавлення бору з лугами в присутності окисника приводить до одержання боратів. Перегріта водяна пара взаємодіючи з бором дає В2О3 і Н2: 2В + 3Н2О 3Н2 + В2О3.
Гідриди бору, або борани, мають склад, подібний із складом вуглеводнів. Так, отримані борани насиченого (BnH2n+2) і ненасиченого (BnHn) рядів. Борани отримують дією кислот і води на бориди деяких металів. Наприклад, так званий метод Штока заключається в обробці Mg3B2 або Be3B2 хлоридною кислотою: Mg3B2 + 6HCl B2H6 + 3MgCl2. Борани – безколірні гази і летючі рідини, рідше тверді речовини. Вони неприємно пахнуть, отруйні. По реакційній здатності борани схожі до силанів. На повітрі суміш боранів самозапалюється з утворенням Н2О і В2О3, а при їх взаємодії утворюється борна кислота і молекулярний водень: В2Н6 + 6Н2О 2Н3ВО3 + 3Н2 Іншим важливим проявом здатності боранів до донорно-акцепторного зв’язку є отримання борнітрогенових сполук. Прикладом може бути реакція: 3В2Н6 + 6NH3 2B3N3H6 + 12H2 (в скляній запаяній ампулі)
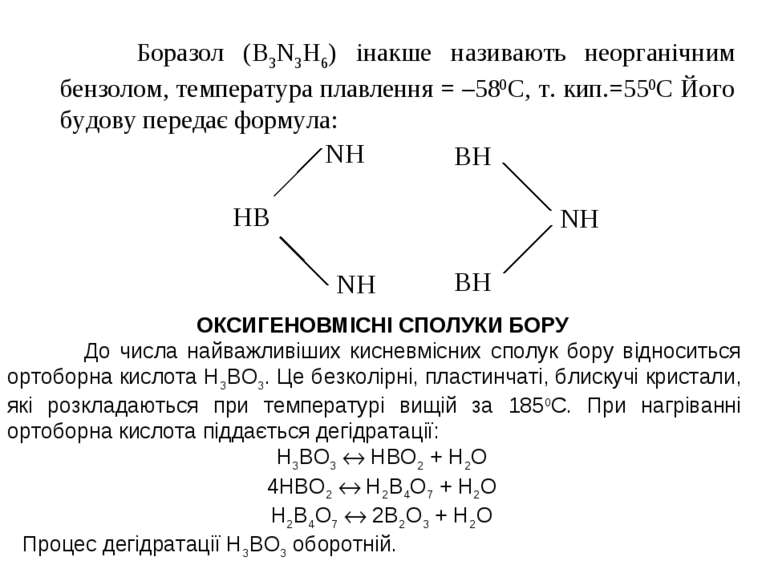
Боразол (B3N3H6) інакше називають неорганічним бензолом, температура плавлення = –580С, т. кип.=550С Його будову передає формула: ОКСИГЕНОВМІСНІ СПОЛУКИ БОРУ До числа найважливіших кисневмісних сполук бору відноситься ортоборна кислота Н3ВО3. Це безколірні, пластинчаті, блискучі кристали, які розкладаються при температурі вищій за 1850С. При нагріванні ортоборна кислота піддається дегідратації: Н3ВО3 НВО2 + Н2О 4НВО2 Н2В4О7 + Н2О Н2В4О7 2В2О3 + Н2О Процес дегідратації Н3ВО3 оборотній.
Пари борної кислоти зафарбовують полум’я у зелений колір. Ортоборна кислота являє собою типовий слабкий електроліт. Кислотні властивості виражені слабко. Раніше дисоціацію Н3ВО3 розглядали, як дисоціацію трьохосновної кислоти: Н3ВО3 Н+ + Н2ВО3– 2Н+ + НВО32– 3Н+ + ВО33– Відповідно константи кислотної дисоціації: К/=7.3 10–10, К//=2 10–13, К///=2 10–14. За сучасними даними борна кислота одноосновна. Вважають, що краще її будову передає формула В(ОН)3, а не Н3ВО3. Тому що, кислотність викликана не депротонізацією (відщепленням іону водню), а приєднанням гідроксильного іону із води: В(ОН)3 + Н2О В(ОН)4– + Н+
На відміну від дуже слабкої ортоборної кислоти тетраборна кислота Н2В4О7 проявляє властивості кислоти,по силі рівній оцтовій кислоті: К/=2 10–4, К//=2 10–5. Це дозволяє розглядати кислотні властивості тетраборної кислоти як результат звичайної депротонізації: Н2В4О7 2Н+ + В4О72–. Різниця у величинах 1 і 2 констант дисоціації у Н2В4О7 складає лише один порядок. Тому відщеплення першого і другого протонів проходить майже одночасно, внаслідок чого утворюються лише двозаміщені солі типу бури Na2B4O7. Солі борних кислот – борати – мають різний склад в залежності від мольного співвідношення в тому чи іншому бораті оксидів лужного металу і бору: Ортоборати Na3ВО3, або 3Na2О В2О3 Метаборати NaВО2, або Na2О В2О3 Тетраборати Na2В4О7, або Na2О 2В2О3
Бор утворює всі чотири тригалогеніди. При звичайних умовах це газоподібні речовини або легкоплавкі рідини. Всі тригалогеніду бору мають структуру плоского трикутника з атомом бору в центрі. Тригалогеніди добувають: 2B + 3F2 2BF3 B2O3 + 3C + 3Cl2 2BCl3 + 3CO. Галогеніди бору при гідролізі утворюють дві кислоти: BCl3 + 3H2O B(OH)3 + 3HCl 2BF3 + 3H2O B(OH)3 + HBF4 + 2HF. Тетрафтороборна кислота сильніша за плавикову (HF). При спробі виділити HBF4 з розчину вона розпадається на HF і BF3. Проте солі тетрафтороборної кислоти – тетрафтороборати – стійкі.
АЛЮМІНІЙ Типовим елементом-металом ІІІ групи є алюміній. Його легкий аналог – бор відноситься до елементів-неметалів. Важкими аналогами алюмінію є скандій, ітрій, лантан і лантаніди (лантаноїди) – 17 елементів, які об’єднують під загальною назвою рідкоземельні елементи. Назва “алюміній” італійського походження: біля італійського міста Чівітавек’я знайдено поклади мінералу алуніту (Na, K)2SO4 Al2(SO4)3. Прожарюванням алуніта одержували квасці K2SO4 Al2(SO4)3 24H2O. Римляни квасці називали alumen, звідси – алюміній. Алюміній – непарний елемент, його порядковий номер 13. В алюмінію є один стабільний ізотоп 2713Al, всі інші – радіоактивні. 2713Al має цінні властивості для атомної техніки – малу площу захоплення нейтронів. 27Al притаманні ядерні характеристики, які дають можливості застосовувати металічний алюміній і його сполуки для “упакування” матеріалів, які діляться, в тепловиділяючих елементах ядерних реакторів.
Основним джерелом для виробництва алюмінію є мінерал боксит (гідроксид алюмінію), частково дегідратований. Боксит – осадова порода. Його склад описується формулою Al2O3 zH2O (z 2). Велика кількість алюмінію входить до складу різновидностей глини (вторинний мінерал). Основою глини є каолініт Al2O3 2SiO2 2H2O. Алюміній відноситься до р-елементів, оскільки один з валентних електронів починає формувати 3р-підрівень. Завдяки невеликим розмірам і великому позитивному заряду, який несе іон Al3+, він є сильним поляризатором. Саме тому в сполуках Al3+– атом (іон), що поляризується, домінує ковалентний тип хімічного зв’язку, а в сполуках Al3+– аніони, які мало поляризуються – іонний. Al3+– сильний комплексоутворювач. Проста речовина алюміній являє собою сріблясто-білий метал, дуже легкий (питома маса = 2.7 г/см3), легкоплавкий (т.пл=6580С). Алюміній в чистому вигляді – м’який метал, який витримує навантаження 6 кг/см2.
Алюміній, взаємодіючи з водою, витісняє водень: 2Al + 6H2O 2Al(OH)3 + 3H2 На поверхні алюмінію є оксидна плівка: 4Al + 3O2 2Al2O3 Завдяки високій спорідненості металічного Al до кисню, алюміній має яскраво виражені відновні властивості. Бекетов запропонував ще в 60-х роках минулого століття використовувати порошок алюмінію для відновлення металів із оксидів (алюмотермія). Al взаємодіє з водою в присутності лугів: Al + 3H2O Al(OH)3 + 3/2H2 Утворення розчинних гідрокомплексів зміщує рівновагу такої реакції вправо і прискорює її протікання: Al(OH)3 + KOH K[Al(OH)4]
Добування металічного алюмінію електрохімічним методом Технологічна стадія підготовки сировини: 1)очищення бокситу Al2O3 zH2O від домішок заліза і SiO2; 2) очищений розчин алюмінату натрію розбавляють водою для гідролізу: Na[Al(OH)4] + H2O NaOH + Al(OH)3 і піддають “викручуванню”; 3) фільтрація кристалічного гідроксиду Al(OH)3 aq і термічна обробка при температурі 1100-12000С Al2O3; 4) електроліз Al2O3 (проводять при температурі 900-9500С; склад електроліту: 85-90% Na3AlF6, 10-15% Al2O3, сила струму 130000 А, напруга 4-5В) з метою одержання металічного алюмінію.
Складні сполуки алюмінію Типовими кисневими сполуками Al (III) є оксид алюмінію Al2O3; гідроксид алюмінію Al(OH)3 і алюмінати. Оксид алюмінію (ІІІ) має кілька кристалічних модифікацій. Найважливіша модифікація - Al2O3 – корунд. Він плавиться при 20700С і кипить при 35000С. За шкалою Мооса твердість корунду 9. Хімічна інертність висока, що дозволяє використовувати корундові тиглі при проведенні лабораторних експериментів в жорстких умовах. Сильно прожарений корунд майже не взаємодіє з водою. Al2O3 належить до класичних амфотерних оксидів і дає два види сполук: 1) солі, в яких Al (ІІІ) виконує роль катіона; 2) алюмінати, де Al (ІІІ) виконує роль аніоноутворювача.
Гідроксид алюмінію (ІІІ) добувають взаємодією розчинних солей Al(III) з аміаком: Al2(SO4)3 + 6NH4OH 2Al(OH)3 + 3(NH4)2SO4 Луги для синтезу Al(OH)3 не застосовують через небезпеку утворення розчинів алюмінатів при дуже високому рН. Гідроксид Al(OH)3 погано розчиняється у воді, через його полімеризацію. При зберіганні відбувається “старіння” внаслідок протікання процесів оляції і оксоляції: [Al(OH)3]n [AlO(OH)]n + nH2O [AlO(OH)]n 1/2nAl2O3 + 1/2nH2O Старіння Al(OH)3 супроводжується зменшенням реакційної здатності. Гідроксид Al(OH)3 розчиняється в кислотах і лугах, що свідчить про його амфотерність. Розчинення в кислотах є наслідком процесу нейтралізації: 2Al(OH)3 + 3H2SO4 Al2(SO4)3 + 6H2O
Розчинення в лугах є наслідком процесу комплексоутворення, причому іони гідроксилу виконують роль ліганду: Al(OH)3 + KOH K[Al(OH)4] або Al(OH)3 + 3KOH K3[Al(OH)6] Склад алюмінатів в розчині спрощено виражають формулами MеAlO2, Mе3AlO3 і т.д. Алюмінати типу МеАlO2 утворюються при спіканні гідратованого в розчині Al(OH)3 з лугами або содою: 2Al(OH)3 + Na2CO3 2NaAlO2 + CO2 + 3H2O Алюмінати, які синтезували шляхом спікання, під дією води перетворюються в гідроксоалюмінати: NaAlO2 + 4H2O Na[Al(OH)4(H2O)2]
Солі алюмінію (ІІІ) Безводні солі алюмінію за властивостями і будовою відрізняються від відповідних гідратів. Наприклад, хлорид Al (ІІІ), який в безводному стані більш схожий на хлорангідрид, чим на сіль; безводний AlCl3 характеризується координаційним числом 4, димер. Розчиняючись у воді, галогеніди Al (ІІІ) піддаються гідролізу. При нагріванні відповідних гідратів відбувається гідроліз: [Al(H2O)6]Cl3 Al(OH)3 + 3HCl + 3H2O з поступовим перетворенням Al(ОН)3 в Al2О3. Солі Al (ІІІ), утворені слабкими кислотами, піддаються гідролізу, й існувати в гідратованому стані не можуть. Із водних розчинів, які містять, наприклад, AlCl3 i Na2S сульфід алюмінію добути не можливо. Дійсно, AlCl3 i Na2S, сумісно перебуваючи у водному розчині, “доводять” гідроліз один одного до кінця, і сульфід Al2S3 не утворюється: 2AlCl3 + 3Na2S + 6H2O 2Al(OH)3 + 3H2S + 6NaCl
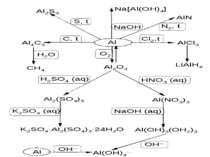
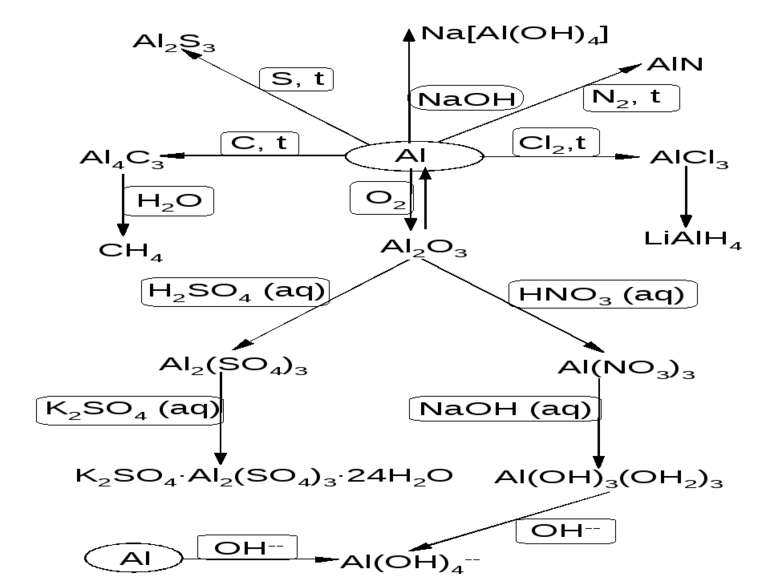
Бінарні сполуки Al AlCl3 + 3LiH AlH3 + 3LiCl; 4LiH + AlCl3 Li[AlH4] + 3LiCl; Li[AlH4] + 4H2O 4H2 + LiOH + Al(OH)3; Al2O3 + 3Si 2SiO + Al2O (Al2O – газоподібна речовина, реакція проходить при 18000С); AlCl3 + 2Al 3AlCl; AlN + 2NaOH + 6H2O 2Na[Al(OH)4] + 2NH3; AlP + 3H2O Al(OH)3 + PH3; Схема деяких реакцій Al
Алюміній відноситься до ІІІ аналітичної групи катіонів. Для визначення Al3+ використовують реакції утворення важкорозчинних сполук: 2AlCl3 + 3(NH4)2S + 6H2O 2Al(OH)3 + 3H2S + 6NH4Cl – білий осад; AlCl3 + 3NaOH Al(OH)3 + 3NaCl; Na2CO3 + 2AlCl3 + 3H2O 2Al(OH)3 + 6NaCl + 3CO2; AlCl3 + CH3COONa (CH3COO)3Al + 3NaCl (CH3COO)3Al + HOH (CH3COO)2AlOH + CH3COOH; Al2(SO4)3 + 3Na2S2O3 + 3H2O 2Al(OH)3 + 3Na2SO4 + 3S + 3SO2; AlCl3 + Na2HPO4 AlPO4 + NaH2PO4 + 3NaCl; Алізарин із іонами Al3+ утворює комплексну сполуку червоного кольору AlOH[C14H6O3(OH)2] – алюмінієвий лак; Алюмінон із іонами Al3+ утворює комплексну сполуку червоного кольору; Морин з іонами Al3+ у нейтральному або оцтовокислому розчині утворює флуоресціюючу сполуку зеленого кольору.
КАРБОН Карбон – типовий елемент IV групи періодичної системи. Карбон – парний елемент, атомна маса домінуючого стабільного ізотопу Характеристика карбону Біологічна роль Поширеність Геологічні відомості Входить в склад ДНК. Вміст в організмі людини: м язи – 67%, кістки – 36%. Щоденно з їжею споживається 300г вуглецю. Звичайно С не токсичний. Проте токсичний у формі СО і ціанідів (СN–). Вміст в організмі середньої людини: 16 кг. Сонце (відносно Н=1 1012): 4.17 108. Земна кора–4.8 10–2 %, Морська вода: в поверхневих шарах 26 10–4. Час перебування: 8 106 років. Ступінь окиснення: IV. Атмосфера, в % по об’єму: СО2 – 3.35 10–2, СО – 0.02 10–4, СН4 – 1.7 10–4. Основні мінерали і джерела: вапняк СаСО3, вугілля, нафта, природний газ, деякі природні модифікаційні форми вуглецю як графіт і алмаз. Запаси: природний газ 110 1012 м3, вугілля 1.1 1012 т, нафта – 1.1 1011
Вуглець за здатністю до хімічної взаємодії належить до малоактивних речовин: з більшістю реагентів він вступає в реакцію при підвищеній температурі. Лише з фтором вуглець реагує при звичайній температурі. Інші неметали, наприклад О2, Н2, S8 та інші реагують лише при нагріванні: 2С + 2Н2 С2Н4 (t>14000C) 2С + Н2 С2Н2 (t>30000C) С + S2 CS2 (t>9000C) На відміну від фтору, хлор і його важкі аналоги безпосередньо з вуглецем не взаємодіють. Галогенопохідні вуглецю отримують непрямим синтезом. З більшістю металів вуглець при нагріванні утворює сполуки – карбіди (Fe3C, Al4C3, Cr3C2).
Сполуки карбону з оксигеном Вуглекислий газ (оксид карбону (IV)) – за звичайних умов газ з формулою СО2. Твердий, рідкий і газоподібний СО2 безколірні. Для одержання великих кількостей вугільного ангідриду звичайно використовують реакції окиснення вуглецю, а також термоліз природних карбонатів: доломіту, вапняку або інших органічних речовин. В лабораторіях звичайно використовують СО2 із балонів, де він знаходиться у стиснутому стані. Інколи СО2 отримують в апараті Кіппа дією кислот на нерозчинні у воді карбонати (СаСО3 + 2НCl СaCl2 + CO2 + H2O).
Вугільний ангідрид (оксид карбону (IV)) – стійка хімічна сполука, з теплотою утворення 90 ккал/моль, тому він тяжко піддається термічному розкладу і в хімічному плані досить інертний. Дерево у атмосфері СО2 не горить, дихання СО2 також не підтримує. Але якщо використати активний метал, то СО2 розкласти можливо. Так, стрічка магнію, яка горить на повітрі продовжує горіти в атмосфері СО2: 2Mg + CO2 2MgO + C. Молекули СО2 мають лінійну структуру, що вказує на sp-гібридизацію атома карбону. Лінійна будова молекули СО2 пояснює низьку полярність, а отже і погану розчинність у воді.
В звичайних умовах водні розчини, які знаходяться у рівновазі з СО2 атмосфери, мають [CO2] = 0.04 М і рН = 4. В розчині протікає наступна реакція утворення вугільної кислоти Н2СО3: СО2 + Н2О Н2СО3 Н+ + НСО3– 2Н+ + СО32–. Таким чином вугільна кислота в розчинах дає слабо кисле середовище, і змінює колір індикатора. Оскільки К’дис і К’’дис Н2СО3 різні, то вугільна кислота може утворити два ряди солей: середні і кислі. Наприклад, основі NaOH відповідають карбонат і гідрокарбонат натрію Na2CO3 і NaHCO3. Карбонат-іони, що попадають у розчин, піддаються гідролізу: Na2CO3 + H2O NaOH + NaHCO3. В скороченій іонній формі це рівняння записується так: СО32– + Н2О ОН– + НСО3 –.
Таким чином, гідроліз соди зумовлює лужне середовище її розчину (рН=10). Розчинення гідрогенкарбонатів лужних металів у воді також супроводжується гідролізом: НСО3– + Н2О Н2СО3 + ОН–, але в значно меншій мірі, ніж для середніх карбонатів. Окрім середніх і кислих карбонатів відомі основні карбонати. Прикладом може бути основний карбонат міді (природний мінерал аналогічного складу – малахіт), який отримують за обмінною реакцією, яка супроводжується як гідролізом катіона, так і аніона: 2CuSO4 + 3Na2CO3 + 2H2O Cu(OH)2 CuCO3 + 2NaHCO3 + 2Na2SO4.
У промисловості найбільше використовують середній карбонат натрію. Для його добування у наш час широко використовують метод Сольве, який базується на насичені газоподібним СО2 “розсолу” – водного розчину NaCl, з добавкою аміаку: СаСО3 СаО + СО2 NaCl + CO2 + NH3 + H2O NaHCO3 + NH4Cl 2NaHCO3 Na2CO3 + H2O + CO2 2NH4Cl + CaO NH3 H2O + CaCl2 Аміак при добуванні соди необхідний для створення нейтрального, або слабко лужного середовища. Інакше гідрокарбонат натрію в осад випадати не буде. Поташ – середній карбонат калію. К2СО3 добувають за реакцією: 2КОН + СО2 К2СО3 + Н2О.
Оксид карбону (ІІ) СО за звичайних умов – газ без кольору і запаху. Утворюється СО при дії відновників на СО2: СО2 + С 2СО (при 8000С) С + Н2О СО + Н2 НСООН СО + Н2О (1000С, H2SO4) Суміш СО і Н2 називають водяним газом. Суміші СО і Н2 певного складу вибухонебезпечні. Оксид вуглецю (ІІ) має нижчі величини температури плавлення і кипіння, чим СО2. Слабку міжмолекулярну взаємодію в СО можна пояснити незначним дипольним моментом. Внаслідок малої полярності СО майже не взаємодіє з водою, хоча формально, оксид карбону (ІІ) – ангідрид мурашиної кислоти. Для СО характерні реакції приєднання (взаємодія з киснем, хлором). Значна реакційна здатність СО поєднується зі значною стійкістю зв’язку С–О.
Відомий ще один великий клас неорганічних карбонвмісних сполук – карбоніли. Карбонілами називають сполуки, які містять атоми металу і молекули СО. Утворення карбонілів характерне лише для перехідних металів. Леткі карбоніли токсичні і легко утворюють вибухові суміші з повітрям (наприклад, Fe(CO)5, Ni(CO)4). Сполуки вуглецю з металами називають карбідами. Найчастіше іонні карбіди отримують взаємодією оксидів металів з вуглецем (наприклад, з графітом) при високій температурі: СаО + 3С СаС2 + СО 2Al2O3 + 9C Al4C3 + 6CO.
Ацетиленіди CuC2 і Ag2C2 синтезують, пропускаючи потік ацетилену С2Н2 через розчин відповідних солей. Ацетиленіди вибухонебезпечні. При гідролізі ацетеленідів виділяється С2Н2. H–С C–Н + 2Cu+ Cu–C C–Cu + 2H+ Металоподібні карбіди отримують безпосередньою взаємодією металу з вуглецем при високій температурі в електропечах: 3Fe + C Fe3C. Визначення вугільної кислоти і карбонат-іону СО32–: CO32– + Ba2+ BaCO3 – білий об′ємистий осад; CO32– + 2Ag+ Ag2CO3 – сполука білого кольору Ag2CO3 + H2O 2AgOH + H2CO3 (H2O + CO2 ) 2AgOH Ag2O + H2O – коричневий осад; СaCO3 + 2HCl CaCl2 + H2CO3 (H2O + CO2 ) Ba(OH)2 + CO2 BaCO3 + H2O – білий осад.
Деякі схеми реакцій в які вступає вуглець та його сполуки C + H2SO4 CO2 + 2SO2 + 2H2O 2C + H2 + N2 2HCN 2C + Na2SO4 Na2S + 2CO2 3C + 8H2SO4 + 2K2Cr2O7 3CO2 + 2Cr2(SO4)3 + 2K2SO4 + 8H2O CO + NaOH Na(HCOO) (t=120-1300C, p) CO2 + NaOH(розв) NaHCO3 CO2 + 2NaOH(конц) Na2CO3 + H2O CO2 + 2Mg C + 2MgO
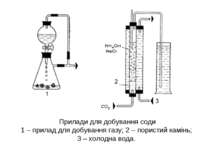
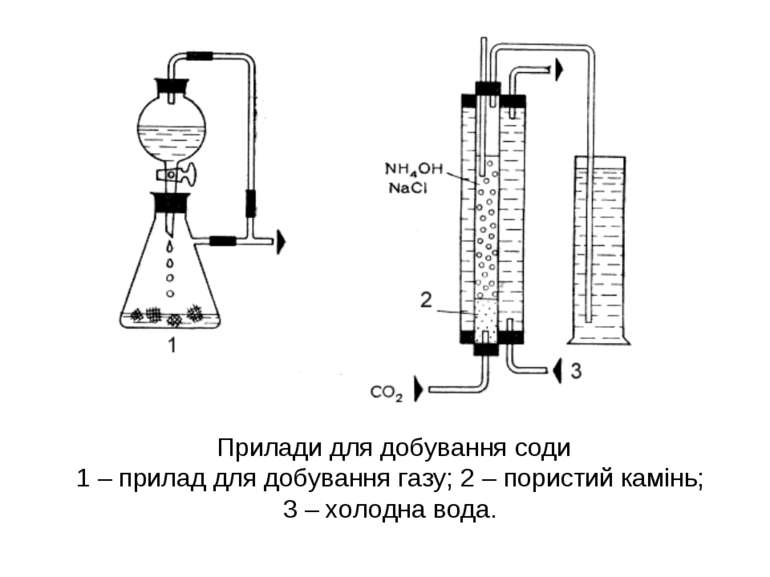
Прилади для добування соди 1 – прилад для добування газу; 2 – пористий камінь; 3 – холодна вода.
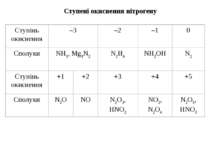
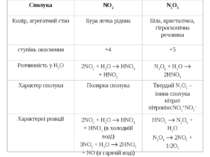
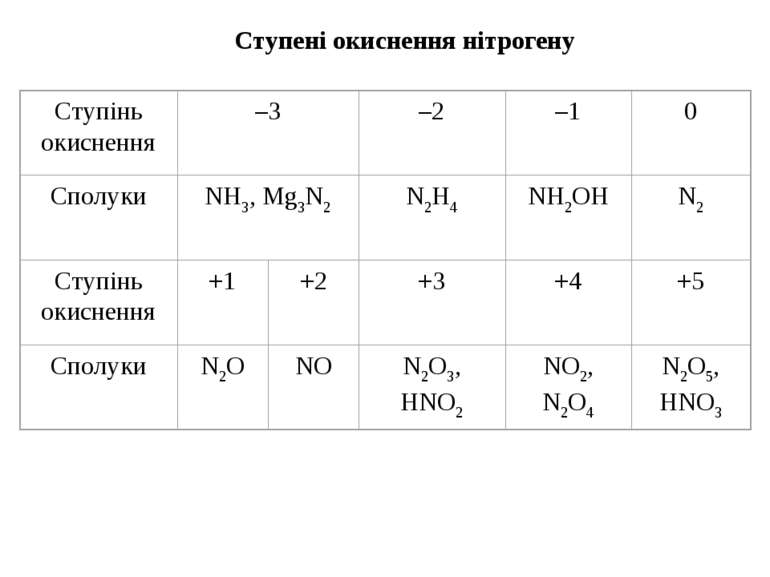
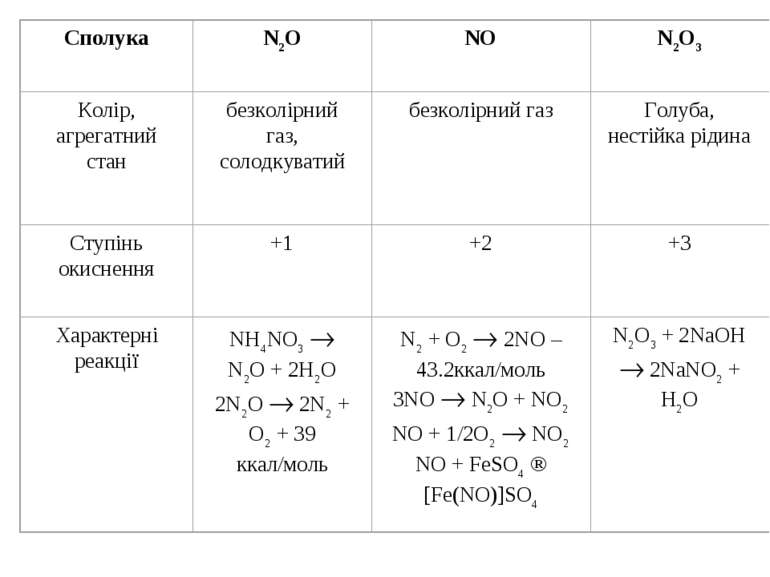
НІТРОГЕН Нітроген (той, що не підтримує життя) очолює V групу головну підгрупу періодичної системи. Він був відкритий Д. Резерфордом у 1772 р. Азот – газ без кольору і без запаху. При кімнатній температурі має низьку реакційну здатність. Утворює велику кількість органічних і неорганічних сполук. Використовується для виробництва мінеральних добрив, кислот, вибухових речовин, пластмас. Нітроген – елемент «непарний». Природна плеяда стабільних ізотопів нітрогену складається із двох компонентів: ізотопу 147N(>99%) і ізотопу 157N (0.38%). З точки зору ядерних властивостей нітроген дуже своєрідний. Оскільки це непарний елемент, то у відповідності із закономірністю, він повинен утворювати атомні ядра, що мають загальну формулу 4n+3 або 4n+1. Але для азоту накладається друге правило – у легких елементів протони й нейтрони, які утворюють атомні ядра, прагнуть з’єднатися в рівних кількостях. Ізотоп 14N повністю відповідає цьому співвідношенню. Крім стабільних, нітроген утворює й радіоактивні ізотопи, наприклад, ізотоп 13N зазнає позитронного розпаду (Т1/2=9.93’). Ще менш стійкий ізотоп 16N, який при радіоактивному розпаді викидає b-частинки (Т1/2 = 8’’). Інертність атмосферного азоту пов’язана з утворенням стійких молекул N2.
ООскільки зв’язок в молекулі N2 ковалентний неполярний, то азот погано розчиняється в полярних розчинниках. Молекулярний азот має низькі температури плавлення і кипіння через незначну міжмолекулярну взаємодію. ДДобування N2 ¨ 4N2 + O2 + C 4N2 + CO2 (4N2 + O2 – повітря) ¨ 4N2 + O2 + 2Cu 4N2 + 2CuO ¨ NH3 + 3O2 2N2 + 6H2O ¨ NH3 + HNO2 NH4NO2 N2 + 2H2O ¨ 2NH3 + 3Cl2 N2 + 6HCl
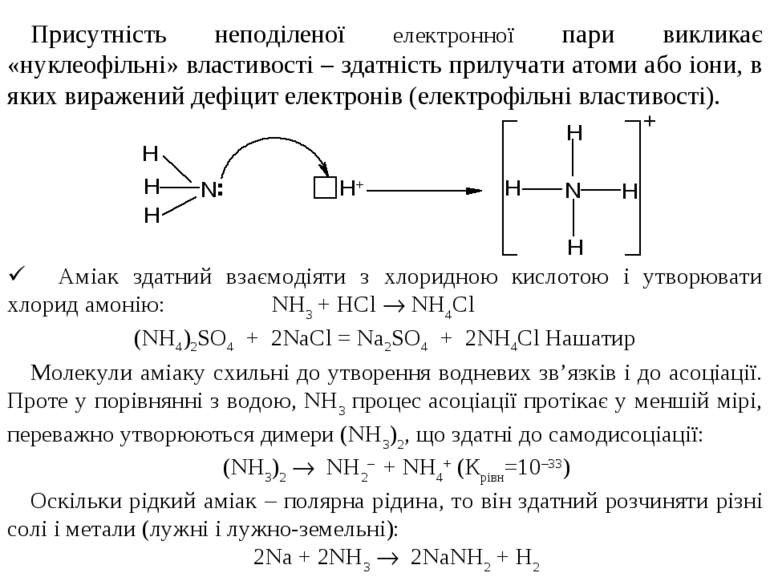
Сполуки N–3 Аміак утворюється в результаті виникнення трьох ковалентних зв’язків між атомами нітрогену і трьома атомами гідрогену. Молекула аміаку являє собою трикутну піраміду з атомом нітрогену при вершині. Просторову структуру молекули можна пояснити наявністю неподіленої електронної пари:
Присутність неподіленої електронної пари викликає «нуклеофільні» властивості – здатність прилучати атоми або іони, в яких виражений дефіцит електронів (електрофільні властивості). Молекули аміаку схильні до утворення водневих зв’язків і до асоціації. Проте у порівнянні з водою, NH3 процес асоціації протікає у меншій мірі, переважно утворюються димери (NH3)2, що здатні до самодисоціації: (NH3)2 NH2– + NH4+ (Крівн=10–33) Оскільки рідкий аміак – полярна рідина, то він здатний розчиняти різні солі і метали (лужні і лужно-земельні): 2Na + 2NH3 2NaNH2 + H2 ü Аміак здатний взаємодіяти з хлоридною кислотою і утворювати хлорид амонію: NH3 + HCl NH4Cl (NH4)2SO4 + 2NаCl = Nа2SO4 + 2NH4Cl Нашатир
Аміак проявляє відновні властивості, тобто він здатний окиснюватися. ü При підвищеній температурі в атмосфері кисню аміак горить: NH3 + 3/2O2 1/2N2 + 3/2H2O 2NH3 + 5/2O2 2NO + 3/2H2O (Pt – каталізатор) 2NH3 + 2O2 NH4NO3 + H2O ü Аміак та солі амонію окиснюється не тільки при дії кисню, але і при взаємодії з іншими реагентами: 3CuO + 2NH3 3Cu + 3H2O + N2 2NH3 + 3Cl2 N2 + 6HCl 2NH3 + 3Br2 N2 + 6HBr ü 6NH4NO3 + 3MnO2 3Mn(NO3)2 + N2 + 4NH3 + 6H2O (t
ü Розкладання карбонату амонію протікає за звичайних умов. І тому в нещільно закритій банці він досить швидко випаровується: NH4HCO3 NH3 + H2O + CO2 (NH4)2CO3 2NH3 + H2O + CO2 (NH4)2HPO4 2NH3 + H3PO4 (t, 0C) (NH4)H2PO4 NH3 + H2O + HPO4 ü Для термолізу солей амонію і окиснюючих кислот характерна окисно-відновна взаємодія: 3(NH4)2SO4 N2 + 3SO2 + 6H2O + 4NH3 NH4NO3 N2O + 2H2O NH4NO2 N2 + 2H2O (NH4)2Cr2O7 N2 + Cr2O3 + 4H2O (“вулканічний попіл”) Нітриди – це сполуки Нітрогену з металами та неметалами, що утворюються при високих температурах N2 + Mg Mg3N2 N2 + 2B 2BN Нітриди лужних, лужноземельних металів та галогенів гідролізують Cl3N + 3HOH 3HClO + NH3
Гідразин N2H4 (NH2–NH2) можна розглядати як продукт заміщення одного із атома водню на аміногрупу NH2 2NH3 + NaOCl N2H4 + NaCl + H2O Гідразин термодинамічно не стійкий: NN2 + 2H2 N2H4; DH0=12 ккал/моль NN2H4 + O2 N2 + 2H2O; DH0 = –148.6 ккал/моль Гідразин в кислих середовищах здатний приєднувати протони: NN2H4 + H+ NH3+NH2 ü Гідразин вступає в окиснювально-відновні процеси: 6N2H4 + 4KJO3 6N2 + 4KJ + 12H2O
Гідроксиламін NH2OH отримують відновленням нітратів або нітритів, а також NO2 або HNO3 дією SO2 або в солянокислому розчині в присутності каталізатора: HNO3 + 6e + 6H+ NH2OH + 2H2O Гідроксиламін – безколірна кристалічна речовина, Тпл=330С, що легко розкладається в результаті реакції самоокиснення-самовідновлення: 3 NH2OH NH3 + N2 + 3H2O NH2OH може бути як окисником так і відновником: 2NH2OH + J2 + 2KOH N2 + 2KJ + 4H2O
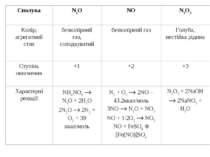
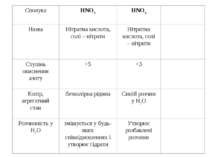
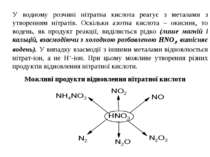
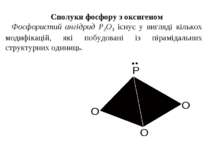
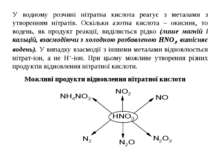
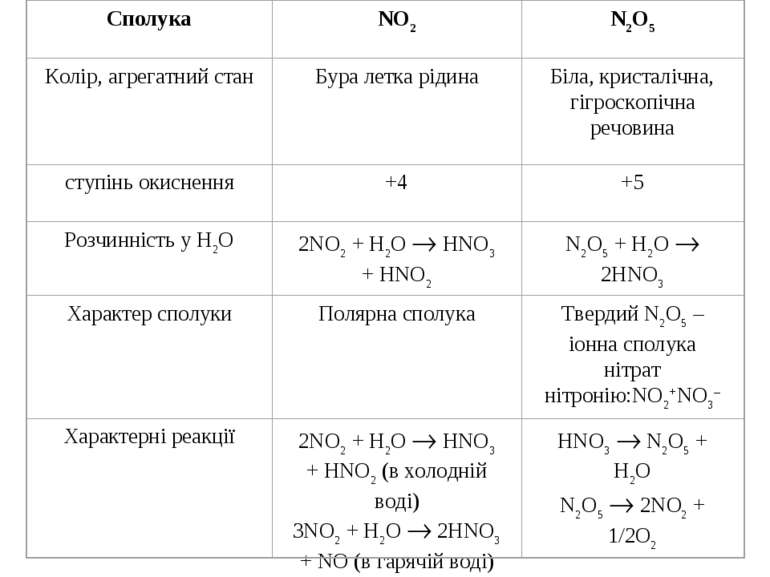
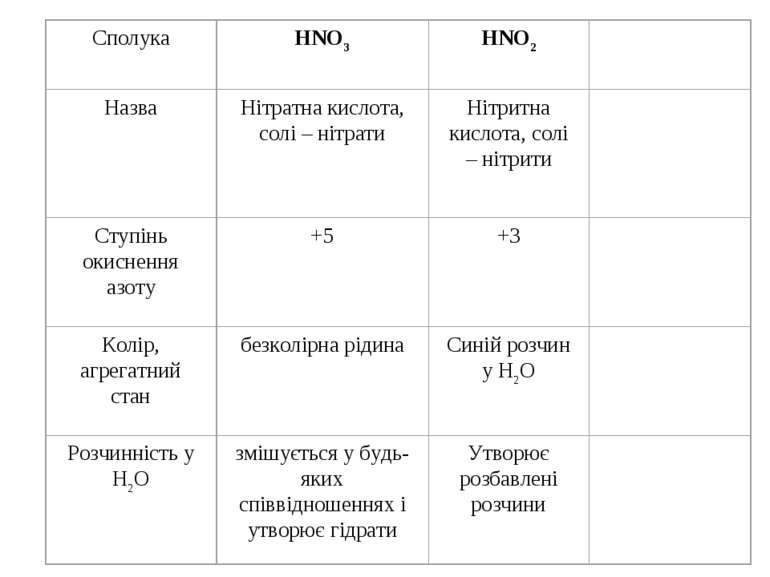
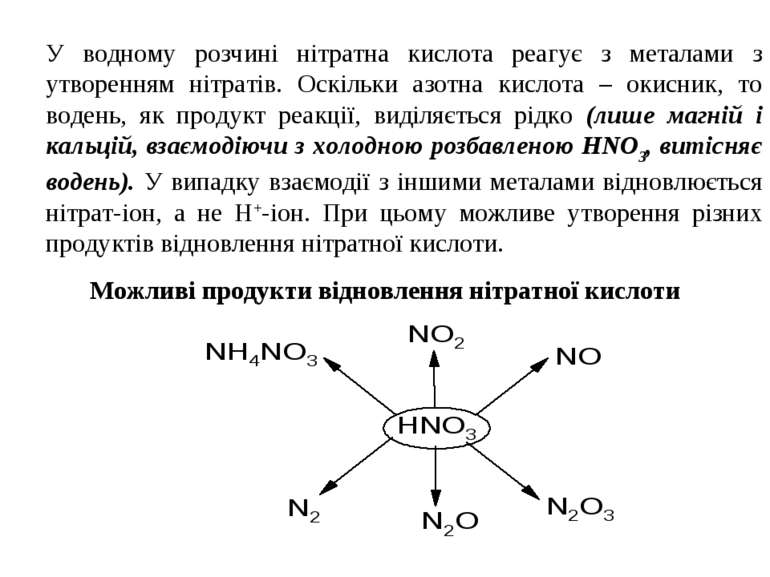
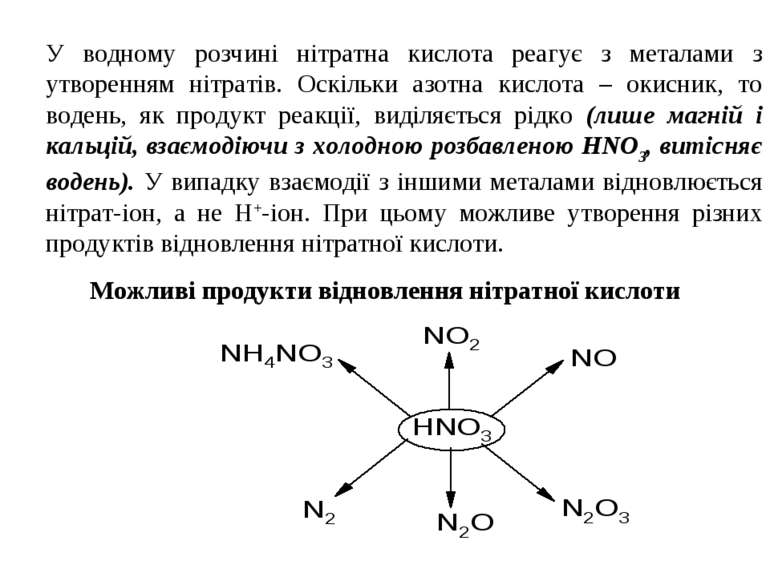
У водному розчині нітратна кислота реагує з металами з утворенням нітратів. Оскільки азотна кислота – окисник, то водень, як продукт реакції, виділяється рідко (лише магній і кальцій, взаємодіючи з холодною розбавленою HNO3, витісняє водень). У випадку взаємодії з іншими металами відновлюється нітрат-іон, а не Н+-іон. При цьому можливе утворення різних продуктів відновлення нітратної кислоти. Можливі продукти відновлення нітратної кислоти
¨ HNO3 + H2SO4 NO2+ + HSO4– + H2O нітруюча суміш ¨ HNO3 + 3HCl 2H2O + 2Cl + NOCl “царська горілка” ¨ HNO3 + KOH KNO3 + H2O ¨ 8HNO3 + 3Cu 3Cu(NO3)2 + 2NO + 4H2O ¨ 4HNO3 + C CO2 + 4NO2 + 2H2O + Q 4Sn + 10HNO3 4Sn(NO3)2 + NH4NO3 + 3H2O
¨ HNO3 + H2SO4 NO2+ + HSO4– + H2O нітруюча суміш ¨ HNO3 + 3HCl 2H2O + 2Cl + NOCl “царська горілка” ¨ HNO3 + KOH KNO3 + H2O ¨ 8HNO3 + 3Cu 3Cu(NO3)2 + 2NO + 4H2O ¨ 4HNO3 + C CO2 + 4NO2 + 2H2O + Q 4Sn + 10HNO3 4Sn(NO3)2 + NH4NO3 + 3H2O
4. Є ряд речовин, які не можна погасити струменем СО2. В першу чергу це суміші, які містять твердий окисник: для їх горіння не потрібно кисню повітря. Наприклад, чорний порох (суміш KNO3, S і C) горить за рахунок твердого окисника – нітрату калію: 2KNO3 + S SO2 + 2KNO2; 2KNO3 + C CO2 + 2KNO2. Сумарна реакція горіння чорного пороху: І варіант: 2KNO3 + S + 3C K2S + N2 + 3CO2 II варіант: 4KNO3 + 2S + 3C K2SO4 + K2CO3 + 2N2 + SO2 + CO2 + CO
Визначення солей амонію NН4+: NH4+ + NаOH Nа+ + H2O + NH3 (пари аміаку визначають змоченим лакмусовим папірцем) 2K2HgJ4 + 3KOH + NH4OH = 7KJ + 3H2O + O Hg-JHg – NH2 Визначення нітратної кислоти та нітрат-іону NO3–: 2NO3– + 3Cu + 8H+ 3Cu2+ + 2NO + 4H2O 2NO + O2 2NO2 – бурі пари оксидів азоту; 3Fe2+ + NO3– + 4H+ 3Fe3+ + NO + 2H2O Fe2+ + NO [Fe(NO)]2+ – сполука темно-коричневого кольору; 3NO3– + 8Al + 5OH– + 2H2O 8AlO2– + 3NH3 NO3– + 4Zn + 3OH– + 2H2O 4HZnO2– + NH3
А Визначення нітритної кислоти та нітрит-іону NO2–: ¨ NaNO2 + H2SO4 NaHSO4 + HNO2 3HNO2 HNO3 + 2NO + H2O 2NO + O2 2NO2; ¨ NO2– + Ag+ AgNO2 – білі кристалічні голки; ¨ NO2– + 2Al + OH– + H2O 2AlO2– + NH3 ¨ 2NO2– + 2J– + 4H+ J2 + 2NO + 2H2O
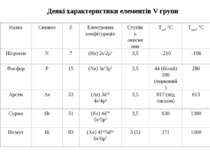
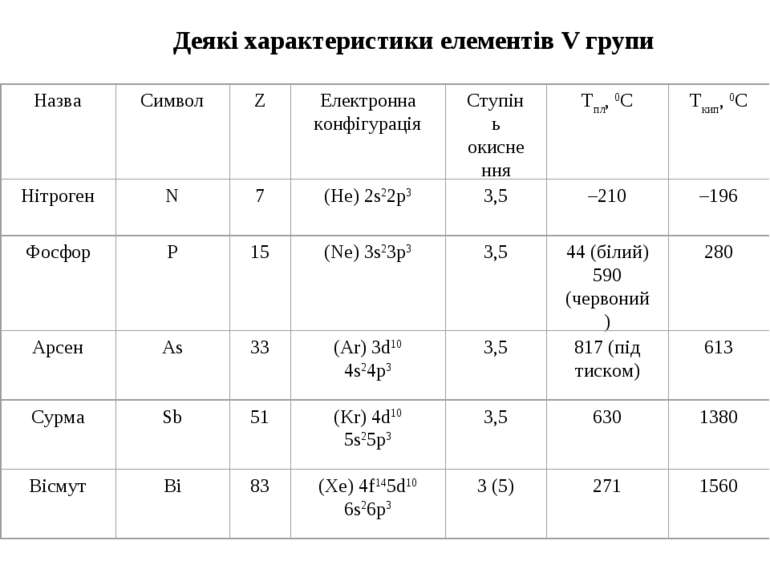
ФОСФОР Фосфор знаходиться в періодичній системі в V групі. Заряд ядра атома Z=15. Фосфор елемент-одинак. Його єдиний стабільний ізотоп має тип ядра по масі 4n+3, що характерно для непарних елементів верхньої частини періодичної системи. Радіоактивні ізотопи фосфору одержують тільки штучним шляхом. Фосфор – літофільний елемент. Фосфор, на відміну від азоту, має вільні d-орбіталі:
Фосфор утворює ковалентні зв’язки з атомами інших елементів, які за властивостями схожі до нього. Фосфор з найбільш електропозитивними металами утворює фосфіди з іонним зв’язком. Фосфор утворює полімери з одинарними зв’язками (оксиди, поліфосфати). Проста речовина фосфор – Р4. Алотропічні модифікації простого фосфору: білий, червоний, чорний. Ступені окиснення фосфору Р–ІІІ PH3, Ca3P2 РІІ P2J4 Р–ІІ P2H4 РІІІ P4O6, H3PO3, PF3 Р0 P4 РV P4O10, H3PO4, РІ H3PO2 (aq)[1], H2PO2–(aq) H2PO4–(aq), PF5, PCl5, POCl3
Гідриди фосфору Фосфін РН3 – безколірний газ з неприємним запахом. Це сильна отрута. Властивості фосфіну дещо відрізняються від властивостей аміаку. Це можна пояснити різною будовою (довжина зв’язку, полярність молекули, відсутність у фосфіну sp3-гібридизації валентних електронів). Фосфін утворюється при взаємодії білого фосфору з лугом: Р4 + 3КОН + 3Н2О = РН3 + 3КН2РО4 Іноді РН3 отримують із фосфідів активних металів: Са3Р2 + 6HCl = 2PH3 + 3CaCl2
Якщо галогеніди азоту дуже нестійкі і являють собою вибухові речовини, то галогеніди фосфору – менш реакційно здатні сполуки. Добування галогенідів фосфору: P4 + 6Cl2 = 4PCl3 3PCl5 + 2P = 5PCl3 PCl3 + Cl2 = PCl5 Хімічні властивості галогенідів фосфору: PCl5 + H2O = POCl3 + 2HCl POCl3 + 3H2O = H3PO4 + 3HCl CH3COOH + PCl5 = POCl3 + HCl + CH3COCl
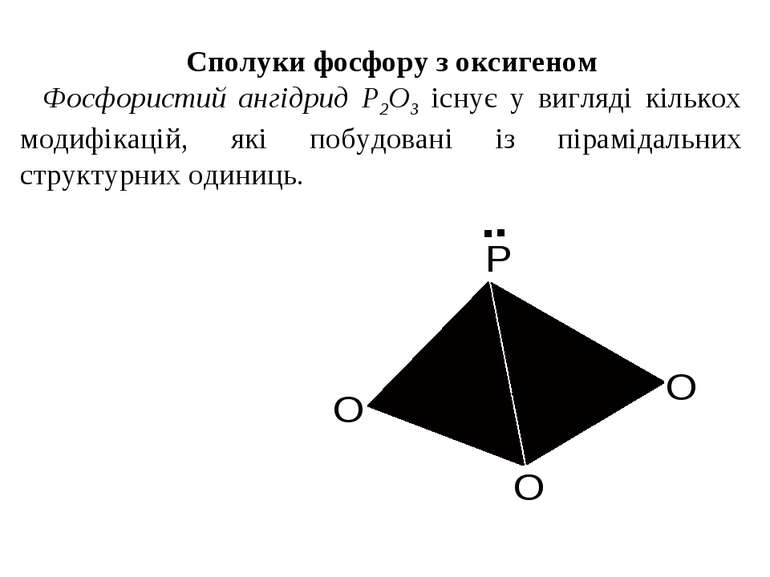
Сполуки фосфору з оксигеном Фосфористий ангідрид Р2О3 існує у вигляді кількох модифікацій, які побудовані із пірамідальних структурних одиниць.
Оксид фосфору, фосфорний ангідрид Р2О5 в газоподібному стані має склад Р4О10. При окисненні білого фосфору утворюється летка модифікація Р2О5 з молекулярною кристалічною граткою, у вузлах якої знаходяться молекули Р4О10. Р4О10 дуже активно взаємодіє з водою. Його використовують для осушення газів і рідин.
Фосфорні кислоти При взаємодії Р4О10 з водою на холоді утворюється метафосфорна кислота стехіометричного складу НРО3. Кип’ятіння розбавленого водного розчину НРО3 викликає перехід метафосфорної кислоти в ортофосфорну: НРО3 + Н2О = Н3РО4 Внаслідок дегідратації Н3РО4 при 200-2500С одержуємо пірофосфорну кислоту Н4Р2О7, яку можемо піддати також дегідратації, і одержати метафосфорну кислоту.
Ортофосфатна кислота в безводному стані – безколірні кристали, надзвичайно гігроскопічні. Н3РО4 – кислота середньої сили (Кдис=7.6·10–2). При відщеплені одного, двох або трьох протонів ортофосфорна кислота утворює відповідно іони: дигідрогенортофосфат Н2РО4-, гідрогенфосфат НРО42–, ортофосфат РО43–. Метафосфорна кислота НРО3 в безводному стані – прозора, склоподібна маса, Тпл=400С, Ткип=8000С. Пірофосфорна кислота Н4Р2О7 – тверда речовина. При стиканні з водою на холоді повільно руйнується. Н4Р2О7 сильніша кислота, ніж Н3РО4.
Солі фосфорних кислот Ортофосфати отримують при нейтралізації Н3РО4 лугом. В твердому стані найлегше виділити дигідроген- і гідрогенфосфати (наприклад, NaH2PO4, Na2HPO4): Na3PO4 + H2O = NaOH + Na2HPO4 Із середніх фосфатів розчинні лише похідні лужних металів. При нагріванні до помірно високих температур середні фосфати не розкладаються. Гідрофосфати піддаються дегідратації з утворенням мета- або пірофосфатів: 2Na2HPO4 = Na4P2O7 + H2O NaH2PO4 = NaPO3 + H2O Суперфосфати широко використовуються в сільському господарстві у вигляді мінеральних добрив (Ca3(PO4)2; Ca(H2PO4)2; CaHPO4). H3PO4 + Ca(OH)2 CaHPO4 + 2H2O Ca3(PO4)2 + 3H2SO4 2H3PO4 + 3CaSO4 Ca3(PO4)2 + 4H3PO4 3Ca(H2PO4)2
А Визначення фосфатної кислоти та фосфат-іонів PO43–: HPO42– + Ba2+ BaHPO4 – сполука білого кольору 2PO43– + 3Ba2+ Ba3(PO4)2 – сполука білого кольору; 2HPO42– + 3Ag+ Ag3PO4 + H2PO4– – сполука жовтого кольору; HPO42– + Mg2+ + NH4OH MgNH4PO4 + H2O – білі кристали; H3PO4 + 12(NH4)2MoO4 + 12HNO3 (NH4)3PO4 12MoO3 + 12NH4NO3 + 12H2O.
СИЛІЦІЙ. ПІДГРУПА ГЕРМАНІЮ Силіцій (Si, силіціум від лат. silex – “камінь”) – парний елемент, тип ядра по масі головного ізотопу 28Si (92.18% в плеяді) 4n. Інші стабільні ізотопи кремнію 29Si, 30Si. Силіцій – другий за поширеністю елемент періодичної системи після Оксигену. На його долю припадає 27.6% по масі. В природі кремній зустрічається в основному у вигляді силікатів, алюмосилікатів і кремнезема SiО2 (кварц, пісок). Ізольований атом Si має таку електронну будову: 1s22s22p63s22p2. Ступінь окиснення силіцію у його сполуках змінюється від +4 в SiО2 і силікатах до –4 в силанах (SiН4) і силіцидах (Mg2Si). У сполуках силіцію при утворенні ковалентних зв’язків звичайно використовується не більше двох 3d-орбіталей, і його координаційне число (КЧ) не перевищує 6. В сполуках Si з Оксигеном, Гідрогеном, Хлором, Бромом і йодом КЧ Si дорівнює 4, і тільки у сполуці з флуором – 6.
В залежності від умов досліду отримують зразки кремнію, які відрізняються за зовнішнім виглядом і властивостями. “Аморфний кремній” являє собою бурий порошок; монокристалічний кремній має металоподібний вигляд. Підвищена реакційна здатність порошкоподібного кремнію, можливо, обумовлена його високою дисперсністю. Температура плавлення кремнію дорівнює 14200С, температура кипіння = 26000С. Кристалічний кремній добре проводить тепло. Теплота плавлення Si дорівнює 11 ккал/моль, теплота атомізації складає 108 ккал/моль. Взаємодія з простими речовинами. В хімічному плані кристалічний кремній досить інертна речовина, проте, чим вища дисперсійність кремнію, тим нижча температура, при якій проходить взаємодія його з іншими речовинами (тобто вища реакційна здатність). Дрібнодисперсний кремній реагує з фтором вже при звичайній температурі, тоді як хлором і киснем окиснюється при підвищеній температурі (4000-6000С) з утворенням SiCl4 і SiО2. З азотом Si вступає в реакцію при 10000С, а з вуглецем і бором – при 20000С.
Мінеральні кислоти на кремній при звичайних умовах не діють. Він розчиняється лише в суміші HF+HNO3: 3Si + 18HF + 4HNO3 3H2[SiF6] + 4NO + 8H2O Луги діють на Si, переводячи його у солі кремнієвої кислоти з виділенням водню: Si + 2NaOH + H2O Na2SiO3 + 2H2 . Вперше Si отримав Берцеліус в 1823р. Звичайно Si добувають, відновлюючи SiО2 вуглецем: SiО2 + 2С 2СО + Si. SiO2 + 5C + CaO Si + CaC2 + 3CO (t=800-10000C) В лабораторних умовах відновником виступає магній: SiO2 + 2Mg 2MgO + Si. Для кремнію, як і для вуглецю характерне утворення в стані пари двохатомних молекул, які при переході в тверду фазу руйнуються з утворенням алмазоподібної структури. Кремній кристалізується в кубічній сингонії. Тут реалізується sp3-гібридизація, характерна для кремнію. Як і алмаз, Si характеризується тугоплавкістю і високою твердістю.
Сполуки силіцію з оксигеном Оксид силіцію (IV) SiO2 (кремнезем) при звичайних умовах не існує у вигляді мономера. Оксид SiO2 в молекулярному стані стійкий лише в газовій фазі. Електронегативність силіцію значно менша, чим у карбону, тому зв’язок Si–О полярніший, чим С–О. Хімічний зв’язок Si–О на 35–50% іонний, але деякі вчені рахують цей зв’язок переважно ковалентним. Отож, електропровідність всіх модифікацій дуже мала. Кремнезем в природі зустрічається у вигляді мінералу кварцу, а також кристобаліту, тридиміту, хоч при звичайних умовах стійким є -кварц, а інші форми метастабільні. SiO2 всіх модифікацій полімерний – (SiO2)n. Він побудований із тетраедрів [SiO4]. Кварц широко використовується в народному господарстві. Великі його кристали вирощують штучно. Прозорі безколірні кристали називають гірським кришталем, зустрічається рожевий кварц, фіолетовий (аметист), зелений (хризопраз). Дрібнокристалічна модифікація кварцу з домішками інших речовин називається халцедоном. Звичайні форми SiO2 (кварц, тридиміт і кристобаліт) мають низьку реакційну здатність. На них діють лише фтор, фтористоводнева кислота, газоподібний фтористий водень, а також розчини лугів. Всі модифікації SiO2 майже не розчинні у воді. 2SiO2 + 2LiAlH4 2SiH4 + Li2O + Al2O3 (t=170-2000C) SiO2 + 4HF SiF4 + 2H2O (t=250-4000C) SiO2 + 2NaOH Na2SiO3 + H2O
Оксид силіцію (IІ) SiO отримують за реакціями: ¨ SiO2 + Si 2 SiO ¨ SiO2 + Н2 SiO + Н2О ¨ SiO2 + С SiO + СО. Швидким охолодженням можна отримати тверду фазу SiO, яка являє собою дрібнодисперсний коричневий порошок. У твердій фазі SiO полімеризований. На повітрі (SiO)n швидко окиснюється до (SiO2)n. SiO + 2CaO + MgO Ca2SiO4 + Mg (t=13500C) Майже всі гірські породи земної кори містять силіцій і їх називають силікатами (третина відомих мінералів). Особливо важливі алюмосилікати, які відносяться до групи польових шпатів. Найбільш поширені мінерали: Польові шпати: ¨ ортоклаз – K[AlSi3O8] Слюди: ¨ мусковіт – KAl2[AlSi3O10] (OH, F)2 ¨ азбест – Mg3[Si2O5] (OH)4 ¨ тальк – Mg3[Si2O3] (OH)4
Із силікатних матеріалів, які отримують штучно, найважливішим є скло. Вихідними продуктами виробництва скла є сода, вапняк і пісок. Вихідні продукти нагрівають у спеціальних ваннах до 15000С, деякий час витримують, а тоді з рідкої маси формують вироби. Взаємодія реагентів проходить за реакцією: Na2CO3 + CaCO3 + 6SiO2 Na2O CaO 6SiO2 + 2CO2. В залежності від призначення скла, можна міняти його властивості, добавляючи різні речовини. Добавки CaO, B2O3, BaO, MgO підвищують механічну стійкість скла. Заміна частини Na2O на оксиди B2O3, Al2O3, SiO2, TiO2, ZrO2 підвищують хімічну стійкість. Силіцієві кислоти Силікатні кислоти одержують дією мінеральних кислот на розчини силікатів або гідролізом деяких сполук кремнію (галогенідів, сульфідів, ефірів кремнієвих кислот та ін.). Диметасилікатна кислота H2Si2O5 (у вигляді луски) утворюється при дії сірчаної кислоти на диметасилікат натрію: Na2Si2O5 + H2SO4 H2Si2O2 + Na2SO4. Структура H2Si2O5 складається із шарів, які утворенні шестичленними кільцями тетраедрів [SiO4]. Ці шари склеєні катіонами Н+.
Метасилікатна кислота H2SiO3 аморфна і менш стійка, чим диметакремнієва кислота. Її отримують за схемою: Na2SiO3 + H2SO4 H2SiO3 + Na2SO4. При температурі вищій за 00С проходить дегідратація: 2 H2SiO3 H2Si2O5 + Н2О. Ортосилікатна кислота H4SiO4 добре розчинна у воді, утворюється при гідролізі галогенідів і сульфідів силіцію, а також: Na4SiO4 + HCl H4SiO4 + NaCl З часом H4SiO4 полімеризується, утворюючи колоїдні розчини. У такому полімері атоми кремнію оточені 6 аніонами ОН–. Атом кремнію у всіх сполуках має координаційне число (КЧ) рівне 4. Отож, полімеризація ортосилікатної кислоти проходить за схемою: 2H4SiO4 H6Si2O7 + Н2О 2 H6Si2O7 H10Si4O13 + Н2О. Силікати майже всіх металів нерозчинні у воді. Розчинні солі утворюють лише лужні метали (Na2SiO3, Na2Si2O5, Na4SiO4 та ін.).
Схема гідролізу силікатів (власне розчинного скла): І стадія – утворення гідросилікатів [SiO4]4– + H2O [HSiO4]3– + OH– [HSiO4]3– + H2O [H2SiO4]2– + OH– [H2SiO4]2– + H2O [H3SiO4]– + OH– [H3SiO4]– + H2O H4SiO4 + OH– Сумарне рівняння гідролізу в молекулярній формі: Na4SiO4 + 4H2O 4NaOH + H4SiO4 ІІ стадія – полімеризація В полімеризації приймають участь мономери ортосилікатної кислоти і гідросилікат-іони: [H3SiO4]– + [H3SiO4]– [H4Si2O7]2– + H2О [H4Si2O7]2– + [H3SiO4]– [H5Si3O10]2– + H2О
Сполуки силіцію з гідрогеном Сполуки силіцію з гідрогеном називають силанами. По складу і структурі вони аналогічні вуглеводням. Формула сполук гомологічного ряду силанів має вигляд: SinH2n+2. Із сполук цього складу відомі SiH4 – моносилан, Si2H6 – дисилан, Si3H8 – трисилан і т.д. Для силанів характерне тетраедричне розміщення зв’язків Si–Н, аналогічно відповідним сполукам вуглецю. Силани і вуглеводні подібні і по фізичним властивостям. Силани безколірні, перші члени гомологічного ряду газоподібні, але наступні – рідини. Кремній і водень взаємодіють між собою безпосередньо лише при температурі вольтової дуги, тому силани звичайно отримують проміжними реакціями: діючи на силіциди активних металів (Mg, Ca, Li) розчинами кислот (HCl, H2SO4, H3PO4). За реакціями отримують суміш силанів. Для виділення індивідуальних сполук силанів суміш охолоджують до –1800С і розділяють фракційною перегонкою. SiCl4 + LiAlH4 SiH4 + LiCl + AlCl3 Моносилан SiH4 – безколірний газ, який має запах плісняви, досить стійкий в інертній атмосфері, але на повітрі інколи самозапалюється. Луги розкладають SiH4: · SiH4 + NaOH + H2O Na2SiO3 + 4H2. · SiH4 Si + 2Н2 (вище 4000С) · SiH4 (SiH2)n + (SiH)n (при 20000С) 3SiH4 + 8KMnO4 8MnO2 + 3SiO2 + 8KOH + 2H2O
Всі силани отруйні і сильні відновники. · SiH4 + Cl2 SiCl4 + H2 · SiH4 + HCl SiH3Cl + H2 · SiH4 + 3HCl SiHCl3 + 3H2 Cиліцидами називають бінарні сполуки силіцію з більш електропозитивними елементами (в тому числі з металами) Існує кілька способів одержання силіцидів: 1. 1. сплавлення металів (або гідридів металів) з кремнієм: М + Si МSi 2МН + 2Si 2МSi + Н2 2. 2. відновлення оксидів металів кремнієм або вуглецем в присутності SiО2: 2МО + 3Si 2МSi + SiО2 МО + 3С + SiО2 МSi + 3СО 1. 3. обмінні реакції: М + SiCl4 + 2H2 MSi + 4HCl Всі ці реакції протікають при високих температурах.
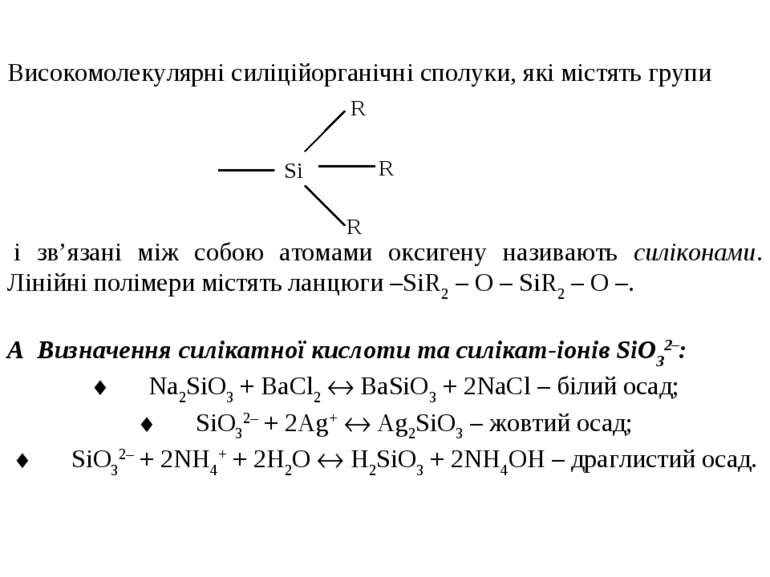
Галогеніди кремнію (сполуки силіцію з галогенами) можна розглядати як продукти часткового або повного заміщення атомів гідрогену силанів на атоми галогену. Переважно це похідні моносилану. Фтор реагує з кремнієм при звичайній температурі, хлор, бром і йод – при нагріванні: ¨ Si + 2Г2 SiГ4 ¨ Ba[SiF6] BaF2 + SiF4 ¨ SiO2 + 2CaF2 + 2H2SO4 SiF4 + 2CaSO4 + 2H2O ¨ SiO2 + 4HF SiF4 + 2H2O Тетрафторид кремнію – безколірний газ з різким запахом. У воді, при розчиненні, частково гідролізує, отруйний. Тетрахлорид кремнію добувають, використовуючи наступні реакції: SiO2 + 2C + 2Cl2 SiCl4 + 2CO2; Mg2Si + 4Cl2 2MgCl2 + SiCl4. SiCl4 – безколірна рідина, яка димить на повітрі, з задушливим запахом. Реагує з більшістю оксидів металів: SiCl4 + 2Al2O3 3SiO2 + 4AlCl3. Гідроген-оксигенові сполуки силіцію отримують гідролізом галогенозаміщених силанів. В них атоми силіцію зв’язані між собою через кисневий місток. Такі сполуки називають силоксанами.
і зв’язані між собою атомами оксигену називають силіконами. Лінійні полімери містять ланцюги –SiR2 – O – SiR2 – O –. А Визначення силікатної кислоти та силікат-іонів SiO32–: ¨ Na2SiO3 + BaCl2 BaSiO3 + 2NaCl – білий осад; ¨ SiO32– + 2Ag+ Ag2SiO3 – жовтий осад; ¨ SiO32– + 2NH4+ + 2H2O H2SiO3 + 2NH4OH – драглистий осад. Високомолекулярні силіційорганічні сполуки, які містять групи
У водному розчині нітратна кислота реагує з металами з утворенням нітратів. Оскільки азотна кислота – окисник, то водень, як продукт реакції, виділяється рідко (лише магній і кальцій, взаємодіючи з холодною розбавленою HNO3, витісняє водень). У випадку взаємодії з іншими металами відновлюється нітрат-іон, а не Н+-іон. При цьому можливе утворення різних продуктів відновлення нітратної кислоти. Можливі продукти відновлення нітратної кислоти
Схожі презентації
Категорії

















![Бінарні сполуки Al AlCl3 + 3LiH AlH3 + 3LiCl; 4LiH + AlCl3 Li[AlH4] + 3LiCl; ... Бінарні сполуки Al AlCl3 + 3LiH AlH3 + 3LiCl; 4LiH + AlCl3 Li[AlH4] + 3LiCl; ...](https://svitppt.com.ua/images/24/23869/770/img17.jpg)





























































![Бінарні сполуки Al AlCl3 + 3LiH AlH3 + 3LiCl; 4LiH + AlCl3 Li[AlH4] + 3LiCl; ... Бінарні сполуки Al AlCl3 + 3LiH AlH3 + 3LiCl; 4LiH + AlCl3 Li[AlH4] + 3LiCl; ...](https://svitppt.com.ua/images/24/23869/210/img17.jpg)