Презентація на тему:
Біогенні елементи.
Завантажити презентацію
Біогенні елементи.
Завантажити презентаціюПрезентація по слайдам:
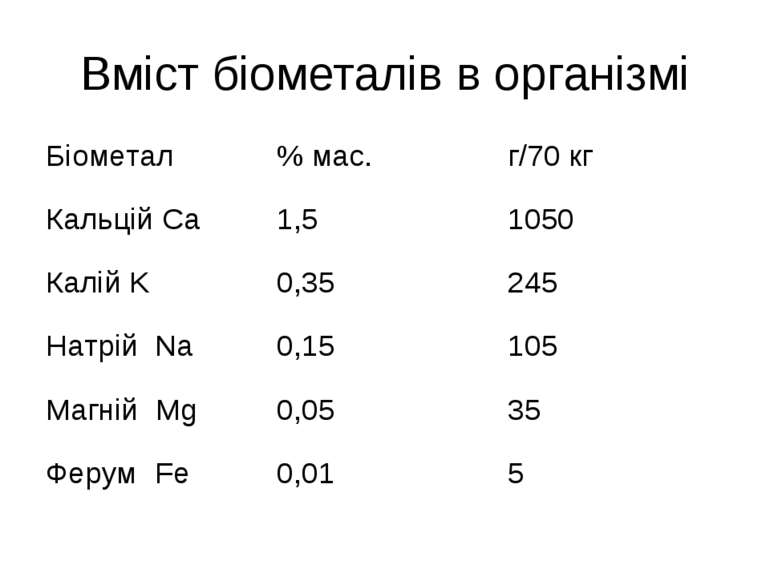
Біогенні елементи В тілі людини і вищих тварин виявлено біля 80 хімічних елементів, що надходять в організм разом з водою і їжею, з них 47 елементи є постійно, тому вони називаються біогенними. Найважливішими є хімічні елементи, що становлять 97,5 % від загальної маси організму. Це шість елементів О, С, Н, N, P, S, які є органогенними елементами.
Біогенні елементи Залежно від кількісного вмісту всі біоелементи А.Виноградов розділив на макро-, мікро- і ультрамікроелементи. До макроелементів, крім елементів-органогенів, відносять елементи, вміст яких в організмі становить 0,01 % і більше маси тіла: натрій Na, калій K, кальцій Ca, магній Mg, хлор Cl. Макроелементи виконують роль пластичного матеріалу, підтримують осмотичний тиск, рН середовища біорідин, йонну та кислотно-основну рівновагу, стан колоїдних систем.
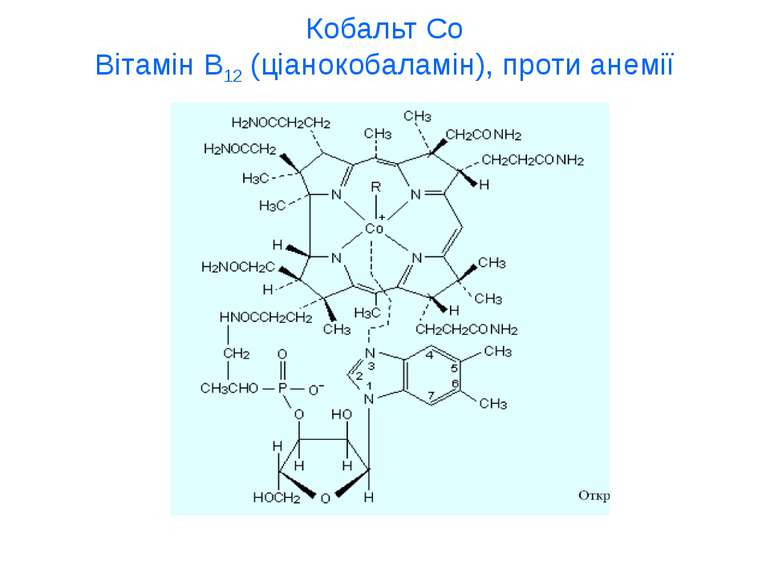
мікроелементи Мікроелементи – 10-3–10-5 %. ферум Fe, йод J, флуор F, цинк Zn, купрум Cu, манган Mn, кобальт Co, хром Cr, нікол Ni, молібден Mo, алюміній Al Мікроелементи входять до складу ферментів, вітамінів, гормонів Ультрамікроелементи – Au, Hg, Tl
s-елементи Na, K, Ca, Mg Натрій Na Na – e = Na+ Солі натрію в організмі знаходяться переважно в розчинному стані в плазмі крові, в лімфі, в лікворі, в травних соках. В клітинах натрію значно менше, зосереджується в позаклітинних зонах. Натрій відіграє важливу роль у затриманні води в організмі. 1 г натрію може затримати до 25 г води. йому належить важлива роль у перерозподілі води між клітинами i рідинами організму, а також в регуляції обміну води в цілому. Натрій хлорид є основним матеріалом, з якого утворюється соляна кислота. В цьому процесі беруть також участь хлориди калію, кальцію та магнію. Ці солі відіграють найбільшу роль в осмотичних процесах. Іони натрію також необхідні для нормальної збудливості м'язів.
Калій K Солі калію, як і натрію, добре розчинні у воді, вони є у всіх тканинах організму. На відміну від натрію, калій в більших кількостях міститься в клітинах, тому натрій звичайно звуть екстрацелюлярним, а калій iнтpaцелюлярним елементом. Так, наприклад, з 8 - 9 г калію, що є в крові, 95 - 96% знаходиться в еритроцитах i лише 3 - 5% у плазмі. Багато калію в травних соках. Іони калію посилюють функції парасимпатичної нервової системи i зменшують збуджуючий вплив натрію на м'язи.
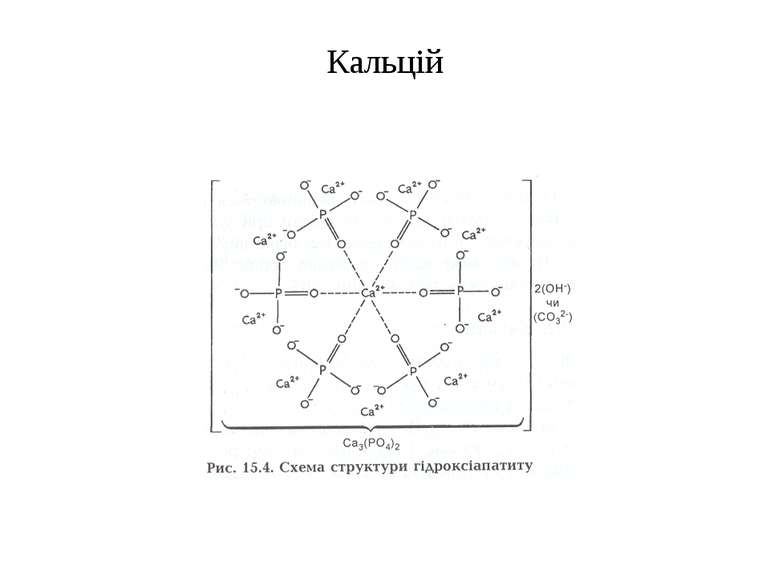
s-елементи Кальцій Ca, Магній Mg Основна маса кальцію міститься в кістках у вигляді солей фосфорної кислоти - оксіапатитів [Са10(РО4)6(ОН)2]. Мінеральна частина кісток складається з мікрокристалів оксіапатиту, на аморфній основі яких сорбуються карбонат (6%), цитрат (1%), натрій (0,7%), магній (0,7%), а також у невеликих кількостях фтор. У великій кількості е кальцій в тканинах зубів, особливо в емалі. Невеликі кількості кальцію (10-11 мкмоль є в крові у вигляді розчинних солей (СаСl2). Кальцій необхідний для коагуляції крові та функції м'язів. Кальцій заспокоює нервову систему i зменшує проникність і спазм судин. Кальцієві солі входять до складу фосфоропротеїду — казеїногену молока.
Визначення іонів кальцію Ca 2+ СaCl2 + (NH4)2CO3 CaCO3 + 2NH4Cl білий аморфний осад; Сa 2+ + SO4 2– CaSO4 ; Ca 2+ + C2O4 2– CaC2O4 , кальцій оксалат Леткі солі кальцію забарвлюють полум я в цегляно-червоний колір.
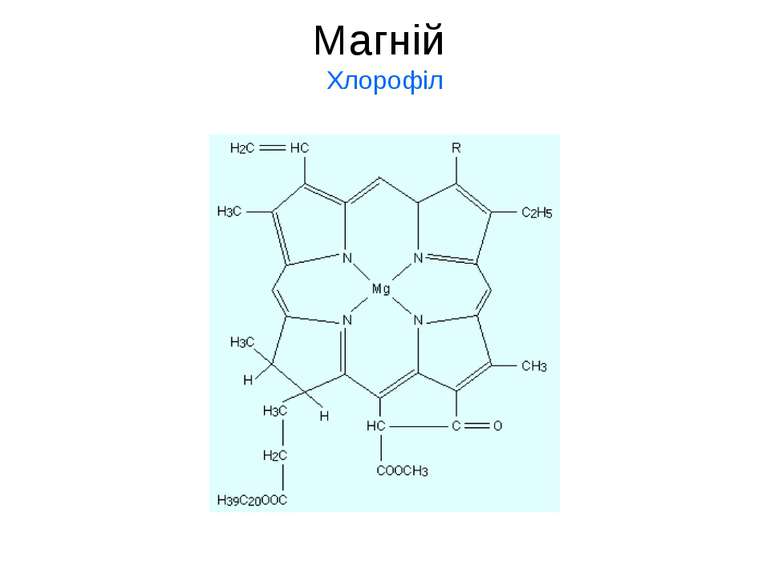
Магній Mg Сполуки Мg містяться у внутрішньоклітинних рідинах у вигляді гідратованих йонів, Mg [(H2O)6]2+, а в кістках скелету та емалі зубів – у вигляді нерозчинних фосфатів
p-елементи Хлор Cl, Йод I, Флуор F Хлор міститься у вигляді аніону Cl- солей натрію, калію, кальцію, магнію та марганцю у всіх рідинах організму людини та тварин. Аніони хлору разом з іонами натрію та калію відіграють основну роль у підтриманні сталості осмотичного тиску плазми крові, лімфи та ін. рідин. Більша частина (65-70%) всього осмотичного тиску плазми крові забезпечується хлоридами, Вони відіграють важливу роль у підтриманні іонної рівноваги, i регуляції концентрації водневих іонів. Іонам хлору та хлоридам взагалі належить також важлива роль в утворенні соляної (хлоридної) кислоти шлункового соку.
Йод I Йод входить до складу гормону щитовидної залози — тироксину. Крім того, в невеликій кількості він завжди е в крові, що необхідно для нормальної функції щитовидної залози. Добова потреба в йоді дорівнює приблизно 100 мікрограмам, або найменше 1 мікрограму на і кг ваги тіла. При недостатності йоду у воді i їжі послаблюється функція щитовидної залози i замість залозистої тканини розростається сполучна тканина, утворюючи досить значні нарости на передній поверхні шиї. В зв'язку з цим i захворювання має назву зобної хвороби.
Флуор F Участь в процесах утворення кісток, емалі зубів і дентину. Він входить до складу цих тканин у стані фторапатиту. В мікрокількостях флуор використовують для профілактики карієсу зубів, збагачуючи питну воду розчинними сполуками флуору або додаючи фториди до зубних паст Надлишок йонів флуору в організмі викликає флюороз хронічне захворювання, що призводить до гіпоплазії емалі зубів.
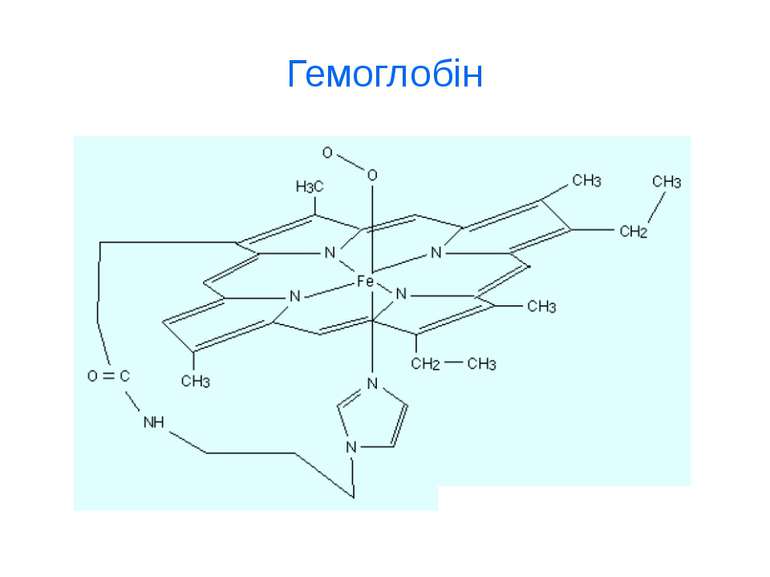
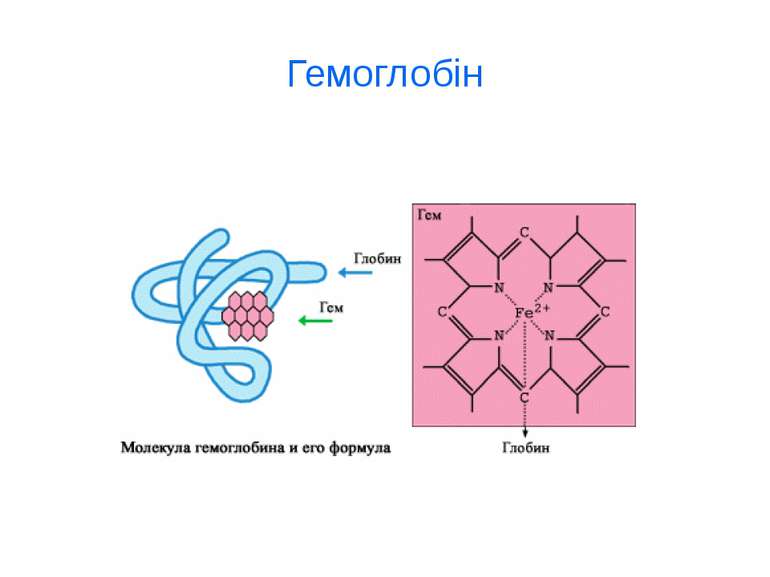
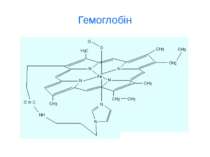
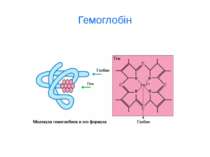
d-елементи Fe, Cu, Zn, Mn, Co, Ni, Cr, Mo ферум Fe Біологічна роль Феруму (заліза) обумовлена головним чином тим, що воно входить до складу гемоглобіну, міоглобіну та великої групи ферментів тканинного дихання (Fe 2+). В організмі людини міститься 3- 5 г заліза, з яких близько 73 % знаходиться в гемоглобіні, 3 - 5 %- — у міоглобіні, 15-16% зв'язано у вигляді залізо-6ілкових комплексів – феритину, що є запасною формою заліза; 0,1% міститься в плазмі у вигляді залізовмісного білка сидерофіліну та близько 0,1% входить до складу ферментів.
Якісні реакції на іони Fe2+ та Fe3+ FeSO4+(NH4)2S→FeS↓+(NH4)2SO4 – чорний осад FeSO4+2NaOH→Fe(OH)2 ↓ +Na2SO4 – білий осад 3FeSO4+2K3[Fe(CN)6]→Fe3[Fe(CN)6]2 ↓ +3K2SO4 – темно-синій осад “турнбулева синька” Fe2(SO4)3+6(NH4)2S →Fe2S3 ↓ +3(NH4)2SO4 – чорний осад 4FeCl3+3K4[Fe(CN)6] →Fe4[Fe(CN)6]3 ↓ +12KCl – темно-синій осад “берлінська блакить” FeCl3+3KSCN →Fe(SCN)3 ↓ +3KCl червоний осад
Купрум Cu Мідь (купрум Cu+, Cu2+) входить у 30 білків і ферментів, що виконують функцію перенесення кисню та електронів в окисно-відновних реакціях. Cu необхідна для процесу утворення крові, при нестачі в організмі людини або тварини міді послаблюється утворення гемоглобіну i розвивається анемія. У сироватці крові є білок церулоплазмін, мідь підсилює дію інсуліну i гормонів гіпофіза, які стимулюють розвиток i функцію статевих залоз.
Цинк Найкраще вивченим ферментом є карбоксипептидаза Цинк входить до фермента алкогольдегідрогенази Цинк входить до складу інсуліну i подібно марганцю підсилює дію його. Цинк також входить до складу гіпофіза i статевих залоз. Він е складовою частиною ферменту карбоангідрази, що каталізує розщеплення вуглекислоти на Н2О та СО2.
БуфернІ розчини Склад буферних розчинів. Механізм буферної дії буферних розчинів. БУФЕРНі СИСТЕМи ОРГАНіЗМу Електродні потенціали. Рівняння Нернста. Типи електродів. Окисно-відновні системи. Потенціометричне вимірювання рН
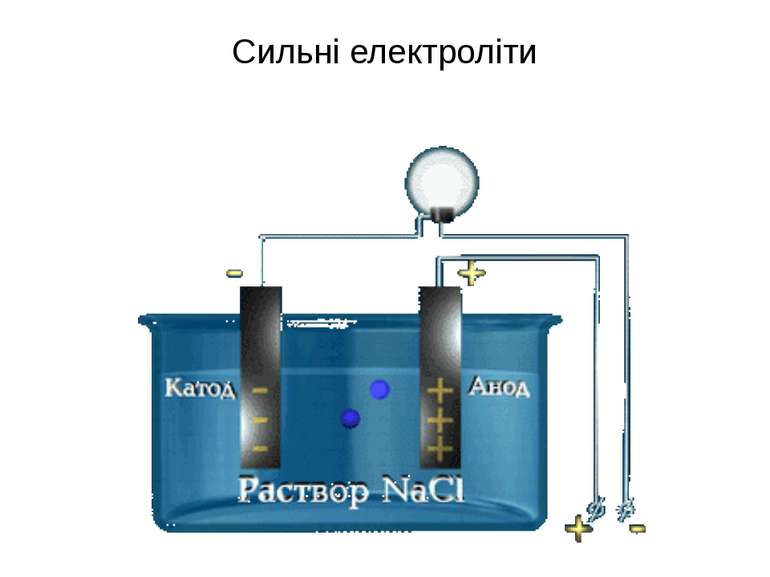
Сильні електроліти Середні водорозчинні солі Мінеральні кислоти Н2SО4 , HCl, HNO3, HClO4, HBr Гідроксиди лужних і лужноземельних металів NaOH, KOH, Ca(OH)2, Ba(OH)2
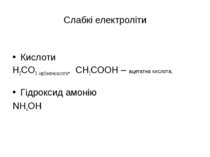
Слабкі електроліти Кислоти H2CO3 карбонатна кислота, СН3СООН – ацетатна кислота, Гідроксид амонію NН4OH
Протонна (протолітична) теорія кислот і основ Бренстеда -Лоурі. -кислота - це сполука, яка віддає протон, є донором протонів Н+ НAn ↔ H+ + An- - основа - це сполука, яка приєднує протон, є акцептором протонів В + Н+ ↔ ВН
Водневий показник рН - від*ємний десятковий логарифм активності (концентрації) іонів гідрогену рН = - lg[H+] Вода дист. pH = 7.0 Кислі розчини рН < 7.0 Лужні розчини рН > 7.0. Нашатирний спирт - рН =12 Кров - 7.4 Слина - 6.6 Шлунковий сік рН=1- 2 0,1 М НСl рН=1
Буферні системи Буферні системи – це розчини які здатні підтримувати сталим рН, як при додаванні сильних кислот або основ, так і при розведенні. Буферні розчини - це суміші слабкої кислоти з її добре дисоційованою сіллю або слабкої основи з її добре дисоційованою сіллю
Склад буферних систем Слабка кислота і сіль цієї кислоти, утворена сильною основою СН3СООН + СН3СООNa Слабка основа і сіль цієї основи, утворена сильной кислотою NH4OH +NH4Cl
(а) слабка кислота та спряжена до неї основа Н2СО3 / НСО3- СН3СООН / СН3СОО- H2PO4-/ HPO42- (б) слабка основа і спряжена до неї кислота NН3 / NH4+
Ацетатний буферний розчин (діапазон рН 3,7-5,6) СН3СООNa→СН3СОО- + Na+ СН3СООH ↔ СН3СОО- + H+ Константа дисоціації [СН3СОО- ] [H+] Ка = ------------------------- [СН3СООH ] Ка [СН3СООН ] [H+] = ------------------------- [H+]= Ка [кислота ]/ [основа] [СН3СОО- ]
Механізм буферної дії ацетатного буферу СН3СООNa→СН3СОО- + Na+(повна дисоціація) СН3СООH ↔ СН3СОО- + H+ (часткова дисоц-я) В розчині є іони СН3СОО-, H+, Na+ при додаванні сильної кислоти: СН3СОО- + H+ ↔ СН3СООH (сильна кислота замінюється на слабку) при додаванні сильної основи: СН3СООH +ОН-→ СН3СОО- + Н2О
БУФЕРНі СИСТЕМИ ОРГАНіЗМУ 1. Гідрокарбонатна буферна система: H2CO3 / NaHCO3 2. Гемоглобінова і оксигемоглбінова буферна система крові: НHb / K-Hb і НHbO2 / K-Hb02 3. Буферна система білків плазми крові: Pt COOH/ PtCOONa Білки (слабкі кислоти)/ Протеїнат Na 4. Фосфатна буферна система: Фосфатна NаН2РО4 + Na2НРО4
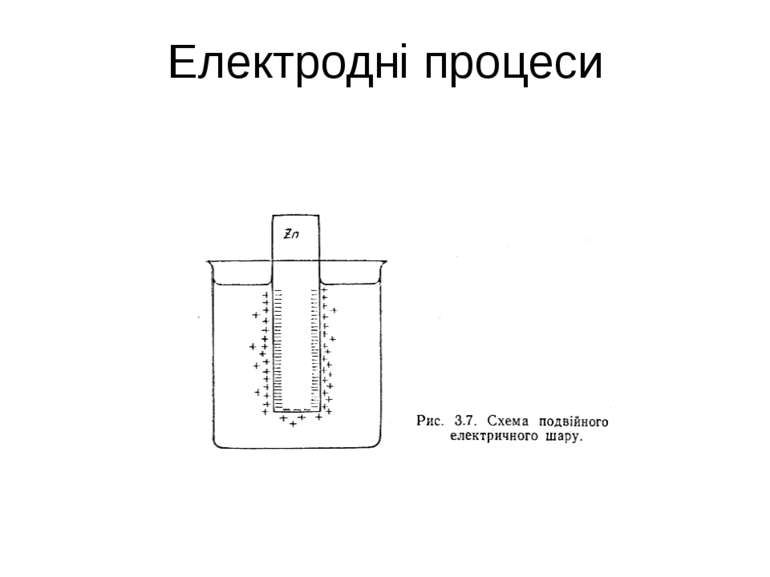
Нормальним електродним потенцІалом називають потенціал, що виникає на металевій пластинці, зануренній в розчин солі цього ж металу з концентрацією 1 моль еквіваленту в літрі розчину, при порівнянні з потенціалом водневого електрода, потенціал якого прийнято вважати рівним 0.
Нормальні потенціали металів при 25 оС Электродна реакція E°, В Li+ + e– ® Li –3,045 Mg2+ + 2e– ® Mg –2,356 Al3+ + 3e– ® Al –1,67 Zn2+ + 2e– ® Zn –0,7626 Cr3+ + e– ® Cr2+ –0,424 2H+ + 2e– ® H2 0,000 Cu2+ + 2e– ® Cu 0,340 Fe3+ + e– ® Fe2+ 0,771 O2 + 4H+ + 4e– ® 2H2O 1,229 Cl2 + 2e– ® 2Cl– 1,3583 F2 + 2e– ® 2F– 2,87
Рівняння Нернста RT e = e0 + ————— lg α Men+ n F де е – электродний потенциал, В e0- нормальний (стандартний электродний потенціал), В R – универсальна газова постійна 8,31 Дж/моль·К Т – абсолютна температура, К n – число електронів,які віддає атом металлу, перетворюючись в іон F – число Фарадея (9,65·104 Кл/моль) α Men+- активність або концентрація іонів металлу в розчині
Схожі презентації
Категорії