Презентація на тему:
Біогенні d елементи
Завантажити презентацію
Біогенні d елементи
Завантажити презентаціюПрезентація по слайдам:
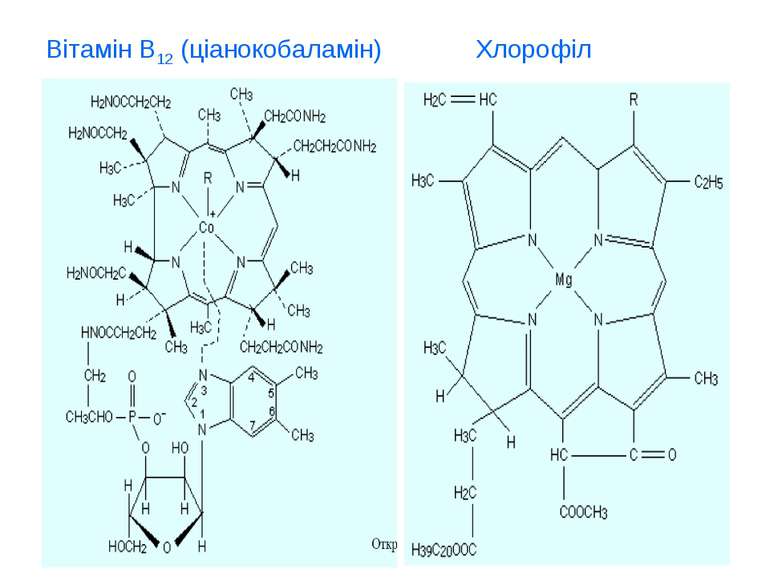
Біогенні d-елемиенти, біологічна роль та застосування у медицині d - елементи І-ІІ В групи. Їх властивості, біологічна роль та використання у медицині (Cu, Ag, Au, Zn, Cd, Hg). d - елементи VІ-VІІ В групи. Їх властивості, біологічна роль та використання у медицині (Cr, Mo, W, Mn, Tc, Re). d - елементи VІІІ В групи. Їх властивості, біологічна роль та використання у медицині (Fe, Co, Ni, Ru, Ph, Pd, Os, Ir, Pt).
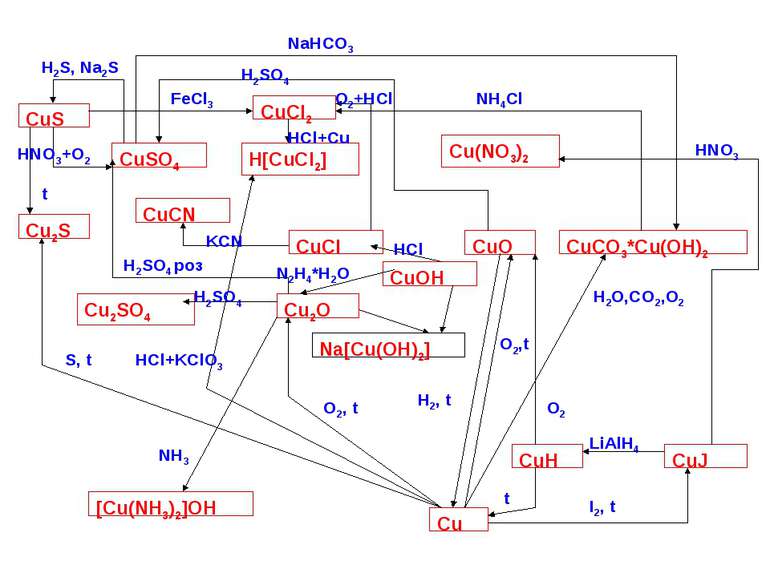
Способи добування елементів І В групи Добування міді збагачення руд методом флотації (Н-д у халькопіриті міститься близько 1-2% міді, а після збагачення до12%). Пірометалургійний метод добування міді з сульфідних руд ґрунтується на окисленні Cu2S до CuO: Cu2S+2O2 →2CuO+SO2, який далі відновлюється до Cu2O і реагує з надлишком сульфіду міді: 2Сu2O+Cu2S → 6Cu+SO2 Добування золота Вимивають з пустої породи Розчиняють у ртуті Ціанідний метод 4Au+8NaCN+O2+H2O → 4Na[Au(CN)2]+4NaOH 2Na[Au(CN)2]+Zn → Na2[Zn(CN)4]+2Au Добування срібла Пірометалургійна переробка руд кольорових металів
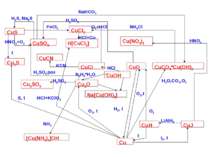
Схеми деяких реакцій Аргентуму та Ауруму Ag AgNO3 Na[Ag(CN)2] Ag2S AgF2, AgCl, AgBr, AgI сплави AgP2, AgP3 Ag2SO4 H[AgCl2] не реагує сплави Na[Au(CN)2] не реагує H[AuCl2] не реагує AuP3 AuF3, AuCl, AuBr, AuI HNO3+HCl HNO3+HCl H2SO4, t>160º H2SO4, t>160º P, t P, t Me, t Me, t Hal2, t Hal2, t NaCN,O2 NaCN,O2 S, t S, t HNO3, t>160º HNO3, t>160º
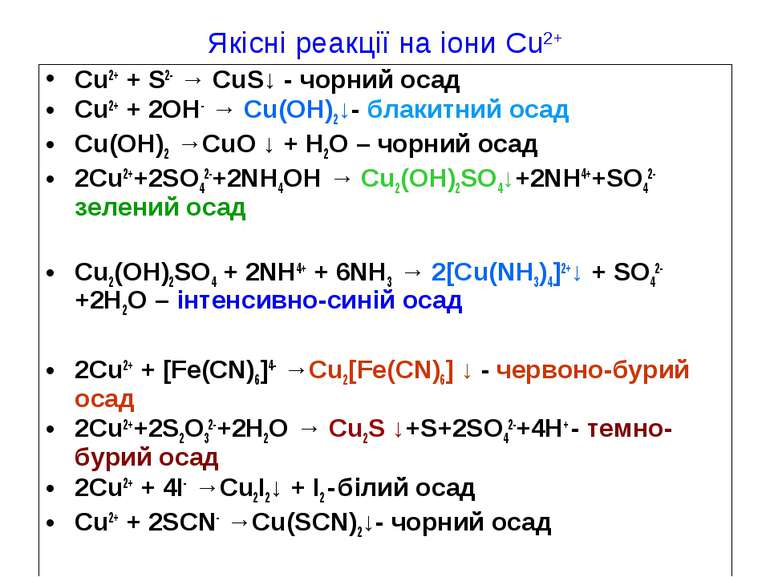
Якісні реакції на іони Cu2+ Cu2+ + S2- → CuS↓ - чорний осад Cu2+ + 2OH- → Cu(OH)2↓- блакитний осад Cu(OH)2 →CuO ↓ + H2O – чорний осад 2Cu2++2SO42-+2NH4OH → Cu2(OH)2SO4↓+2NH4++SO42- зелений осад Cu2(OH)2SO4 + 2NH4+ + 6NH3 → 2[Cu(NH3)4]2+↓ + SO42- +2H2O – інтенсивно-синій осад 2Cu2+ + [Fe(CN)6]4- →Cu2[Fe(CN)6] ↓ - червоно-бурий осад 2Cu2++2S2O32-+2H2O → Cu2S ↓+S+2SO42-+4H+ - темно-бурий осад 2Cu2+ + 4I- →Cu2I2↓ + I2 - білий осад Cu2+ + 2SCN- →Cu(SCN)2↓- чорний осад
Якісні реакції на іони Ag+ 2AgNO3+H2S → Ag2S↓+2HNO3 чорний осад AgNO3+NaCl → AgCl↓+NaNO3 білий сирнистий осад AgNO3+2NaOH → 2NaNO3+2AgOH 2AgOH → Ag2O↓+H2O бурий осад 2NH4OH+2AgNO3 → Ag2O↓+ 2NH4NO3+H2O бурий осад Ag2O↓+4NH4OH → 2[Ag(NH3)2]OH+3H2O 2AgNO3+(NH4)2CO3 → Ag2CO3↓+NH4NO3 білий осад 3AgNO3+2Na2HPO4 → Ag3PO4↓+3NaNO3+NaH2PO4 жовтуватий осад 4AgNO3+K4[Fe(CN)6] → Ag4[Fe(CN)6] ↓+4KNO3 білий осад AgNO3+KBr → AgBr↓+KNO3 блідо-жовтий осад AgNO3+KI → AgI↓+KNO3 жовтий осад 2AgNO3+Na2S2O3 → Ag2S2O3↓+2NaNO3 білий сирнистий осад AgNO3+KSCN → AgSCN↓+KNO3 білий осад AgSCN↓+2KSCN → K2[Ag(SCN)3] 2AgNO3+K2CrO4 →Ag2CrO4↓+2KNO3 цеглисто-червоний осад 2AgNO3+K2Cr2O7 → Ag2Cr2O7↓+2KNO3 темно-червоний осад
Способи добуваня елементів ІI В групи Добування цинку та кадмію Пірометалургійне добування металічного цинку та кадмію відбувається у дві стадії:спочатку випалюванням на повітрі переводять сульфіди в оксиди, які потім відновлюють вуглецем 2ZnS+3O2 →2ZnO+2SO2, ZnO+C → Zn+CO Добування ртуті Добування металічної ртуті з кіноварі відбувається в одну стадію, оскільки оксид ртуті (ІІ) при високих температурах нестійкий HgS + O2 → Hg + SO2
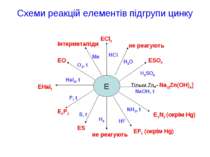
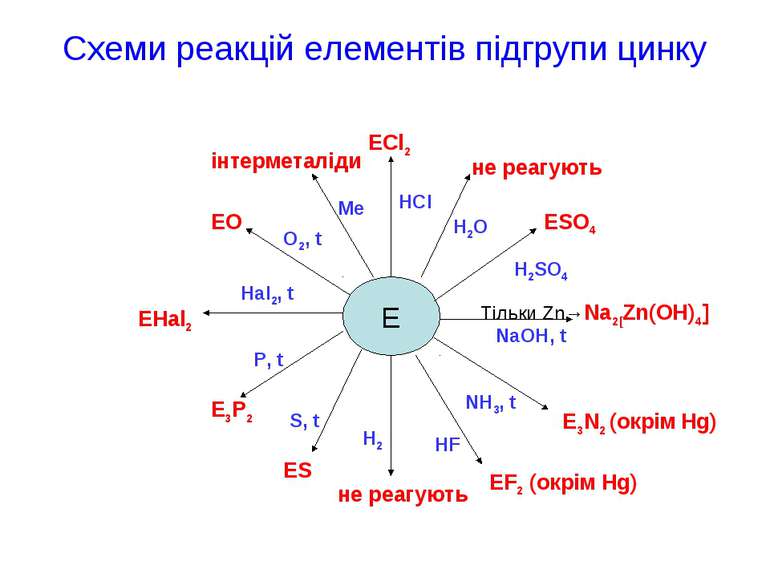
Схеми реакцій елементів підгрупи цинку E ECl2 не реагують ESO4 Тільки Zn→Na2[Zn(OH)4] E3N2 (окрім Hg) EF2 (окрім Hg) не реагують ES E3P2 EHal2 EO інтерметаліди P, t Hal2, t O2, t Me HCl H2O H2SO4 NaOH, t NH3, t HF H2 S, t
Якісні реакції на іони Zn2+ ZnSO4+(NH4)2S → ZnS↓+(NH4)2SO4 – білий осад ZnCl2+H2S → ZnS↓+2HCl – білий осад ZnCl2+NaOH → Zn(OH)2↓+2NaCl– білий осад 3ZnCl2+4Na2HPO4 → Zn3(PO4)2↓+2NaH2PO4+6NaCl– білий осад 3ZnCl2+2K4[Fe(CN)6] → Zn3K2[Fe(CN)6]↓+6KCl– білий осад ZnSO4+CuSO4+2(NH4)2[Hg(SCN)4] → Zn[Hg(SCN)4]*Cu[Hg(SCN)4]↓+2(NH4)2SO4– фіолетовий осад Zn(NO3)2+Co(NO3)2 → CoZnO2↓+4NO2+O2– “ринманова зелень” зеленого забарвлення
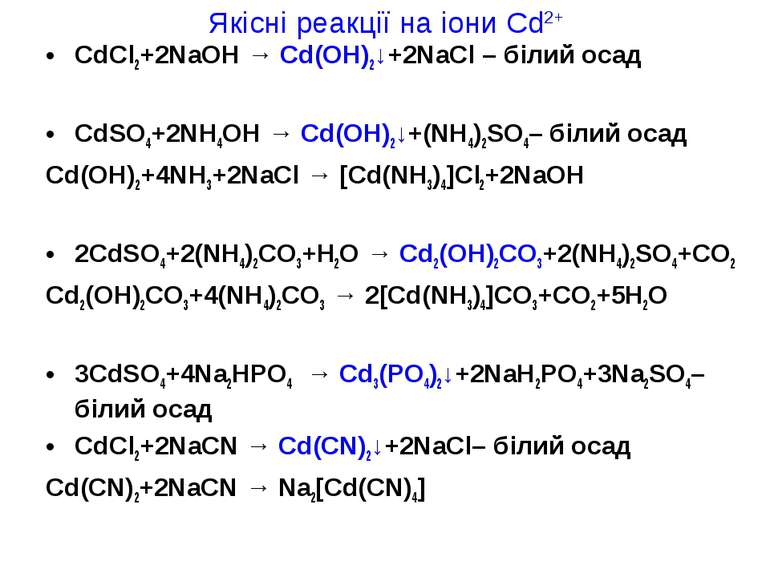
Якісні реакції на іони Cd2+ CdCl2+2NaOH → Cd(OH)2↓+2NaCl – білий осад CdSO4+2NH4OH → Cd(OH)2↓+(NH4)2SO4– білий осад Cd(OH)2+4NH3+2NaCl → [Cd(NH3)4]Cl2+2NaOH 2CdSO4+2(NH4)2CO3+H2O → Cd2(OH)2CO3+2(NH4)2SO4+CO2 Cd2(OH)2CO3+4(NH4)2CO3 → 2[Cd(NH3)4]CO3+CO2+5H2O 3CdSO4+4Na2HPO4 → Cd3(PO4)2↓+2NaH2PO4+3Na2SO4– білий осад CdCl2+2NaCN → Cd(CN)2↓+2NaCl– білий осад Cd(CN)2+2NaCN → Na2[Cd(CN)4]
Якісні реакції на іони Ртуті Hg2(NO3)2+2HCl → Hg2Cl2↓+2HNO3 – білий осад Hg2Cl2+2NH4OH → NH2HgCl+Hg+NH4Cl+2H2O Hg2(NO3)2+2NaOH → Hg2O↓+2NaNO3+H2O – чорний осад Hg2(NO3)2+2NH4OH → NH2HgNO3+Hg+NH4NO3+2H2O Hg2(NO3)2+Na2CO3 → Hg2CO3↓+2NaNO3 – жовтий осад Hg2CO3 → HgO+Hg+CO2↑ Hg2(NO3)2+Na2HPO4 → Hg2HPO4↓+2NaNO3 – білий осад Hg2(NO3)2+2KI → Hg2I2 ↓+2KNO3 – зеленуватий осад Hg2(NO3)2+K2Cr2O4 → Hg2Cr2O4 ↓+2KNO3 – червоний осад Hg2(NO3)2+2Na2S2O3→ HgS↓+S+Hg+SO2↑+Na2SO4+2NaNO3 – чорний осад Hg2(NO)2+Cu → Cu(NO3)2+2Hg HgCl2+H2S → HgS ↓ +2HCl – чорний осад HgCl2+2NH4OH → NH2HgCl ↓+NH4Cl+2H2O – білий осад 4HgCl2+4Na2CO3 → HgCO3*3HgO ↓+3CO2 ↑ – червоно-бурий осад 3Hg(NO3)2+4Na2HPO4 → Hg3(PO4)2 ↓+2NaH2PO4+6NaNO3 – білий осад Hg(NO3)2+2NH4SCN → Hg(SCN)2 ↓+2NH4NO3 – білий осад HgCl2+Cu → Hg+CuCl2
Способи добуваня елементів V I В групи Добування хрому Хромистий залізняк усумішші з содою нагрівають у спеціальних печах при наявності повітря. При цьому Хром (ІІІ) окиснюється до хромату: 4Fe(CrO2)2+8Na2CO3+7O2 →2Fe2O3+8Na2CrO4+8CO2↑ Далі хромат натрію відмивають водою від погано розчинного залишку, тпідкислюють сірчаною кислотою і переводять у дихромат Na2Cr2O7, який викристалізовують з розчину і відновлюють вугіллям: Na2Cr2O7+2C → Cr2O3+Na2CO3+CO Для добування хрому з оксиду використовують алюмотермічний метод, тобто нагрівають оксид з алюмінієм у спеціальних печах: Cr2O3+2Al →Al2O3+2Cr Добування молібдену Молібден добувають з молібденіту, випалюванням у спеціальних печах: 2MoS+7O2 → 2MoO3+4SO2 Після випалювання руду обробляють розчином аміаку, внаслідок чого у розчині утворюється сіль (NH4)2MoO4, яку відфільтровують від нерозчинних речовин. При підкисленні розчину сульфатної кислотиутворюється кислота H2MoO4, яку відновлюють воднем у трубчастих печах при температурі 950°С: H2MoO4+3H2 → 4H2O+Mo Добування вольфраму Вольфраміт спікають з содою при наявності повітря у спеціальних печах: 4FeWO4*MnWO4+3O2+2Na2CO3 → 2Fe2O3+4MnO2+8Na2WO4+8CO2↑ Na2WO4+2HCl →H2WO4+2NaCl H2WO4 →WO3+H2O WO3+3H3 →W+3H2O або WO3+3C → W+3CO↑ Добування урану Уран добувають електролізом розплавів подвійних галогенів або за такими реакціями: UCl4+4Na →4NaCl+U KUF5+2Mg →KF+2MgF2+U UF4+2Ca →2CaF2+U
Якісні реакції на іони Хрому 3Na2CO3+2CrCl3+3H2O →2Cr(OH)3↓+3CO2+6NaCl – сіро-зелений осад Cr2(SO4)3+3Na2S2O3+3H2O →2Cr(OH)3 ↓ +3Na2SO4+3S+3SO2 – сіро-зелений осад CrCl3+Na2HPO4 →CrPO4 ↓ +NaH2PO4+NaCl – зелений осад Na2CrO4+AgNO3 →2NaNO3+Ag2CrO4 ↓ – цеглисто-червоний осад Na2CrO4+(CH3COO)2Pb →2CH3COONa+PbCrO4 ↓ – жовтий осад
Способи добування елементів VІІ В групи Добування мангану Манган добувають у вигляді його сплаву з залізом – феромарганцю, який містить 60-90% мангану. Феромарганець добувають відновленням суміші оксидів металів коксом у доменних печах: MnO2+Fe2O3+5C →Mn+2Fe+5CO↑ Металічний манган без домішок заліза далі добувають методом алюмометрії: 3MnO2*xH2O → Mn3O4+O2+xH2O 3Mn3O4+8Al →4Al2O3+9Mn Магнан високого ступеня чистоти добувають електролізом водних розчинів MnSO4. Якісні реакції на іони Mn2+ MnSO4+(NH4)2S→(NH4)2SO4+MnS↓- зелений осад MnSO4+2NaOH →Na2SO4+Mn(OH)2 ↓ - білий осад MnCl2+Na2CO3 →2NaCl+MnCO3 ↓- білий осад 3MnSO4+4Na2HPO4 →2NaH2PO4+3Na2SO4+Mn3(PO4)2 ↓ - білий осад 2MnCl2+K4[Fe(CN)6] →4KCl+Mn2[Fe(CN)6]2 ↓- бурий осад MnO+Na2CO3+2KNO3 →2KNO2+CO2+Na2MnO4 ↓- зелений осад
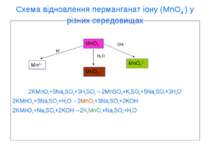
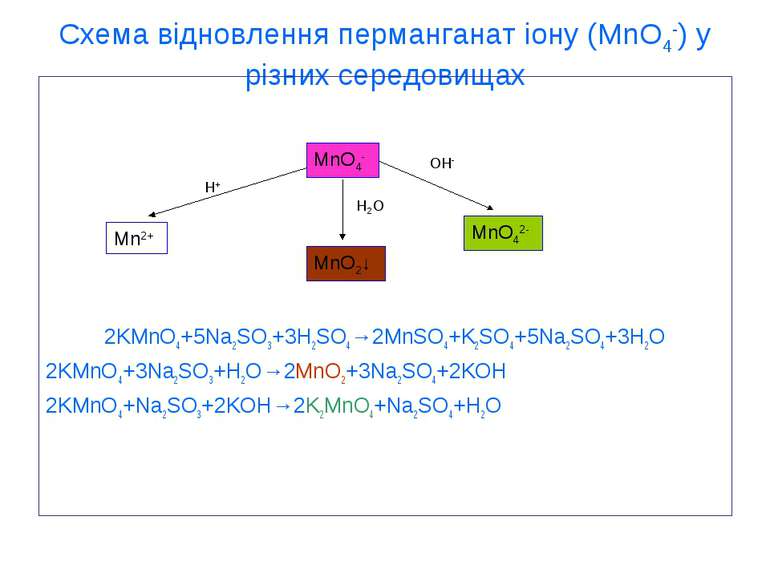
Схема відновлення перманганат іону (MnO4-) у різних середовищах 2KMnO4+5Na2SO3+3H2SO4→2MnSO4+K2SO4+5Na2SO4+3H2O 2KMnO4+3Na2SO3+H2O→2MnO2+3Na2SO4+2KOH 2KMnO4+Na2SO3+2KOH→2K2MnO4+Na2SO4+H2O MnO4- MnO2↓ Mn2+ MnO42- OH- H2O H+
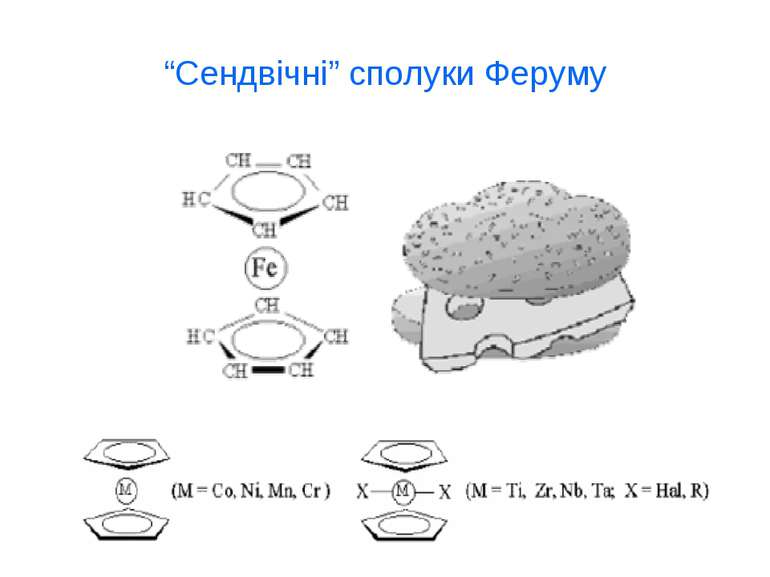
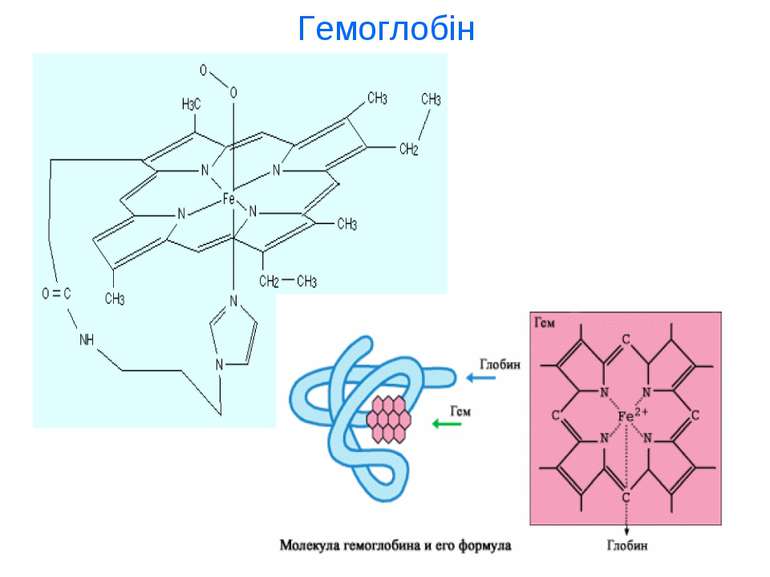
Якісні реакції на іони Fe2+ та Fe3+ FeSO4+(NH4)2S→FeS↓+(NH4)2SO4 – чорний осад FeSO4+2NaOH→Fe(OH)2 ↓ +Na2SO4 – білий осад 4FeCO3+O2+6H2O→4Fe(OH)3 ↓ +4CO2↑ - бурий осад 3FeSO4+2K3[Fe(CN)6]→Fe3[Fe(CN)6]2 ↓ +3K2SO4 – темно-синій осад “турнбулева синь” Fe2(SO4)3+6(NH4)2S →Fe2S3 ↓ +3(NH4)2SO4 – чорний осад 2FeCl3+3Na2CO3+H2O →2FeOHCO3 ↓ +6NaCl+CO2 ↑ - червоно-бурий осад 4FeCl3+3K4[Fe(CN)6] →Fe4[Fe(CN)6]3 ↓ +12KCl – темно-синій осад “берлінська лазур” FeCl3+3KSCN →FeSCN3 ↓ +3KCl – червоний осад
Схожі презентації
Категорії





![Схеми деяких реакцій Аргентуму та Ауруму Ag AgNO3 Na[Ag(CN)2] Ag2S AgF2, AgCl... Схеми деяких реакцій Аргентуму та Ауруму Ag AgNO3 Na[Ag(CN)2] Ag2S AgF2, AgCl...](https://svitppt.com.ua/images/24/23872/770/img5.jpg)




















![Схеми деяких реакцій Аргентуму та Ауруму Ag AgNO3 Na[Ag(CN)2] Ag2S AgF2, AgCl... Схеми деяких реакцій Аргентуму та Ауруму Ag AgNO3 Na[Ag(CN)2] Ag2S AgF2, AgCl...](https://svitppt.com.ua/images/24/23872/210/img5.jpg)