Презентація на тему:
Комплексоутворення в біологічних системах. Біогенні елементи.
Завантажити презентацію
Комплексоутворення в біологічних системах. Біогенні елементи.
Завантажити презентаціюПрезентація по слайдам:
План Поняття про комлексні сполуки (КС). Координаційна теорія Вернера. Будова КС. Класифікація та номенклатура КС. Значення КС. Комплексонометрія. Біогенні елементи.
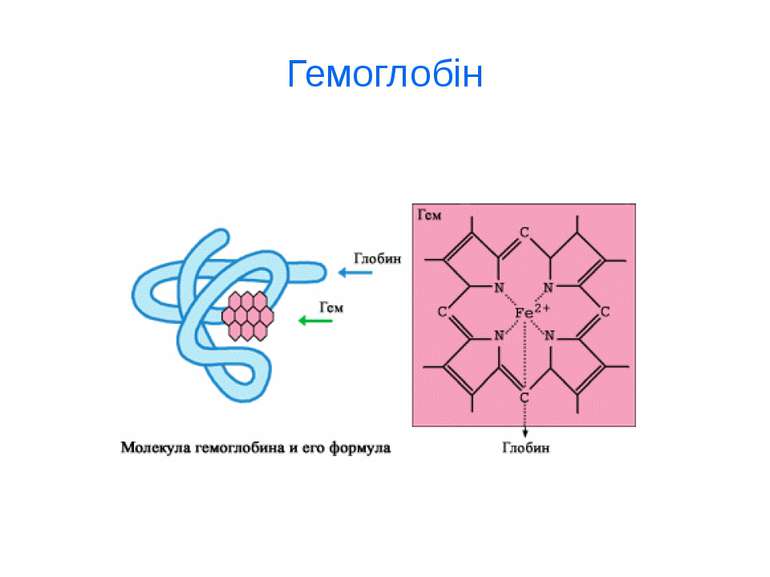
Комплексні сполуки [Cu (NH3)4] SO4 K4[Fe(CN)6] Комплексними називають складні сполуки, які мають комплексний йон, що складається з комплексоутворювача та координованих навколо нього лігандів, і який здатний самостійно існувати в розчині. Переважна більшість металів входить до складу тваринних організмів у вигляді КС.
Комплексні сполуки Координаційна теорія Вернера Будова [Cu (NH3)4] SO4 Cu2+ - комплексоутворювач (центральний атом) NH3 – ліганд (аденд) [Cu (NH3)4]2+ - комплексний іон (внутрішня координаційна сфера) SO42- - аніон (зовнішня координаційна сфера)
Комплексні сполуки Координаційна теорія Вернера CuSO4 + 4 NH3 = [Cu (NH3)4] SO4 [Cu (NH3)4] SO4
Комплексоутворювачі: Іони металів: Ag+, Cu2+, Cu+, Co3+, Al3+, Ni2+, Pb2+, Pt4+, Cr3+, Au3+, Fe2+, Fe3+ ... Атоми неметалів з позитивним ступенем окиснення: бор, силіцій, фосфор, S+4, S+6, P+3 К[ВF4] Заряд комплексного іона визначається алгебраїчною сумою зарядів простих іонів, що входять до його складу.
Ліганди: Іони: C2O42-, Cl-, I-, Br-, SO32-, CN- Нейтральні молекули: NH3, H2O, H2N – NH2 (гідразин) . Важливою характеристикою лігандів є їх координаційна ємність або дентатність, яка визначається числом місць,які ліганди займають у внутрішній сфері
Ліганди: Монодентатні ліганди Cl-, I-, Br-, CN- Бідентатні ліганди C2O42-, SO32- Полідентатні ліганди аніон ЕДТА
Заряд Координаційне число Приклади центрального атома +1 2 Ag+, Cu+ +2 4, 6 Cu2+, Zn2+, Pd2+, Pt2+ +3 6, 4 Pt4+, Cr3+, Co3+, Fe3+ +4 8 Координаційна теорія Вернера
1. ОДНОЯДЕРНІ (містять один центральний атом) Аміакати [Cu(NH3)4]SO4 Аквакомплекси [Al(H2O)6]Cl3 Ацидокомплекси K2[PtCl4] Змішанолігандні K[Pt(NH3)Cl3] Циклічні (хелатні) Основні типи комплексних сполук
Основні типи комплексних сполук ПОЛІЯДЕРНІ Місткові [Cr(NH3)5 – OH – (NH3)Cr]Cl3 Кластери (CO)5Mn – Mn(CО)5
Класифікація за зарядом комплексного йона Катіонні комплекси [Ag(NH3)2]Cl, Al[(H2O)6]Cl3 Аніонні комплекси K4[Fe(CN)6] Нейтральні комплекси [Fe(CO)5]
Хімічний зв*язок За методом валентних зв*язків утворення КС відбувається через донорно-акцепторну взаємодію між комплексоутворювачем та лігандами.
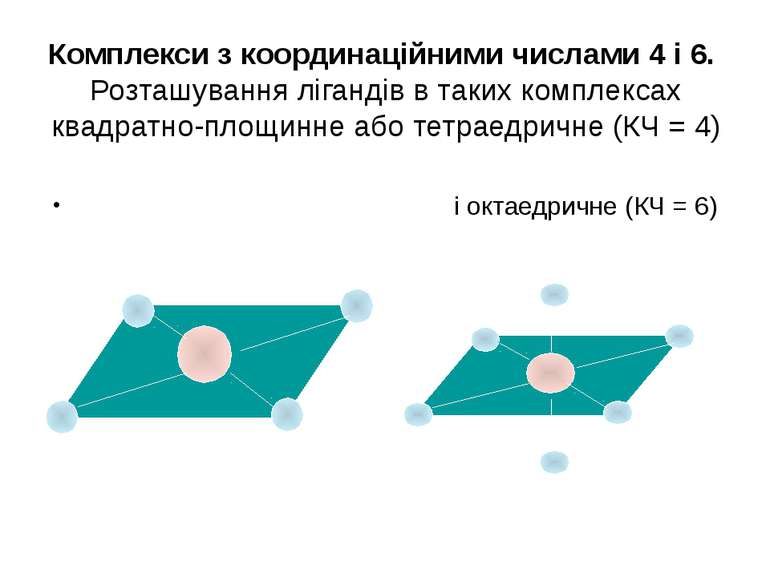
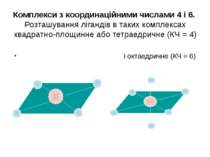
Комплекси з координаційними числами 4 і 6. Розташування лігандів в таких комплексах квадратно-площинне або тетраедричне (КЧ = 4) і октаедричне (КЧ = 6)
Спочатку в називному відмінку називають катіон (простий або комплексний), потім називають аніон. Аніонні комплекси мають суфікс –ат. Ліганди перелічують за абеткою, вказуючи їх число, а потім називають центральний атом. Називають електронегативні ліганди з закінченням на „о”: Cl-– хлоро, CN- – ціано, NО2- – нітро і т.д. позначаючи їх грецькими числівниками: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта, 8 – окта. Якщо в сполуці присутні ліганди – нейтральні молекули, позначають і їх (NH3 – амін, H2O – аква). Номенклатура комплексних сполук
Центральному атому дають латинську назву елемента з закінченням „ат” (якщо елемент має змінний ступінь окислення, її вказують в дужках римськими цифрами перед назвою елемента). К4[Fe(CN)6] – калій гексаціаноферат(ІІ) K3[Fe(CN)6] – калій гексаціаноферат (ІІІ) Na2[Zn(OH)4] – натрій тетрагідроксоцинкат Номенклатура комплексних сполук. що містять комплексний аніон
Дають назву комплексному катіону: називають електронегативні ліганди із закінченням на „о” називають молекулярні ліганди із закінченням на „о” (якщо вони є) Вказують кількість лігандів грецькими числівниками. Називають центральний атом відповідно до української назви еле- мента. Називають аніон, що утворює зовнішню координаційну сферу (сульфат, нітрат, хлорид). [Ag(NH3)2]Cl – діамінаргентум хлорид [Cr(H2O)6]Cl – гексааквахром(ІІІ) хлорид Сполуки, що містять комплексний катіон
Комплексиметрія Комплексиметричним титруванням, або комплексиметрією, називають титриметричні методи, які базуються на реакціях утворення розчинних комплексів. . В методі комплексиметричного титрування виділяють такі методи: меркуриметрія; фторидометрія; ціанідометрія; комплексонометрія.
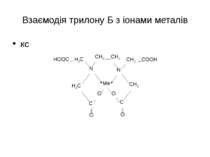
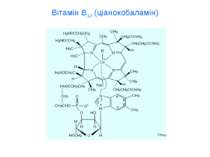
Комплексонометрія Комплексонометрія – титриметричний метод аналізу, який базується на використанні реакцій іонів-комплексоутворювачів з комплексонами, які супроводжуються утворенням стійких малодисоційованих розчинних у воді внутрішньокомплексних солей. Комплексони – це амінокарбонові кислоти або їх солі. Етилендіамінтетраоцтова кислота та її натрієва сіль.
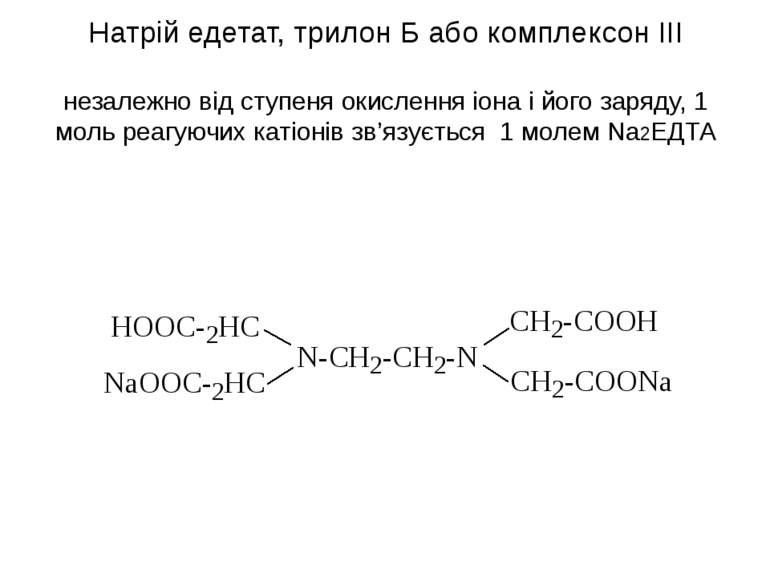
Натрій едетат, трилон Б або комплексон ІІІ незалежно від ступеня окислення іона і його заряду, 1 моль реагуючих катіонів зв’язується 1 молем Na2ЕДТА
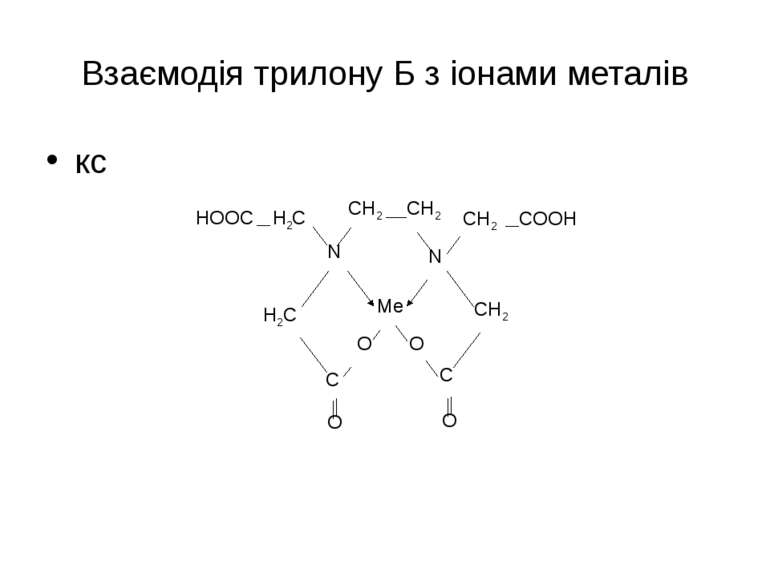
Взаємодія трилону Б з іонами металів Са2+ + [H2Y]2- → [CaY]2- + 2H+ In3+ + [H2Y]2- → [InY]- + 2H+ Th4+ + [H2Y]2- → [ThY] + 2H+ Індикатори – еріохром чорний, ксиленоловий оранжевий Аналіз питної води .
Твердість води Твердість води визначається наявністю в ній розчинних солей, в основному сульфатів, хлоридів і бікарбонатів кальцію і магнію. Твердість води, обумовлена гідрокарбонатами Са(ІІ), Mg(II), називається тимчасовою твердістю. Тимчасова твердість усувається кип’ятінням: гідрокарбонати перетворюються в середні карбонати і випадають в осад. В результаті цього вміст солей у воді знижується. М(НСО3)2 МСО3 + СО2 + Н2О
Постійна твердість Постійну твердість води неможливо усунути простим кип’ятінням води; вона обумовлена присутністю відносно добре розчинних сульфатів, хлоридів, які не руйнуються при кип’ятінні. Для усунення постійної твердості води розроблені різні методи, наприклад: СaSO4 + Na2CO3 CaCO3 + Na2SO4.
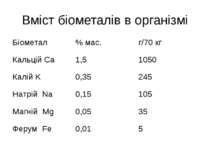
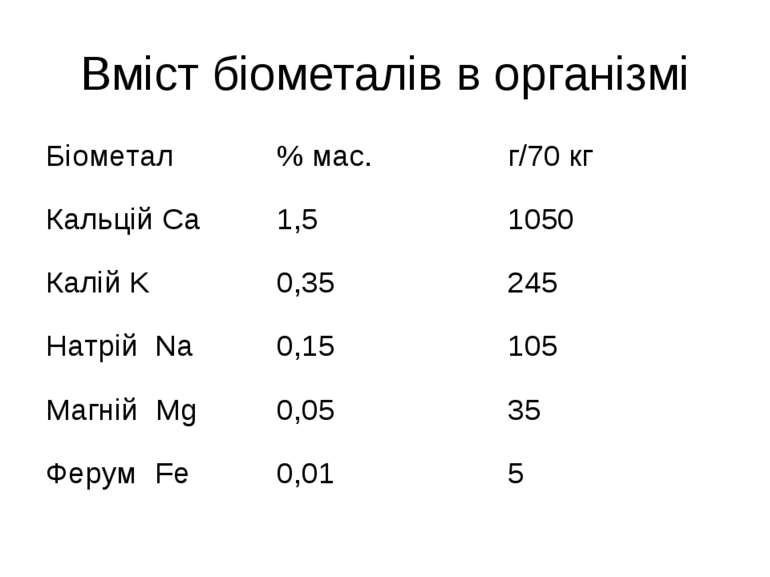
Біогенні елементи В тілі людини і вищих тварин виявлено біля 80 хімічних елементів, що надходять в організм разом з водою і їжею, з них 47 елементи є постійно, тому вони називаються біогенними. Найважливішими є хімічні елементи, що становлять 97,5 % від загальної маси організму. Це шість елементів О, С, Н, N, P, S, які є органогенними елементами.
Біогенні елементи Залежно від кількісного вмісту всі біоелементи А.Виноградов розділив на макро-, мікро- і ультрамікроелементи. До макроелементів, крім елементів-органогенів, відносять елементи, вміст яких в організмі становить 0,01 % і більше маси тіла: натрій Na, калій K, кальцій Ca, магній Mg, хлор Cl. Макроелементи виконують роль пластичного матеріалу
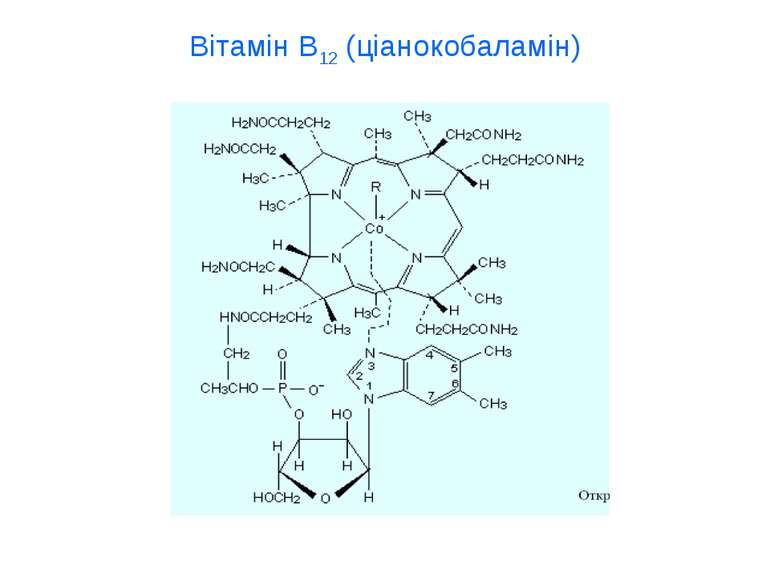
Біогенні елементи Мікроелементи – 10-3–10-5 %. Це йод, бром, фтор, ферум, купрум, алюміній, манган, кобальт, цинк, стронцій, літій, хром, селен, молібден, нікол. Мікроелементи входять до складу ферментів, вітамінів, гормонів Ультрамікроелементи – ртуть, золото, силіцій.
s-елементи Натрій Солі натрію в організмі знаходяться переважно в розчинному стані в плазмі крові, в лімфі, в лікворі, в травних соках. В клітинах натрію значно менше, тому він зосереджується в позаклітинних зонах. Натрій відіграє важливу роль у затриманні води в організмі. Підраховано, що 1 г натрію може затримати до 25 г води. У зв'язку з тим, що іони натрію в рідинах і міжклітинних зонах найбільше, йому належить важлива роль у перерозподілі води між клітинами i рідинами організму, а також в регуляції обміну води в цілому. Натрій хлорид є основним матеріалом, з якого утворюється соляна кислота. В цьому процесі беруть також участь хлориди калію, кальцію та магнію. Ці солі відіграють найбільшу роль в осмотичних процесах. Іони натрію також необхідні для нормальної збудливості м'язів.
Калій Солі калію, як і натрію, добре розчинні у воді, вони є у всіх тканинах організму. На відміну від натрію, калій в більших кількостях міститься в клітинах, тому натрій звичайно звуть екстрацелюлярним, а калій iнтpaцелюлярним елементом. Так, наприклад, з 8 - 9 г калію, що є в крові, 95 - 96% знаходиться в еритроцитах i лише 3 - 5% у плазмі. Багато калію в травних соках. Іони калію посилюють функції парасимпатичної нервової системи i зменшують збуджуючий вплив натрію на м'язи. Калій посилює дію ацетилхоліну на нервові закінчення в м'язах.
Кальцій Основна маса кальцію міститься в кістках у вигляді солей фосфорної кислоти - оксіапатитів [Са10(РО4)6(ОН)2]. Мінеральна частина кісток складається з мікрокристалів оксіапатиту, на аморфній основі яких сорбуються карбонат (6%), цитрат (1%), натрій (0,7%), магній (0,7%), а також у невеликих кількостях фтор. Оксіапатити в невеликих кількостях також міститься в складі плазми крові. У великій кількості е кальцій в тканинах зубів, особливо в емалі. Невеликі кількості кальцію (10-11 мкмоль є в крові у вигляді розчинних солей (СаСl2). Кальцій необхідний для коагуляції крові та функції м'язів. Кальцій заспокоює нервову систему i зменшує проникність і спазм судин. Кальцієві солі входять до складу фосфоропротеїду — казеїногену молока. Обмін кальцію в організмі в значній мірі пов’язаний з вітамінами групи D, з функцією паращитовидних залоз та обміном вуглеводів
Визначення іонів кальцію Ca 2+ СaCl2 + (NH4)2CO3 CaCO3 + 2NH4Cl білий аморфний осад; Сa2+ + SO42– CaSO4 ; Ca2+ + C2O42– CaC2O4 , кальцій оксалат K4[Fe(CN)6] + Ca2+ K2Ca[Fe(CN)6] – білий осад; Ca2+ + HPO42– CaHPO4 – білий осад; Леткі солі кальцію забарвлюють полум я в цеглисто-червоний колір.
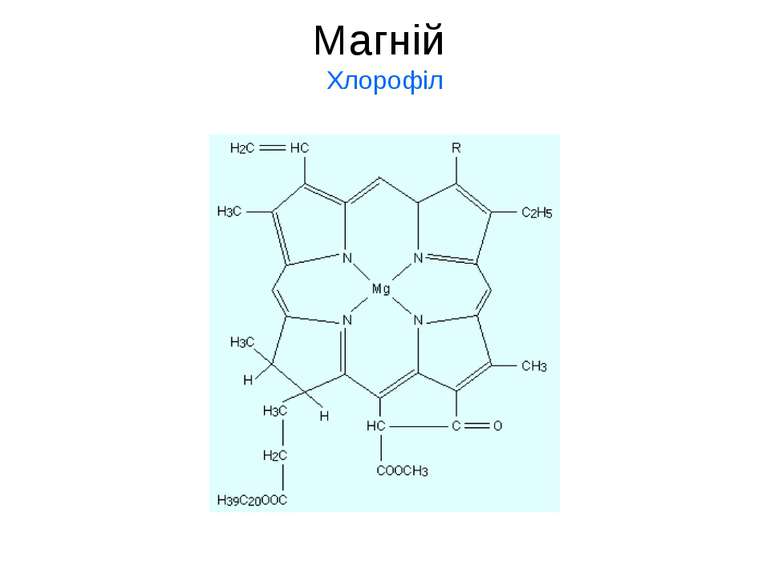
Магній Сполуки Мg містяться у внутрішньоклітинних рідинах у вигляді гідратованиї йонів, а в кістках скелету та емалі зубів – у вигляді нерозчинних фосфатів
P-елементи Хлор, Йод Хлор міститься у вигляді аніону солей натрію, калію, кальцію, магнію та марганцю у всіх рідинах організму людини та тварин. Аніони хлору разом з іонами натрію та калію відіграють основну роль у підтриманні сталості осмотичного тиску плазми крові, лімфи та інших рідин. Більша частина (65-70%) всього осмотичного тиску плазми крові забезпечується хлоридами, Вони відіграють важливу роль у підтриманні іонної рівноваги, а отже, i регуляції концентрації водневих іонів. Іонам хлору та хлоридам взагалі належить також важлива роль в утворенні соляної кислоти шлункового соку.
йод В організмі людини міститься близько 25 мг йоду, з яких 15 — у щитовидні й залозі. Йод входить до складу гормону щитовидної залози — тироксину. Крім того, в невеликій кількості він завжди е в крові, що необхідно для нормальної функції щитовидної залози. Добова потреба в йоді дорівнює приблизно 100 мікрограмам, або найменше 1 мікрограму на і кг ваги тіла. При недостатності йоду у воді i їжі послаблюється функція щитовидної залози i замість залозистої тканини розростається сполучна тканина, утворюючи досить значні нарости на передній поверхні шиї. В зв'язку з цим i захворювання має назву зобної хвороби.
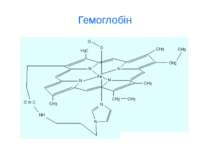
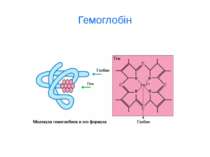
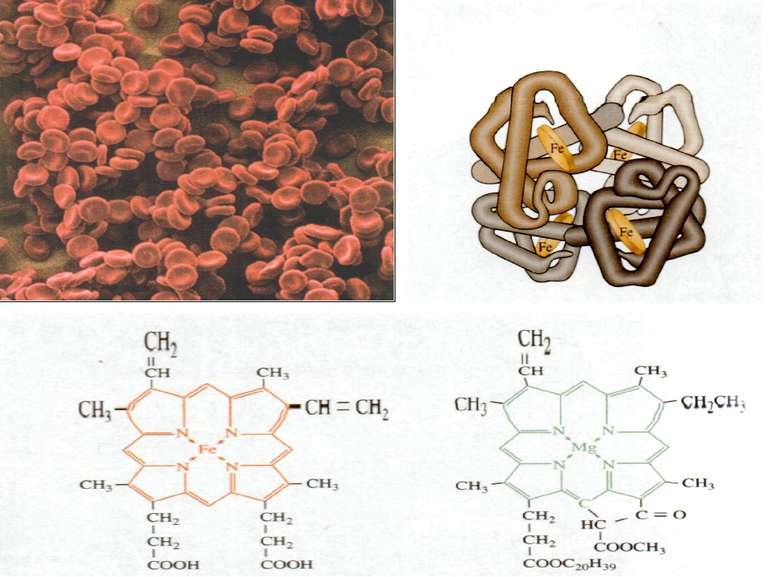
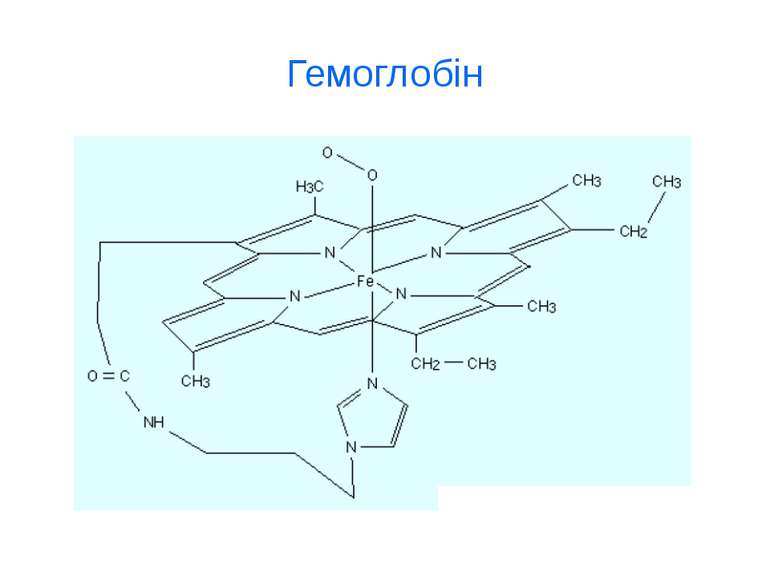
d-елементи ферум Біологічна роль заліза обумовлена головним чином тим, що воно входить до складу гемоглобіну, міоглобіну та великої групи ферментів тканинного дихання. В організмі людини міститься 3- 5 г заліза, з яких близько 73 % знаходиться в гемоглобіні, 3 - 5 %- — у міоглобіні, 15-16% зв'язано у вигляді залізо-6ілкових комплексів – феритину, що є запасною формою заліза; 0,1% міститься в плазмі у вигляді залізовмісного білка сидерофіліну та близько 0,1% входить до складу ферментів.
d-елементи VІІI В групи Елемент 26Fe Розподіл електронів на зовнішньому рівні 3d 6 4s 2 Атомний радіус, нм 0.126 Характерні с.о. +6, +3, +2, 0 Основні мінерали Fe3O4 - магнетит Fe2O3 – гематит Fe2O3*H2O- лімоніт Стабільні ізотопи 56Fe
Якісні реакції на іони Fe2+ та Fe3+ FeSO4+(NH4)2S→FeS↓+(NH4)2SO4 – чорний осад FeSO4+2NaOH→Fe(OH)2 ↓ +Na2SO4 – білий осад 3FeSO4+2K3[Fe(CN)6]→Fe3[Fe(CN)6]2 ↓ +3K2SO4 – темно-синій осад “турнбулева синька” Fe2(SO4)3+6(NH4)2S →Fe2S3 ↓ +3(NH4)2SO4 – чорний осад 4FeCl3+3K4[Fe(CN)6] →Fe4[Fe(CN)6]3 ↓ +12KCl – темно-синій осад “берлінська блакить” FeCl3+3KSCN →Fe(SCN)3 ↓ +3KCl червоний осад
Купрум Мідь необхідна для процесу утворення крові при нестачі в організмі людини або тварини міді послаблюється утворення гемоглобіну i розвивається анемія. мідь підсилює дію інсуліну i гормонів гіпофіза, які стимулюють розвиток i функцію статевих залоз. Мідь виявлено в еритроцитах та печінці — у вигляді білка гемокупреїну. Крім того, вона утворює комплекси з білками плазми. Мідь входить до складу ферментів: альдолази, каталази. Малі дози міді гальмують розпад глікогену i тим самим сприяють збереженню його в організмі. Солі міді застосовуються в очній, дерматологічній, уролопчній та гінеколопчній клініці.
Цинк Найкраще вивченим ферментом є карбоксипептидаза Цинк входить до фермента алкогольдегідрогенази Цинк входить до складу інсуліну i подібно марганцю підсилює дію його. Цинк також входить до складу гіпофіза i статевих залоз. Він е складовою частиною ферменту карбоангідрази, що каталізує розщеплення вуглекислоти на Н2О та СО2.
Схожі презентації
Категорії



![Комплексні сполуки [Cu (NH3)4] SO4 K4[Fe(CN)6] Комплексними називають складні... Комплексні сполуки [Cu (NH3)4] SO4 K4[Fe(CN)6] Комплексними називають складні...](https://svitppt.com.ua/images/10/9148/770/img2.jpg)

![Комплексні сполуки Координаційна теорія Вернера Будова [Cu (NH3)4] SO4 Cu2+ -... Комплексні сполуки Координаційна теорія Вернера Будова [Cu (NH3)4] SO4 Cu2+ -...](https://svitppt.com.ua/images/10/9148/770/img4.jpg)
![Комплексні сполуки Координаційна теорія Вернера CuSO4 + 4 NH3 = [Cu (NH3)4] S... Комплексні сполуки Координаційна теорія Вернера CuSO4 + 4 NH3 = [Cu (NH3)4] S...](https://svitppt.com.ua/images/10/9148/770/img5.jpg)




![1. ОДНОЯДЕРНІ (містять один центральний атом) Аміакати [Cu(NH3)4]SO4 Аквакомп... 1. ОДНОЯДЕРНІ (містять один центральний атом) Аміакати [Cu(NH3)4]SO4 Аквакомп...](https://svitppt.com.ua/images/10/9148/770/img10.jpg)
![Основні типи комплексних сполук ПОЛІЯДЕРНІ Місткові [Cr(NH3)5 – OH – (NH3)Cr]... Основні типи комплексних сполук ПОЛІЯДЕРНІ Місткові [Cr(NH3)5 – OH – (NH3)Cr]...](https://svitppt.com.ua/images/10/9148/770/img12.jpg)
![Класифікація за зарядом комплексного йона Катіонні комплекси [Ag(NH3)2]Cl, Al... Класифікація за зарядом комплексного йона Катіонні комплекси [Ag(NH3)2]Cl, Al...](https://svitppt.com.ua/images/10/9148/770/img13.jpg)






![Взаємодія трилону Б з іонами металів Са2+ + [H2Y]2- → [CaY]2- + 2H+ In3+ + [H... Взаємодія трилону Б з іонами металів Са2+ + [H2Y]2- → [CaY]2- + 2H+ In3+ + [H...](https://svitppt.com.ua/images/10/9148/770/img22.jpg)




















![Комплексні сполуки [Cu (NH3)4] SO4 K4[Fe(CN)6] Комплексними називають складні... Комплексні сполуки [Cu (NH3)4] SO4 K4[Fe(CN)6] Комплексними називають складні...](https://svitppt.com.ua/images/10/9148/210/img2.jpg)

![Комплексні сполуки Координаційна теорія Вернера Будова [Cu (NH3)4] SO4 Cu2+ -... Комплексні сполуки Координаційна теорія Вернера Будова [Cu (NH3)4] SO4 Cu2+ -...](https://svitppt.com.ua/images/10/9148/210/img4.jpg)
![Комплексні сполуки Координаційна теорія Вернера CuSO4 + 4 NH3 = [Cu (NH3)4] S... Комплексні сполуки Координаційна теорія Вернера CuSO4 + 4 NH3 = [Cu (NH3)4] S...](https://svitppt.com.ua/images/10/9148/210/img5.jpg)




![1. ОДНОЯДЕРНІ (містять один центральний атом) Аміакати [Cu(NH3)4]SO4 Аквакомп... 1. ОДНОЯДЕРНІ (містять один центральний атом) Аміакати [Cu(NH3)4]SO4 Аквакомп...](https://svitppt.com.ua/images/10/9148/210/img10.jpg)
![Основні типи комплексних сполук ПОЛІЯДЕРНІ Місткові [Cr(NH3)5 – OH – (NH3)Cr]... Основні типи комплексних сполук ПОЛІЯДЕРНІ Місткові [Cr(NH3)5 – OH – (NH3)Cr]...](https://svitppt.com.ua/images/10/9148/210/img12.jpg)
![Класифікація за зарядом комплексного йона Катіонні комплекси [Ag(NH3)2]Cl, Al... Класифікація за зарядом комплексного йона Катіонні комплекси [Ag(NH3)2]Cl, Al...](https://svitppt.com.ua/images/10/9148/210/img13.jpg)







![Взаємодія трилону Б з іонами металів Са2+ + [H2Y]2- → [CaY]2- + 2H+ In3+ + [H... Взаємодія трилону Б з іонами металів Са2+ + [H2Y]2- → [CaY]2- + 2H+ In3+ + [H...](https://svitppt.com.ua/images/10/9148/210/img22.jpg)