Презентація на тему:
Білки. Версія 1
Завантажити презентацію
Білки. Версія 1
Завантажити презентаціюПрезентація по слайдам:
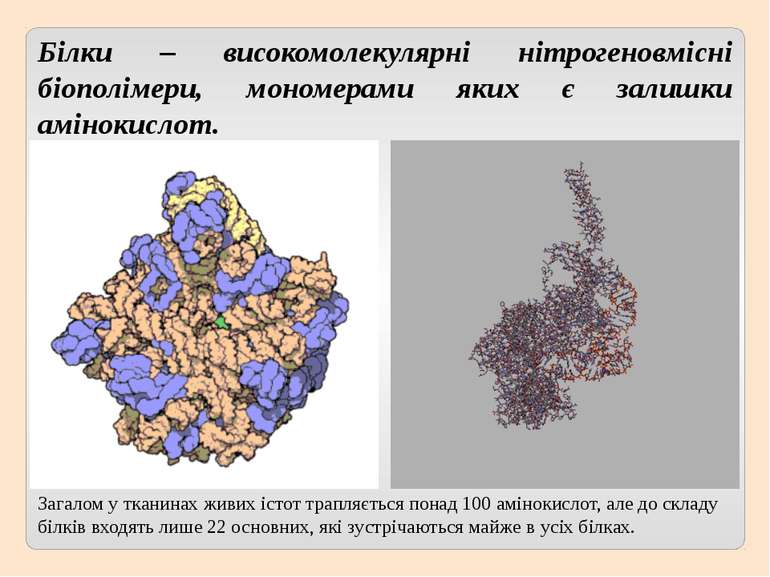
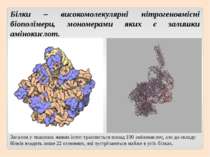
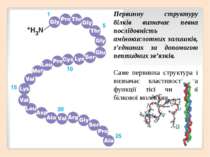
Білки – високомолекулярні нітрогеновмісні біополімери, мономерами яких є залишки амінокислот. Загалом у тканинах живих істот трапляється понад 100 амінокислот, але до складу білків входять лише 22 основних, які зустрічаються майже в усіх білках.
Існують різні класифікації амінокислот. Зокрема, амінокислоти поділяють на замінні та незамінні. Замінні амінокислоти організму людини і тварин здатні синтезуватися з продуктів обміну речовин. Натомість, незамінні амінокислоти в організмах людини і тварин не утворюються, а надходять разом з їжею. Ці амінокислоти синтезують рослини, гриби, бактерії. Білки, які містять усі незамінні амінокислоти, називають повноцінними, на відміну від неповноцінних, до складу яких не входять окремі незамінні амінокислоти.
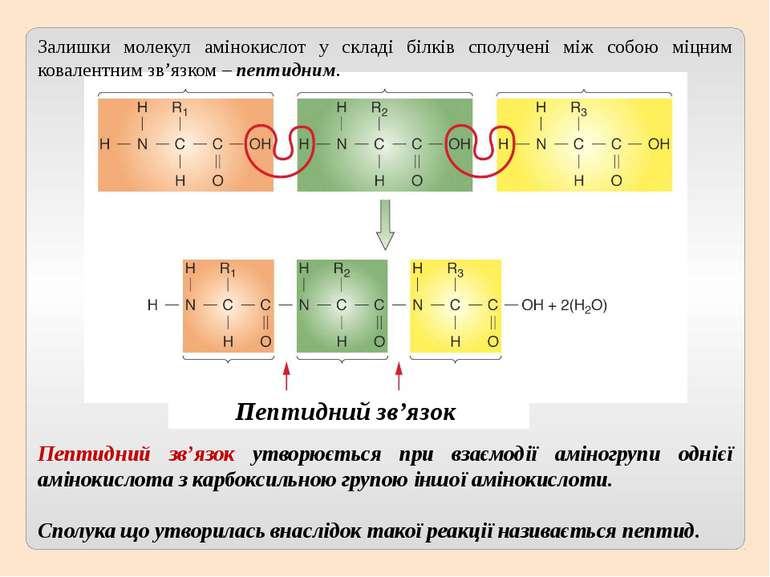
Пептидний зв’язок утворюється при взаємодії аміногрупи однієї амінокислота з карбоксильною групою іншої амінокислоти. Сполука що утворилась внаслідок такої реакції називається пептид. Пептидний зв’язок Залишки молекул амінокислот у складі білків сполучені між собою міцним ковалентним зв’язком – пептидним.
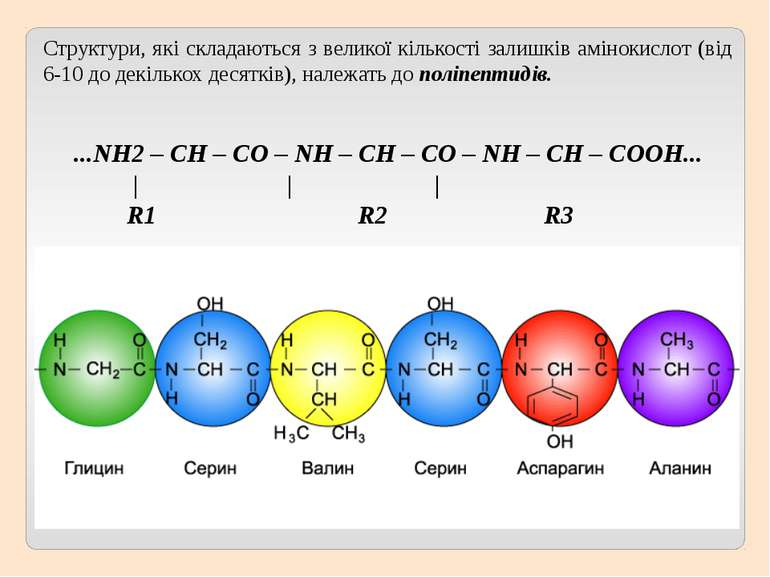
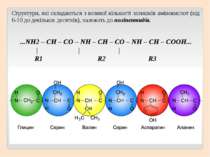
Структури, які складаються з великої кількості залишків амінокислот (від 6-10 до декількох десятків), належать до поліпептидів. ...NH2 – CH – CO – NH – CH – CO – NH – СН – COOH... | | | R1 R2 R3
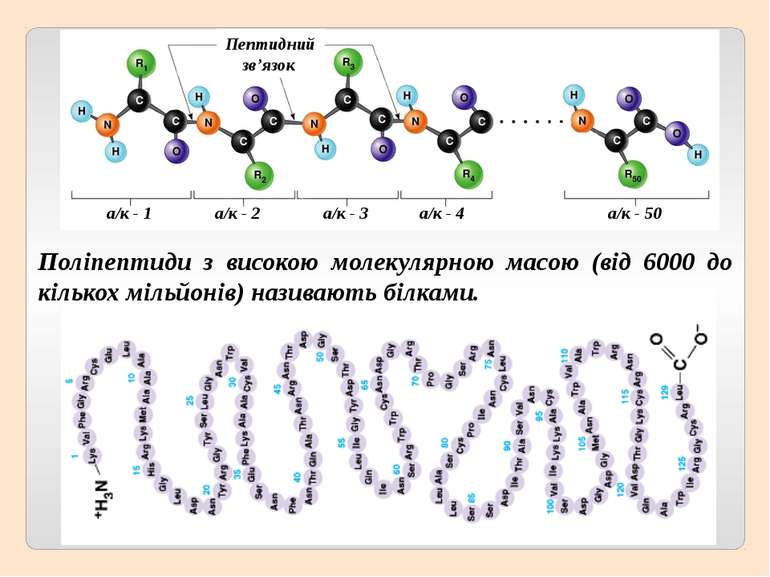
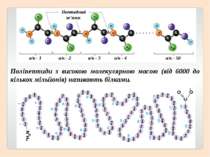
Поліпептиди з високою молекулярною масою (від 6000 до кількох мільйонів) називають білками. Пептидний зв’язок а/к - 1 а/к - 2 а/к - 3 а/к - 4 а/к - 50
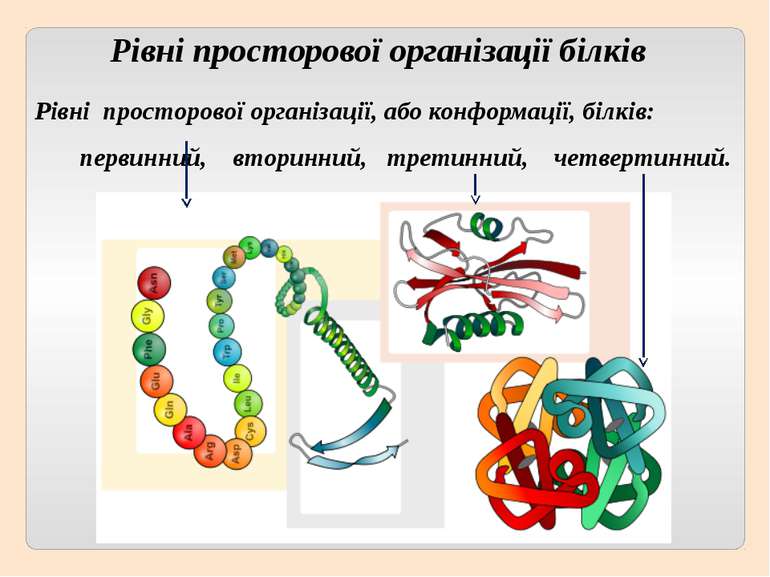
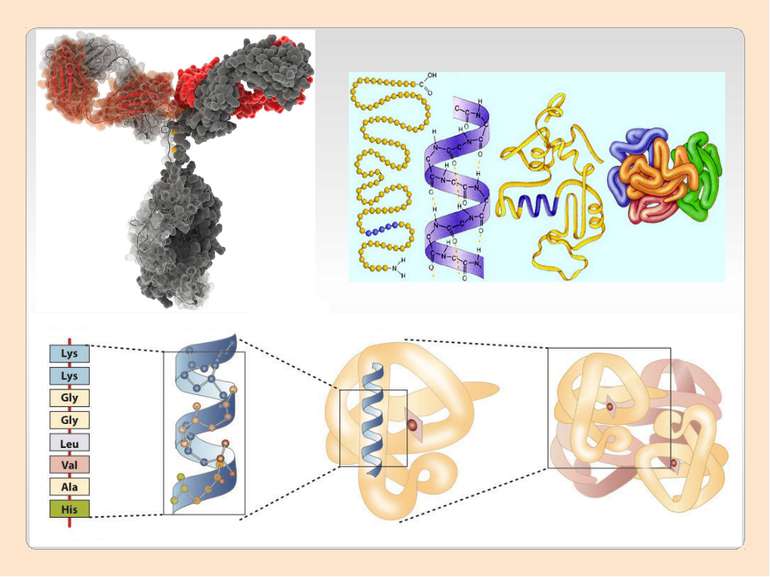
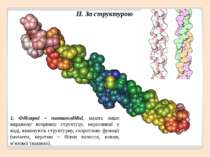
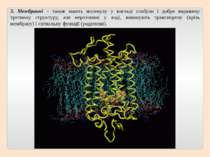
Рівні просторової організації білків Рівні просторової організації, або конформації, білків: первинний, вторинний, третинний, четвертинний.
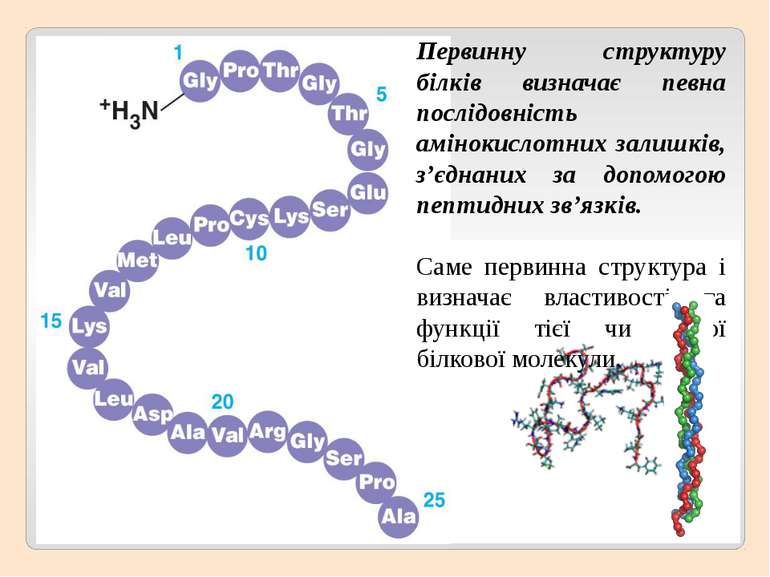
Первинну структуру білків визначає певна послідовність амінокислотних залишків, з’єднаних за допомогою пептидних зв’язків. Саме первинна структура і визначає властивості та функції тієї чи іншої білкової молекули.
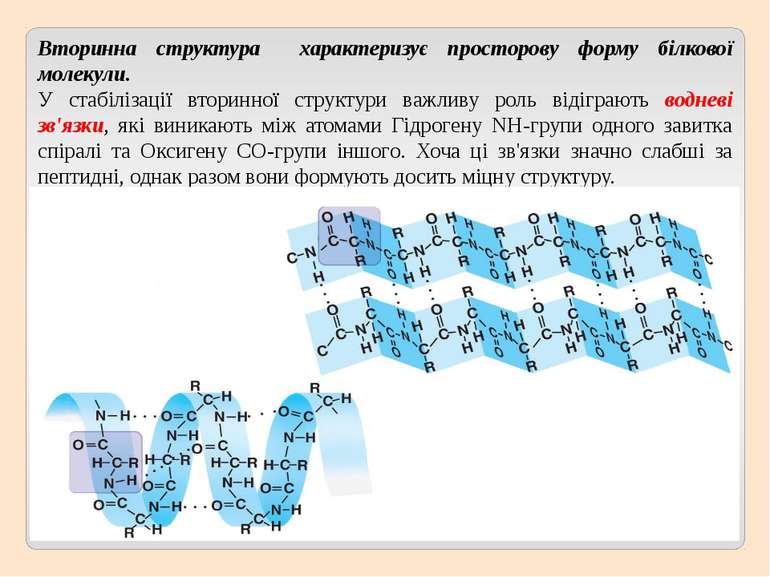
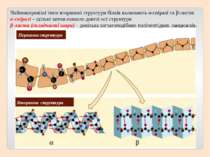
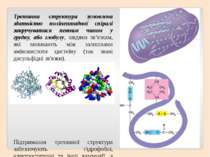
Вторинна структура характеризує просторову форму білкової молекули. У стабілізації вторинної структури важливу роль відіграють водневі зв'язки, які виникають між атомами Гідрогену NH-групи одного завитка спіралі та Оксигену CO-групи іншого. Хоча ці зв'язки значно слабші за пептидні, однак разом вони формують досить міцну структуру.
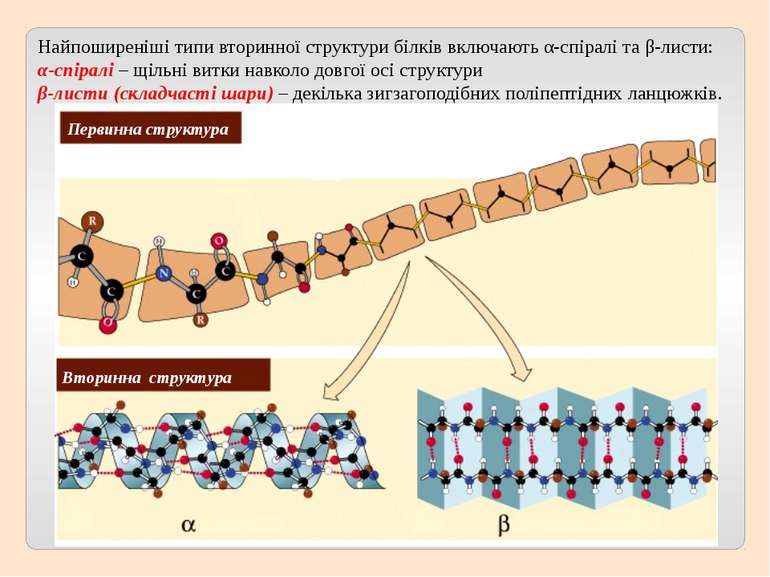
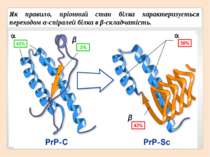
Первинна структура Вторинна структура Найпоширеніші типи вторинної структури білків включають α-спіралі та β-листи: α-спіралі – щільні витки навколо довгої осі структури β-листи (складчасті шари) – декілька зигзагоподібних поліпептідних ланцюжків.
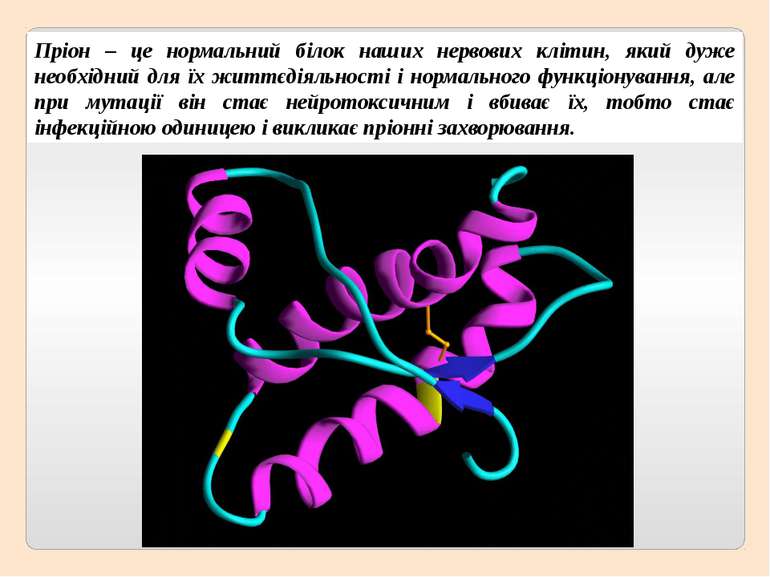
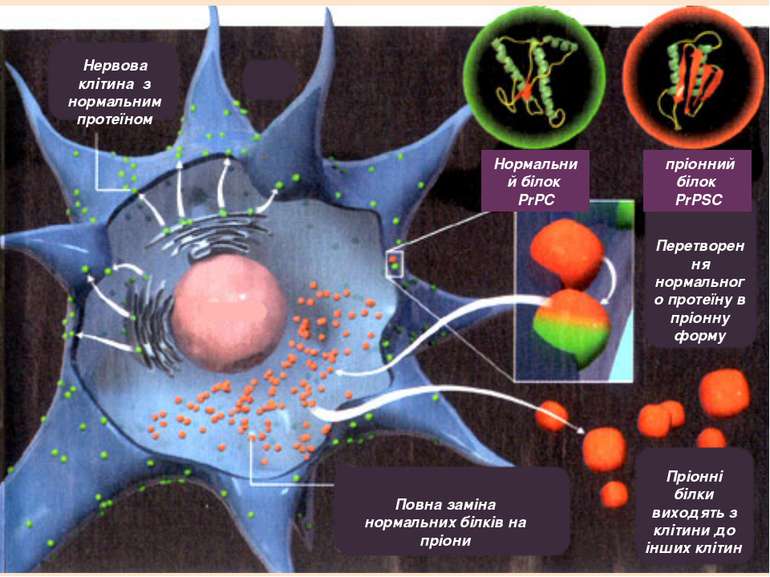
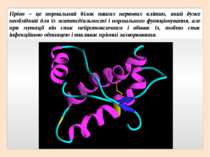
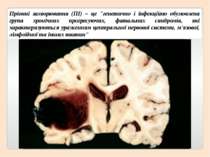
Пріон – це нормальний білок наших нервових клітин, який дуже необхідний для їх життєдіяльності і нормального функціонування, але при мутації він стає нейротоксичним і вбиває їх, тобто стає інфекційною одиницею і викликає пріонні захворювання.
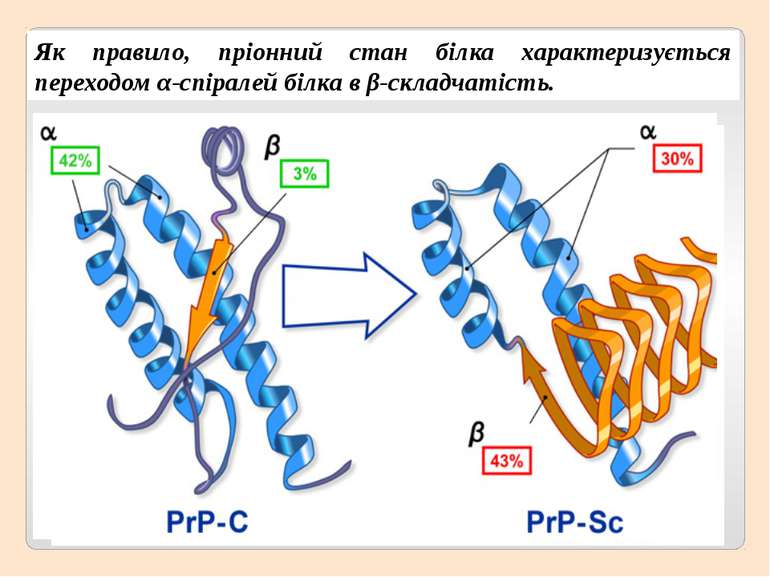
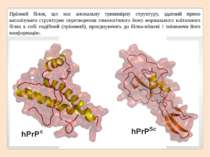
Як правило, пріонний стан білка характеризується переходом α-спіралей білка в β-складчатість.
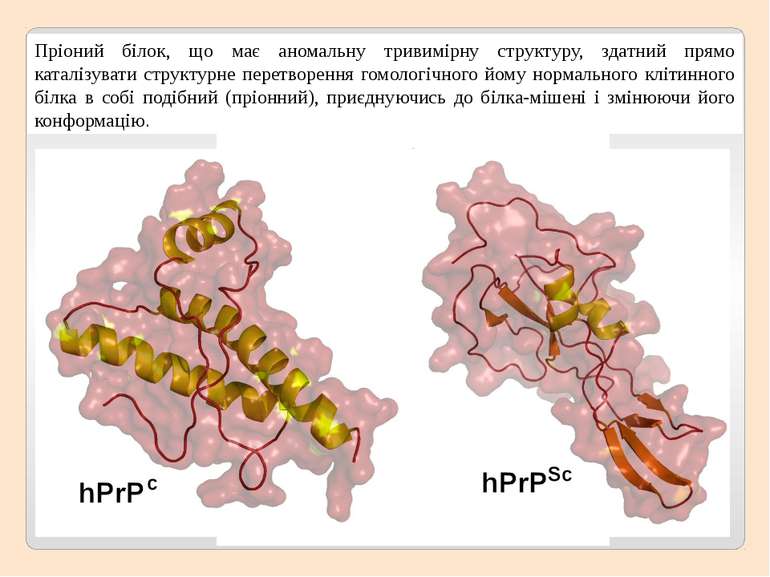
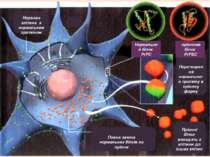
Пріоний білок, що має аномальну тривимірну структуру, здатний прямо каталізувати структурне перетворення гомологічного йому нормального клітинного білка в собі подібний (пріонний), приєднуючись до білка-мішені і змінюючи його конформацію.
Нервова клітина з нормальним протеїном Перетворення нормального протеїну в пріонну форму Пріонні білки виходять з клітини до інших клітин Повна заміна нормальних білків на пріони Нормальний білок PrPC пріонний білок PrPSC
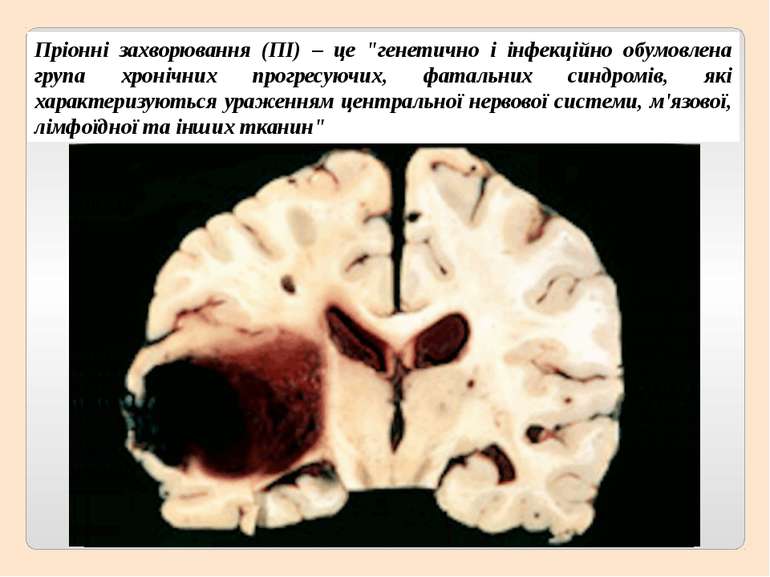
Пріонні захворювання (ПІ) – це "генетично і інфекційно обумовлена група хронічних прогресуючих, фатальних синдромів, які характеризуються ураженням центральної нервової системи, м'язової, лімфоїдної та інших тканин"
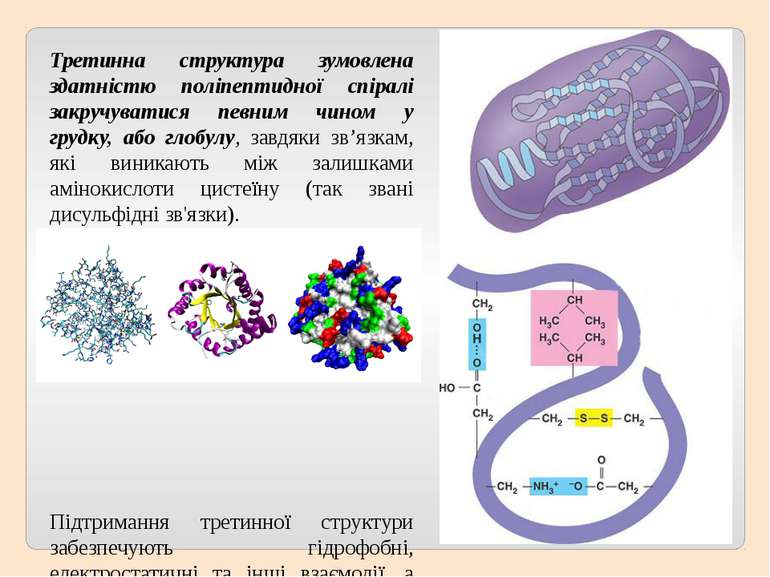
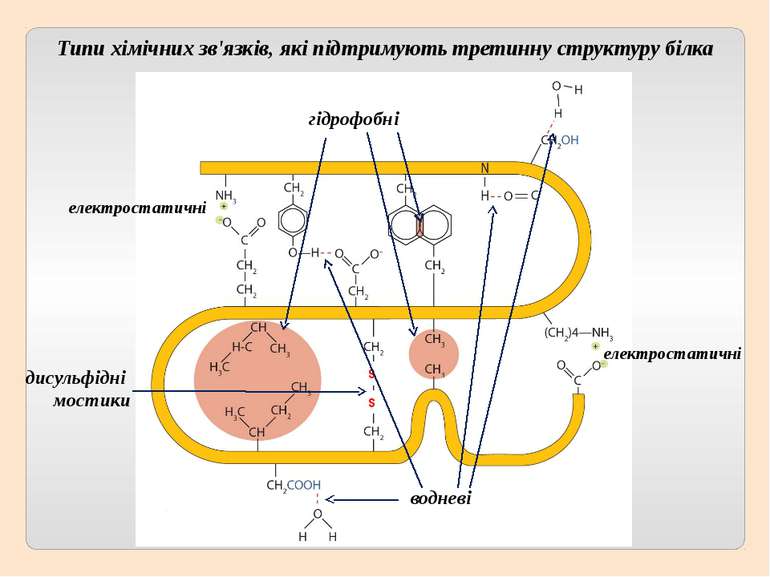
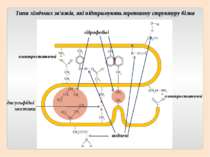
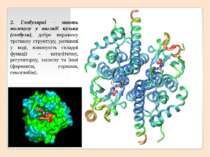
Третинна структура зумовлена здатністю поліпептидної спіралі закручуватися певним чином у грудку, або глобулу, завдяки зв’язкам, які виникають між залишками амінокислоти цистеїну (так звані дисульфідні зв'язки). Підтримання третинної структури забезпечують гідрофобні, електростатичні та інші взаємодії, а також водневі зв'язки.
S S електростатичні гідрофобні дисульфідні мостики водневі Типи хімічних зв'язків, які підтримують третинну структуру білка електростатичні
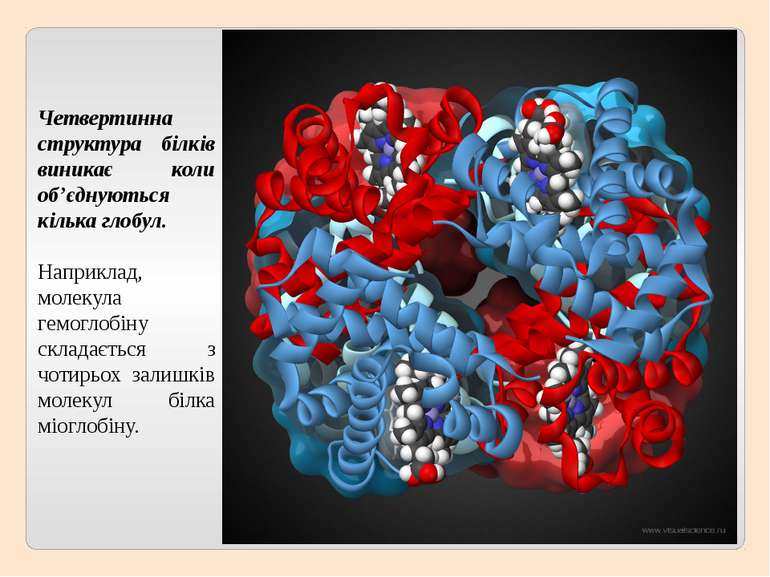
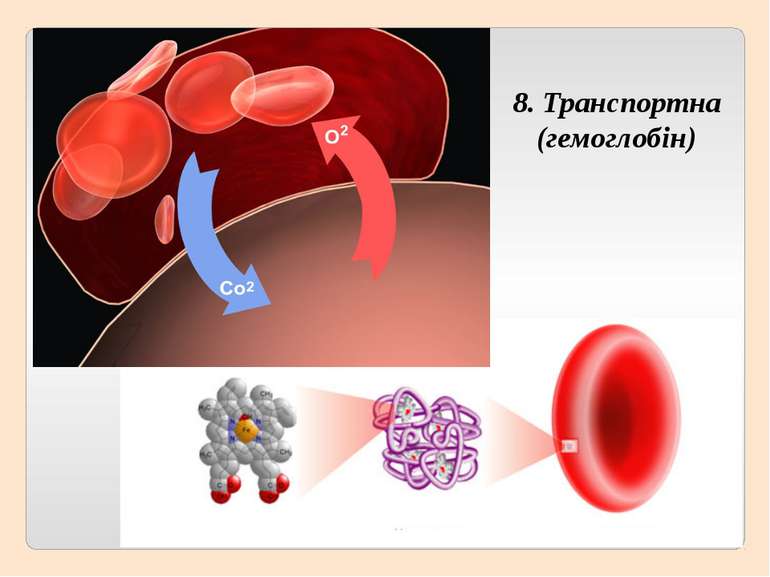
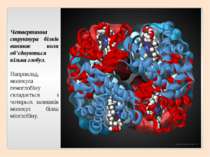
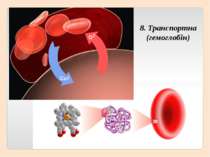
Четвертинна структура білків виникає коли об’єднуються кілька глобул. Наприклад, молекула гемоглобіну складається з чотирьох залишків молекул білка міоглобіну.
Класифікація білків І. За складом 1. Прості (протеїни) – це білки, до складу яких входять лише залишки амінокислот (наприклад, яєчний альбумін) .
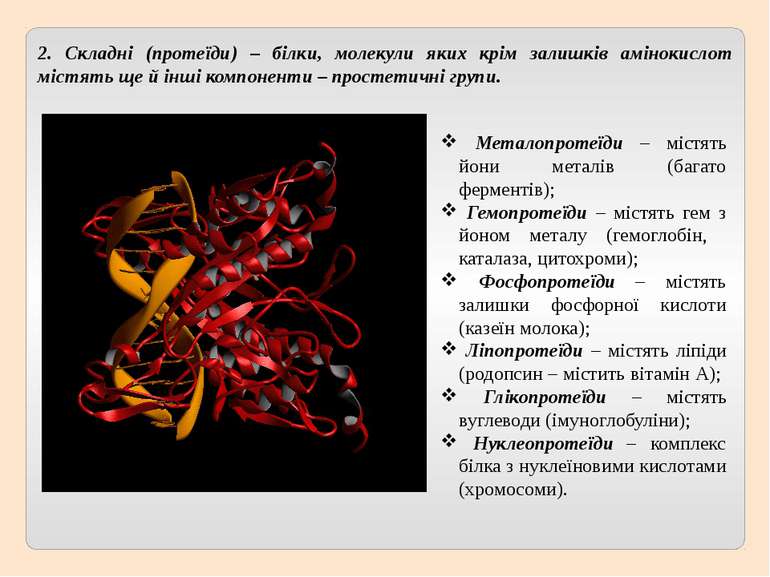
2. Складні (протеїди) – білки, молекули яких крім залишків амінокислот містять ще й інші компоненти – простетичні групи. Металопротеїди – містять йони металів (багато ферментів); Гемопротеїди – містять гем з йоном металу (гемоглобін, каталаза, цитохроми); Фосфопротеїди – містять залишки фосфорної кислоти (казеїн молока); Ліпопротеїди – містять ліпіди (родопсин – містить вітамін А); Глікопротеїди – містять вуглеводи (імуноглобуліни); Нуклеопротеїди – комплекс білка з нуклеїновими кислотами (хромосоми).
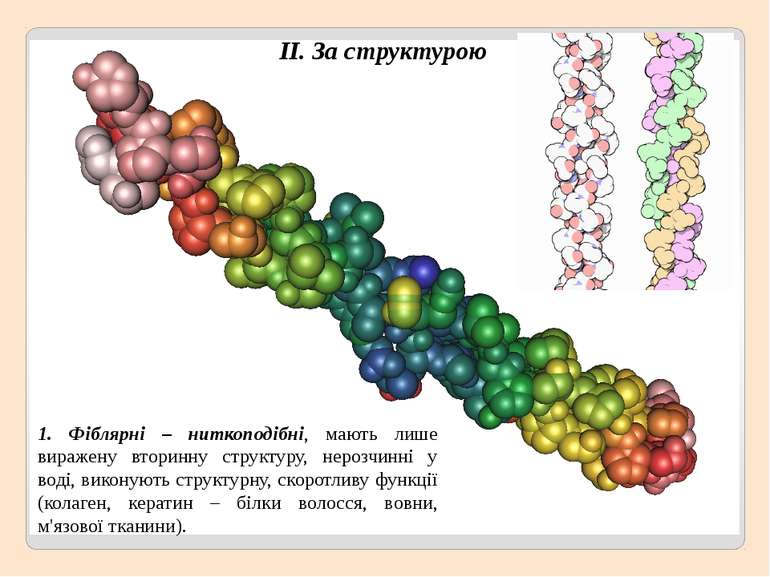
1. Фіблярні – ниткоподібні, мають лише виражену вторинну структуру, нерозчинні у воді, виконують структурну, скоротливу функції (колаген, кератин – білки волосся, вовни, м'язової тканини). ІІ. За структурою
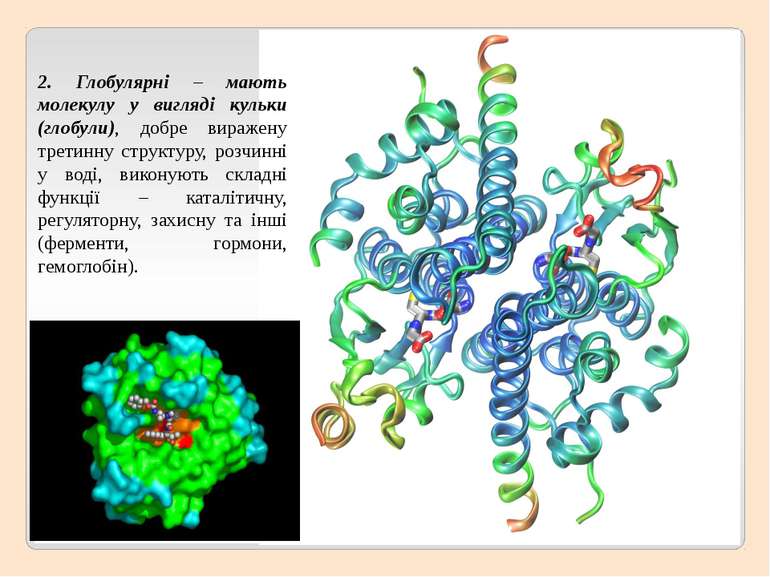
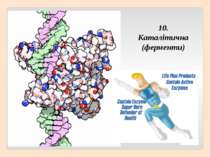
2. Глобулярні – мають молекулу у вигляді кульки (глобули), добре виражену третинну структуру, розчинні у воді, виконують складні функції – каталітичну, регуляторну, захисну та інші (ферменти, гормони, гемоглобін).
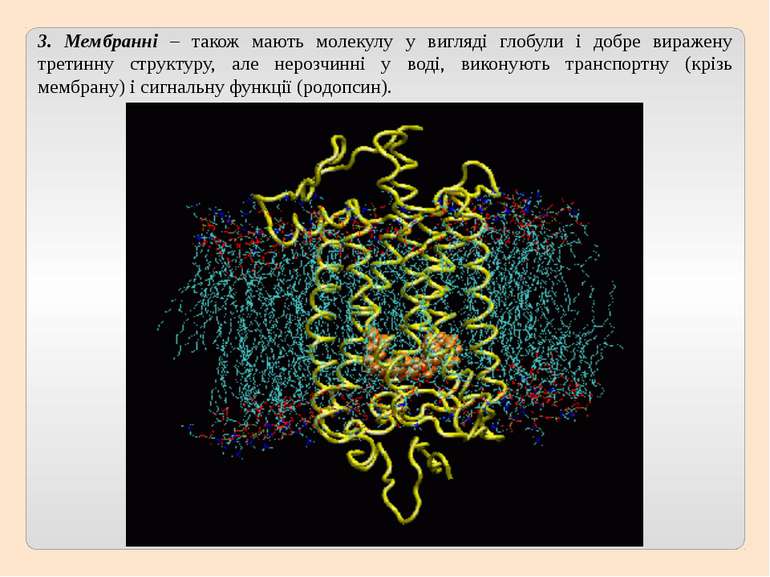
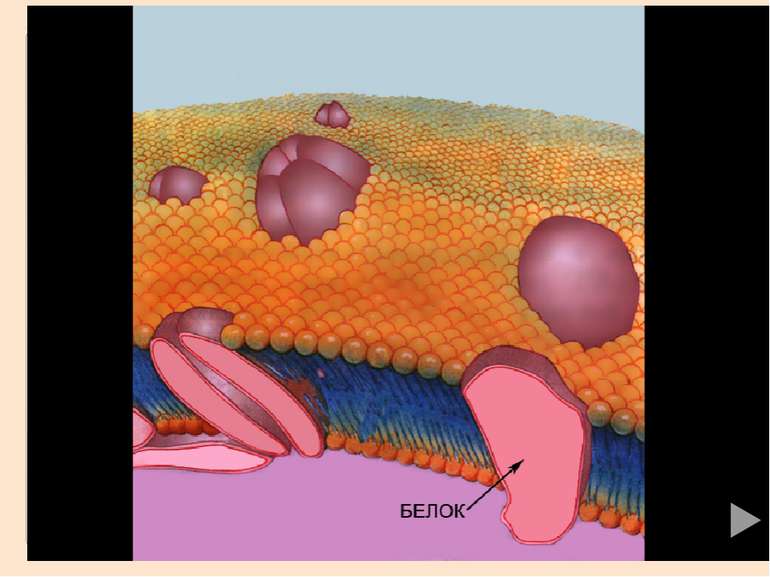
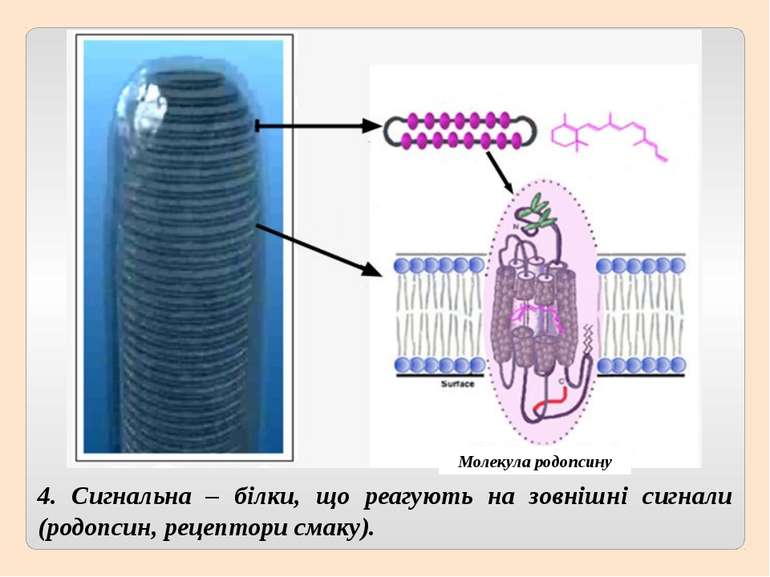
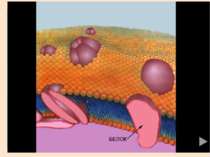
3. Мембранні – також мають молекулу у вигляді глобули і добре виражену третинну структуру, але нерозчинні у воді, виконують транспортну (крізь мембрану) і сигнальну функції (родопсин).
Молекули білків мають позитивні і негативні заряди. Тому білки, як і амінокислоти, мають амфотерні властивості. Фізичні та хімічні властивості білків різноманітні: є білки гідрофільні та гідрофобні; одні з них від незначної дії різноманітних чинників легко змінюють свою структуру, інші є стійкими до подібних чинників.
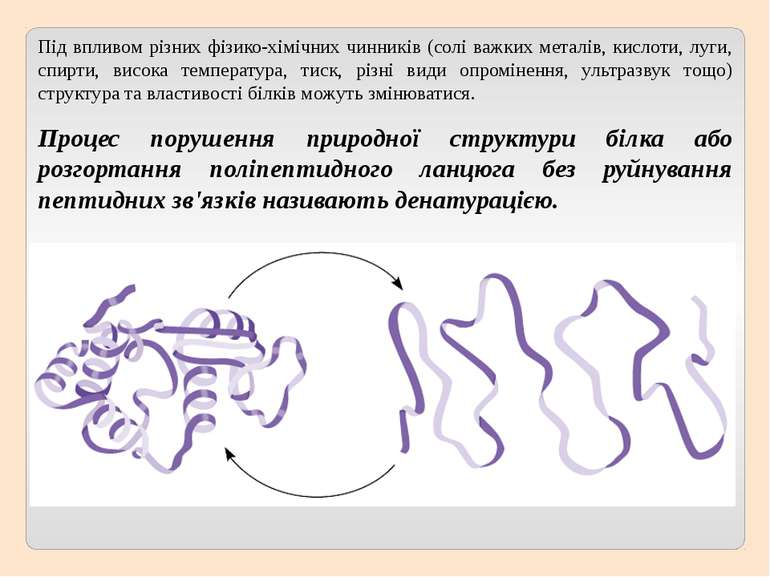
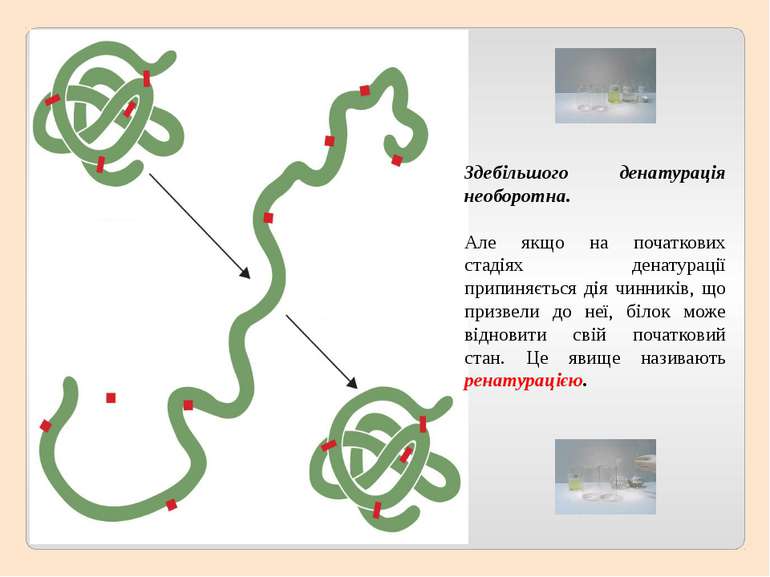
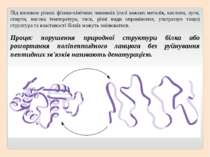
Під впливом різних фізико-хімічних чинників (солі важких металів, кислоти, луги, спирти, висока температура, тиск, різні види опромінення, ультразвук тощо) структура та властивості білків можуть змінюватися. Процес порушення природної структури білка або розгортання поліпептидного ланцюга без руйнування пептидних зв'язків називають денатурацією.
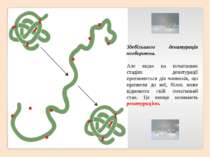
Здебільшого денатурація необоротна. Але якщо на початкових стадіях денатурації припиняється дія чинників, що призвели до неї, білок може відновити свій початковий стан. Це явище називають ренатурацією.
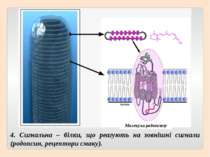
4. Сигнальна – білки, що реагують на зовнішні сигнали (родопсин, рецептори смаку). Молекула родопсину
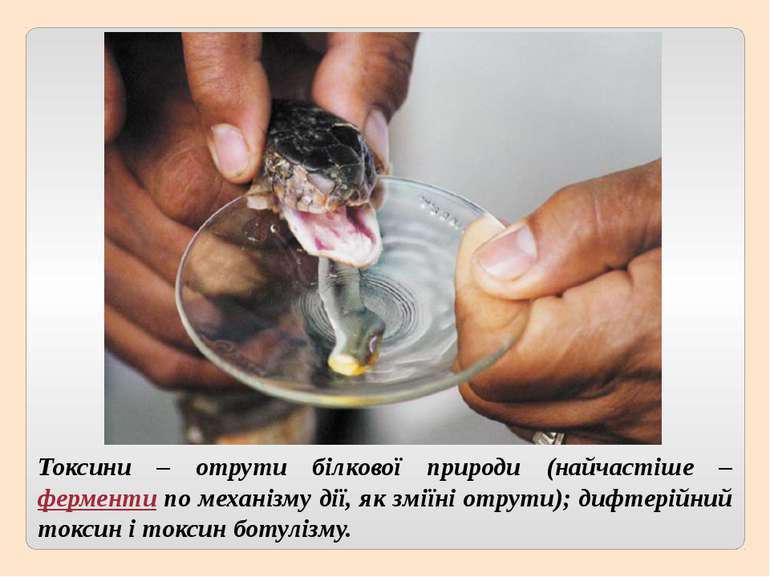
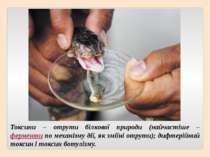
Токсини – отрути білкової природи (найчастіше – ферменти по механізму дії, як зміїні отрути); дифтерійний токсин і токсин ботулізму.
Бiлки – складова бiологiчних мембран. Бiлки беруть участь у процесi згортання кровi. Бiлки регулюють активнiсть обмiну речовин Складнi бiлки клiтинних мембран розпiзнають специфiчнi хiмiчнi сполуки. Деякi вiдкладаються прозапас.
6. Бiлки беруть участь у перенесеннi речовин. 7. Внаслiдок розщеплення бiлкiв у клiтинi видiляеться енергiя. 8. Деякi бiлkи можуть скорочуватися, забезпечуючи здатнiсть клiтини, тканини чи органiзму змiнювати форму. 9. Найважливiша функцiя бiлкiв – здатнiсть прискорювати хiмiчнi реакцii у клiтинi.
Домашне завдання Опрацювати параграф 9 пiдручника Завдання за вибором: а) як ви розумiете твердження «Усi ферменти - бiлки, але не всi бiлки - ферменти»? б) Чому при пiдвищеннi температури понад 40 градусiв Цельсiю бiльшiсть ферментiв перестае дiяти?
Схожі презентації
Категорії