Презентація на тему:
Білки
Завантажити презентацію
Білки
Завантажити презентаціюПрезентація по слайдам:
Історія дослідження В 1728р. Я.Бекарі виділив із пшеничного борошна клейковину і дослідив її властивості. Білки були виділені в окремий клас біологічних молекул в 18 столітті в результаті робіт французького хіміка Антуана де Фуркруа та інших учених, в яких було відмічено властивість білків коагулювати при нагріванні або під дією кислот. У той час були досліджені такі білки, як альбумін з яєчних білків, фібрин з крові і глютен із зерна пшениці. Голландський хімік Герріт Мульдер провів аналіз складу білків і виявив, що практично всі білки мають однакову емпіричну формулу. Мульдер також визначив продукти руйнування білків — амінокислоти — і для однієї з них (лейцину) майже точно визначив молекулярну масу — 131 дальтон. Антуан Франсуа де Фуркруа, основоположник дослідження білків.
Білки були вперше описані шведським хіміком Єнсом Якобом Берцеліусом в 1838 році, який і дав їм назву протеїни, від грец. πρώτα — «першорядної важливості». Проте, їхня центральна роль в життєдіяльності всіх живих організмів була виявлена лише у 1926 році, коли Джеймс Самнер показав, що фермент уреаза також є білком.
Перші тривимірні структури білків гемоглобіну і міоглобіну були отримані за допомогою рентгеноструктурного аналізу, за що автори методу, Макс Перуц і Джон Кендрю, отримали Нобелівську премію з хімії 1962 року
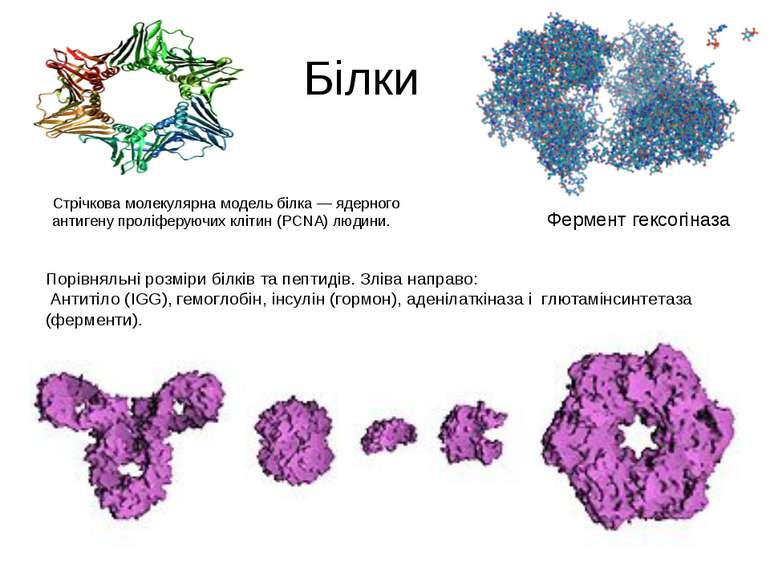
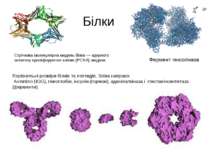
Білки Порівняльні розміри білків та пептидів. Зліва направо: Антитіло (IGG), гемоглобін, інсулін (гормон), аденілаткіназа і глютамінсинтетаза (ферменти). Фермент гексогіназа Стрічкова молекулярна модель білка — ядерного антигену проліферуючих клітин (PCNA) людини.
Що таке білки? Білки – це високомолекулярні біополімери , мономерами яких є залишки амінокислоти.
Різноманітність білкових молекул забезпечується різними комбінаціями 20 основних (золотих) амінокислот.
Розмір білка може вимірюватися за числом амінокислот або в одиницях молекулярної маси — дальтонах — Да (частіше, з-за великих розмірів молекули, в похідних одиницях — кілодальтонах — кДа). Найбільшим відомим одиничним білком є тітін (компонент саркомер м'язів), що містить понад 29 тис. амінокислот і має молекулярну масу 3 МДа, а найбільший внутрішньоклітинний білковий комплекс — комплекс ядерної пори хребетних тварин — має масу біля 125 МДа.
Найменший білок також важко визначити, багато білків. що мають ензиматичну активність, не перевищують за розміром кілька десятків амінокислот, багато пептидних гормонів мають ще мінші розміри. Інколи найменшим білком вважать єдину невелику амінокислоту пролін, що має самостійну каталітичну активність.
Хімічний склад білків Елементарний склад: Амінокислоти Грен, 1809 р. Браконно, 1820 р C – 55 -60% глікокол(гідроліз желатину) 19-24% N – 15- 18% H – 6-8% S – 0.4-2% Деякі метали Гемоглобін – C3032H4816O872N780S8Fe4. Mr білка яйця = 36 000, Mr білка мязів = 1 500 000
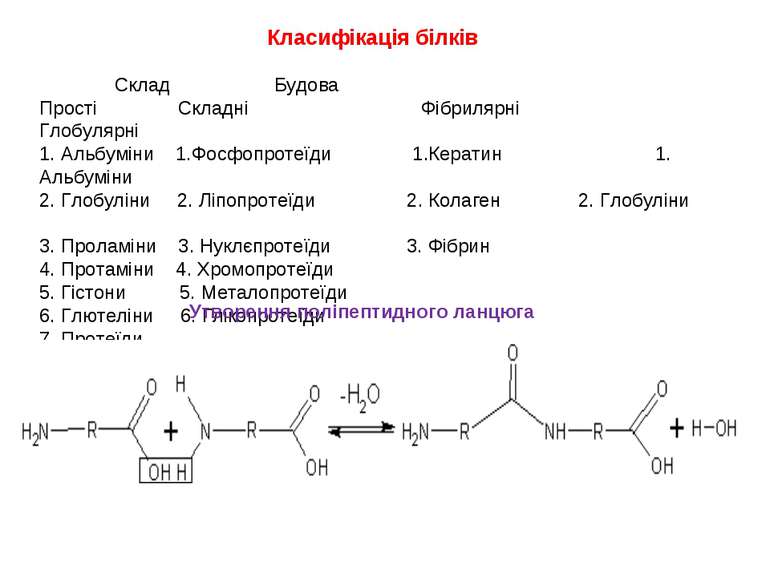
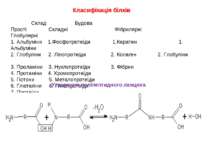
Класифікація білків Склад Будова Прості Складні Фібрилярні Глобулярні 1. Альбуміни 1.Фосфопротеїди 1.Кератин 1. Альбуміни 2. Глобуліни 2. Ліпопротеїди 2. Колаген 2. Глобуліни 3. Проламіни 3. Нуклєпротеїди 3. Фібрин 4. Протаміни 4. Хромопротеїди 5. Гістони 5. Металопротеїди 6. Глютеліни 6. Глікопротеїди 7. Протеїди Утворення поліпептидного ланцюга
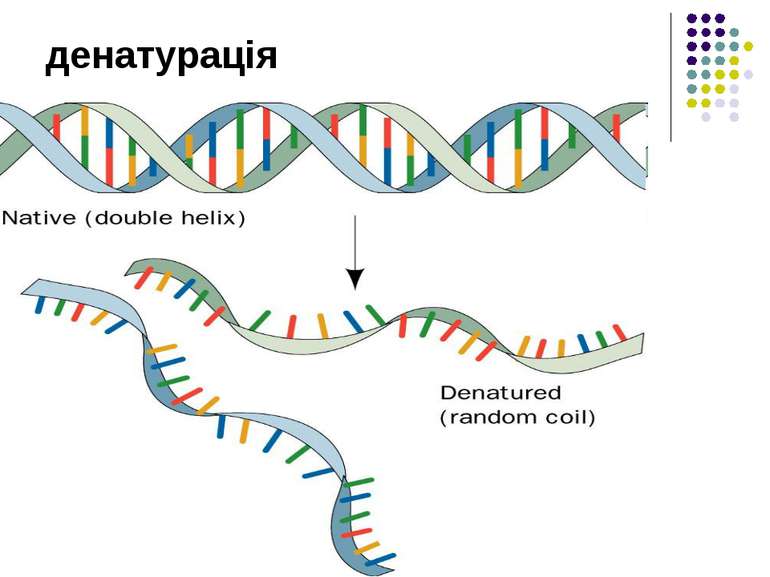
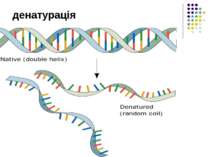
Хімічні властивості білків 1. Гідроліз (кислотно-основний, ферментативний), в результаті якого утворються амінокислоти. 2. Денатурація – порушення природної структури білка під дією нагрівання або хімічних реагентів. Денатурований білок втрачає свої біологічні властивості.
Кольорові реакції на білки 1. Ксантопротеїнова – взаємодія з концентрованою азотною кислотою, яка супроводжується появою жовтого забарвлення. 2. Біуретова – взаємодія слаболужних розчинів білків с розчином сульфату міді (II), в результаті якої зявляється фиолетово-синє забарвлення.
Функція Приклад пар 23 ст 131 Структурна Захисна Сигнальна, рецепторна Рухова Регуляторна запасаюча Енергетична транспортна каталітична
Функція Приклад пар 23 ст 131 Структурна Білки мембрани, мікротрубочки, мікрониточки . Еластин зв’язок, кератин волосся, колаген сухожилля, осеїн кісток. Захисна Антитіла, фібрин, тромбопластин, тромбін, інтерферон, антифризи, кріопротектори, муцин, отрута, лізоцим Сигнальна, рецепторна Зовнішні білки мембрани, опсин, родопсин, йодопсин, фітохром (хлорофіл), ацетилхолін. Рухова Актин міозин у м'язах, тубулін джгутиків і війок Регуляторна Гормони - інсулін, трийодтиронін, кальцитонін, глюкагон, адреналін, тироксин, паратгормон. Норадреналін, соматотропін, запасаюча Клітковина злакових, білки бобових, альбумін яйця птахів, ендосперм, казеїн молока Енергетична транспортна 17,6 кДж енергії – розпад 1г білка Гемоглобін, гемоціанін, гемеритрин каталітична Пепсин, хемотрипсин, амілаза, мальтаза, ліпаза
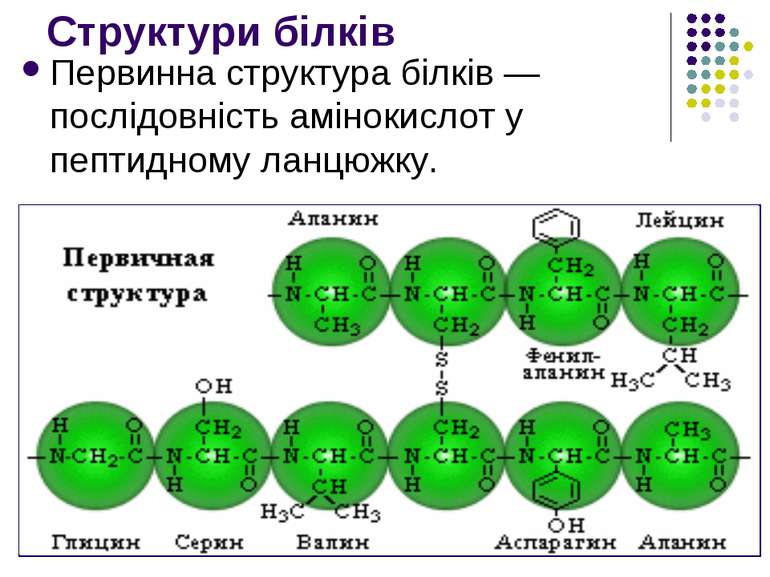
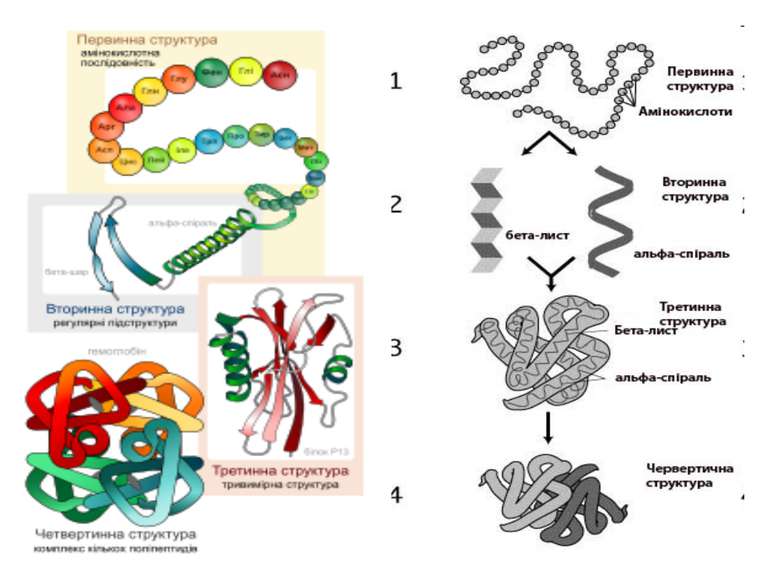
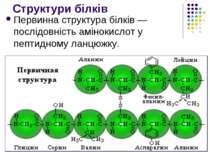
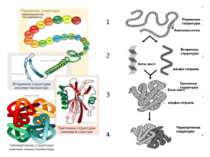
Структури білків Первинна структура білків — послідовність амінокислот у пептидному ланцюжку.
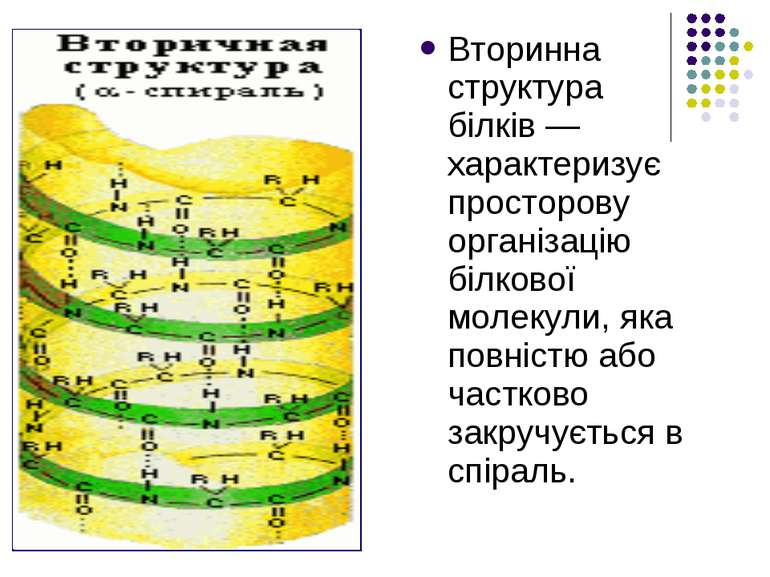
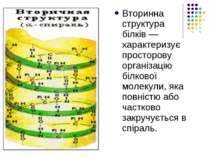
Вторинна структура білків — характеризує просторову організацію білкової молекули, яка повністю або частково закручується в спіраль.
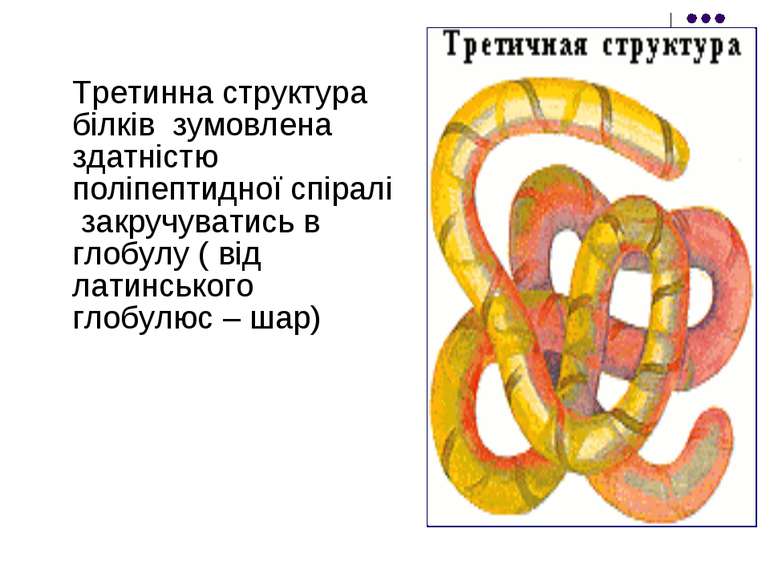
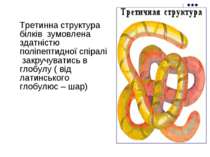
Третинна структура білків зумовлена здатністю поліпептидної спіралі закручуватись в глобулу ( від латинського глобулюс – шар)
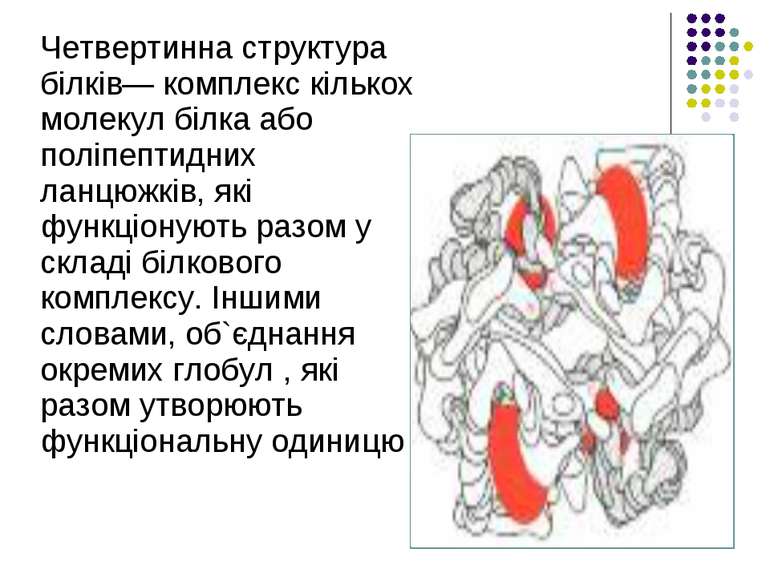
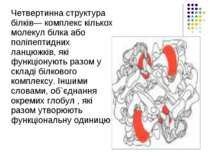
Четвертинна структура білків— комплекс кількох молекул білка або поліпептидних ланцюжків, які функціонують разом у складі білкового комплексу. Іншими словами, об`єднання окремих глобул , які разом утворюють функціональну одиницю
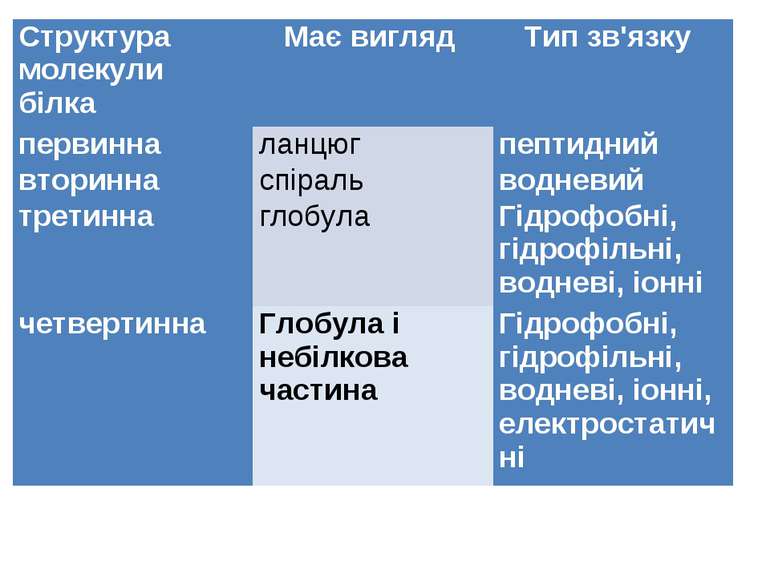
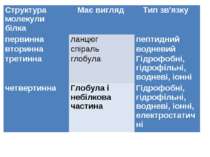
Структура молекули білка Має вигляд Тип зв'язку первинна ланцюг пептидний вторинна спіраль водневий третинна глобула Гідрофобні, гідрофільні, водневі, іонні четвертинна Глобула і небілкова частина Гідрофобні, гідрофільні, водневі, іонні, електростатичні
Властивості білків Денатурація — зміна високорівневої структури молекул. Ренатурація — відновлення структури білка на початковій стадії руйнування. Ренатурація для людини є корисна, оскільки це запобігає знищенню білка ворганізмі. Деструкція - процес порушення первинної структури білків.
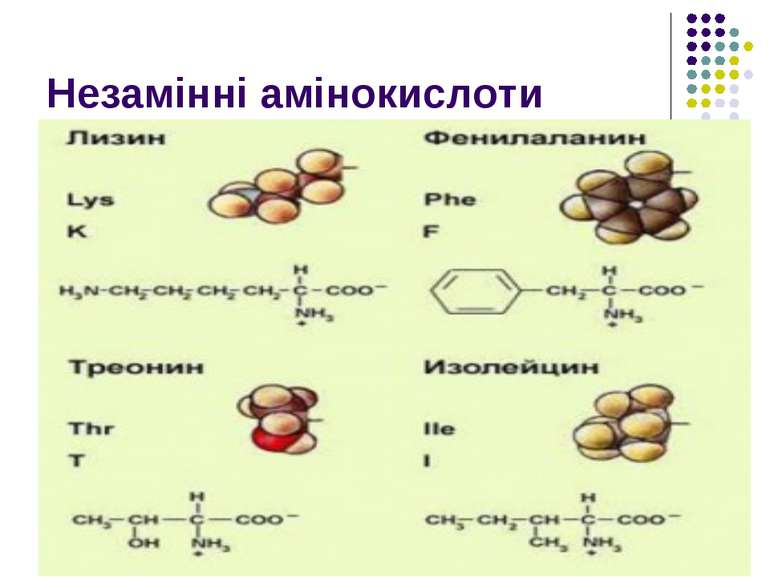
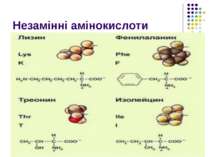
Назви основних амінокислот: Аланін. 11. Лейцин. Аргінін. 12. Лізин Аспарагін. 13. Метіонін Аспарагінова кислота. 14. Пролін Валін. 15. Серин. Гістидин. 16. Тирозин Гліцин. 17. Треонін Глутамін. 18. Триптофан Глутамінова кислота. 19. Фенілаланін. Ізолейцин. 20. Цистеїн. Визначити кислі, основні, нейтральні, полярні, неполярні, позитивно- та негативно заряджені, замінні, незамінні, . Пар 21, форзац підручника
Самостійна робота Білки Протеїни Структурна Енергетична Замінні Неповноцінні Пептидний Третинна Вторинна Амінокислоти Протеїди Каталітична Запасаюча Незамінні Повноцінні Водневий Первинна четвертинна
Домашнє завдання: Вивчити пар.21-23, повторити пар.20, повідомлення з теми «Ферменти і біологічний каталіз», творчі роботи по різноманітності та функціям білкі на прикладі 1 білка.
Схожі презентації
Категорії