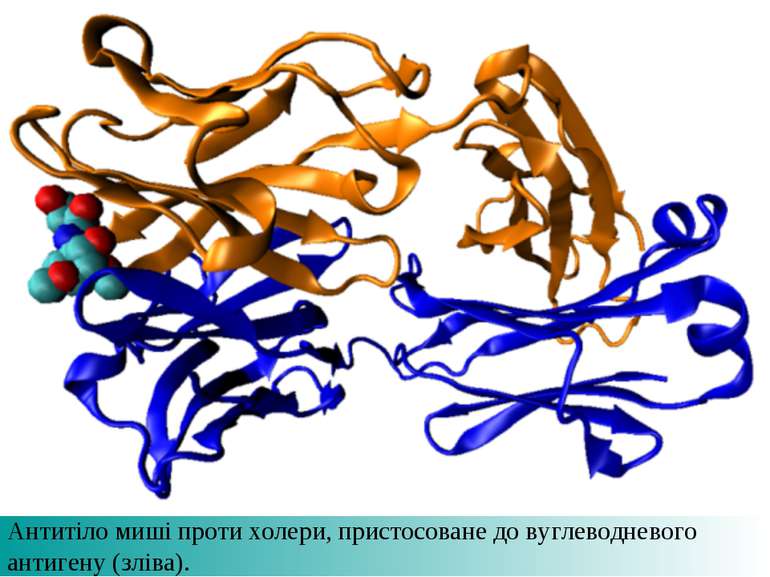
Презентація на тему:
Білки та їх роль в забезпеченні біологічної специфічності організмів
Завантажити презентацію
Білки та їх роль в забезпеченні біологічної специфічності організмів
Завантажити презентаціюПрезентація по слайдам:
Тема: Білки та їх роль в забезпеченні біологічної специфічності Лектор: асистент кафедри медичної біології, Тусик Оксана Тимофіївна
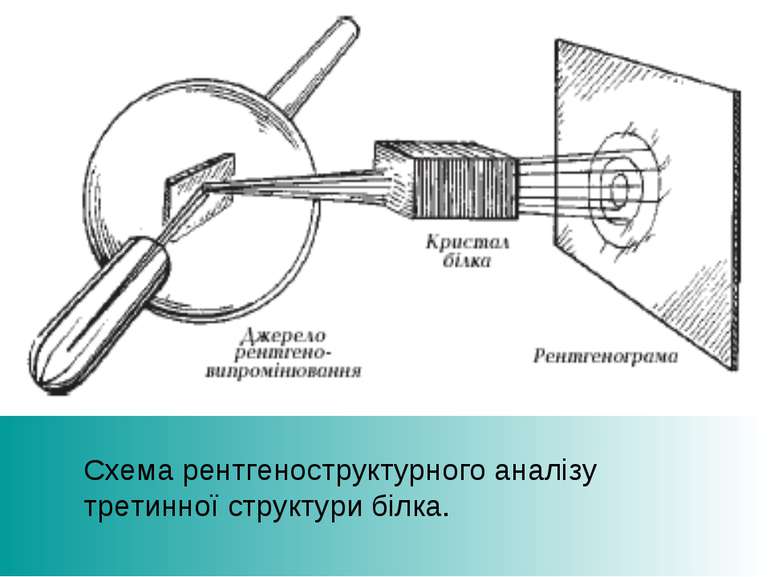
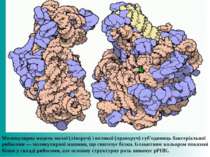
Білки були вперше описані шведським хіміком Єнсом Якобом Берцеліусом в 1838 році, який і дав їм назву протеїни, від грец.πρώτα — «першорядної важливості». Проте, їх центральна роль в життєдіяльності всіх живих організмів була виявлена лише у 1926 році, коли Джеймс Самнер показав, що фермент уреаза також є білком. Секвенування першого білка — інсуліну, тобто визначення його амінокислотної послідовності, принесло Фредерику Сенгеру Нобелівську премію з хімії 1958 року. Перші тривимірні структури білків гемоглобіну і міоглобіну були отримані за допомогою рентгеноструктурного аналізу, за що автори методу, Макс Перуц і Джон Кендрю, отримали Нобелівську премію з хімії 1962 року. Стрічкова молекулярна модель ферменту уреази бактерії H. pylori.
Білки були виділені в окремий клас біологічних молекул в ХVIII ст. в результаті робіт французького хіміка Антуана Фуркруа та інших учених, в яких було відмічено властивість білків коагулювати при нагріванні або під дією кислот. У той час були досліджені такі білки, як альбумін з яєчних білків, фібрин з крові і глютен із зерна пшениці. Голландський хімік Герріт Мульдер провів аналіз складу білків і виявив, що практично всі білки мають однакову емпіричну формулу. Він також визначив продукти руйнування білків — амінокислоти. Антуан Франсуа де Фуркруа, основоположник дослідження білків.
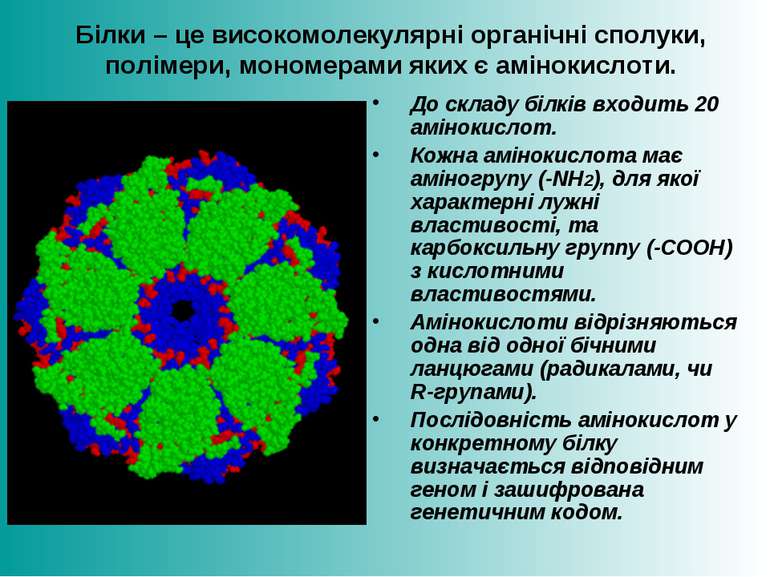
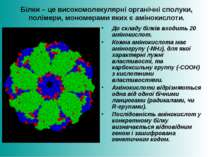
Білки – це високомолекулярні органічні сполуки, полімери, мономерами яких є амінокислоти. До складу білків входить 20 амінокислот. Кожна амінокислота має аміногрупу (-NH2), для якої характерні лужні властивості, та карбоксильну группу (-СООН) з кислотними властивостями. Амінокислоти відрізняються одна від одної бічними ланцюгами (радикалами, чи R-групами). Послідовність амінокислот у конкретному білку визначається відповідним геном і зашифрована генетичним кодом.
Класифікація амінокислот Основні амінокислоти – 20 амінокислот, залишки яких входять до складу білків; Замінні амінокислоти – можуть синтезуватися в організмі людини і тварин з продуктів обміну речовин: аланін, аргінін, аспарагін, аспарагінова кислота, гістидин, гліцин, глутамін, глутамінова кислота, ізолейцин, серин, тирозин, цистеїн; Незамінні амінокислоти – в організмі людини і тварин не синтезуються: валін, ізолейцин, лейцин, лізин, пролін, треонін, триптофан, фенілаланін. Білки, які містять усі незамінні амінокислоти, називаються повноцінними, на відміну від неповноцінних, до складу яких не входять ті чи інші незамінні амінокислоти. Гомологічні білки (що виконують одну функцію і мають загальне еволюційне походження, наприклад, гемоглобіни) різних організмів мають в багатьох місцях ланцюжка різні амінокислотні залишки, які називають варіабельними, напротивагу консервативним, спільним залишкам. За ступенем гомології можна оцінити еволюційну відстань між таксонами, до яких належать організми.
В процесі трансляції на рибосомах синтезуються поліпептидні ланцюги. Амінокислоти у них сполучені пептидними зв’язками, що виникають між аміногрупою однієї амінокислоти та карбоксильною групою іншої (при відщепленні води). Поліпептиди з високою молекулярною масою (понад 6000) називають білками. Вони можуть містити до кількох тисяч амінокислотних залишків. Схематичне зображення утворення пептидного зв'язку.
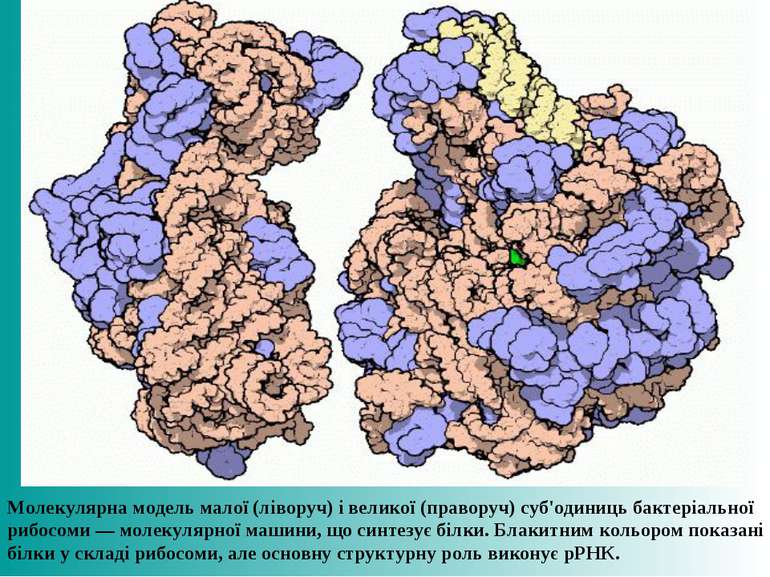
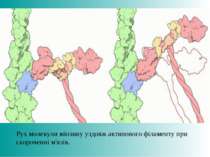
Молекулярна модель малої (ліворуч) і великої (праворуч) суб'одиниць бактеріальної рибосоми — молекулярної машини, що синтезує білки. Блакитним кольором показані білки у складі рибосоми, але основну структурну роль виконує рРНК.
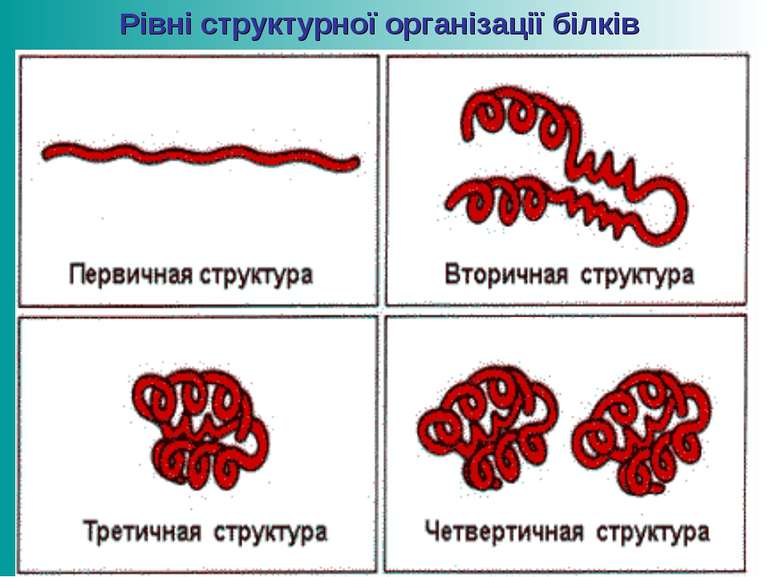
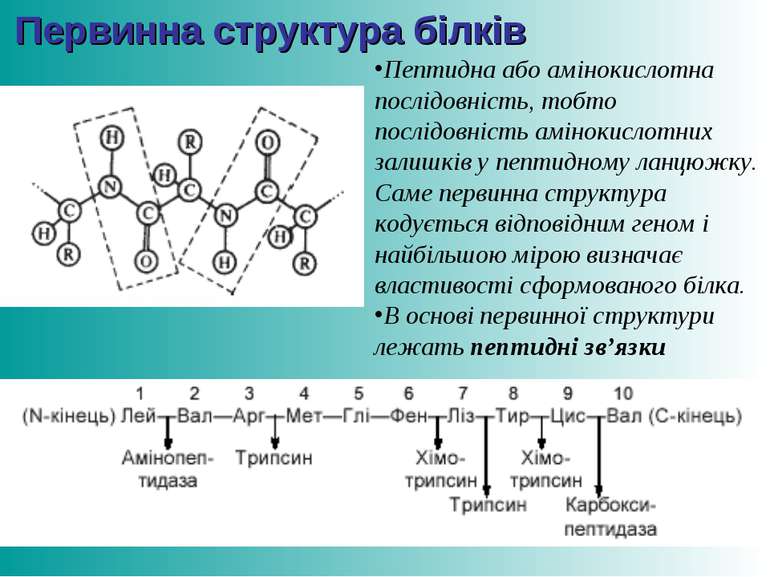
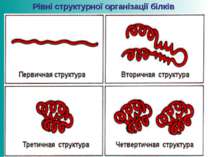
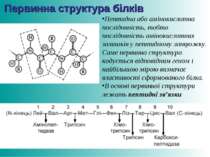
Первинна структура білків Пептидна або амінокислотна послідовність, тобто послідовність амінокислотних залишків у пептидному ланцюжку. Саме первинна структура кодується відповідним геном і найбільшою мірою визначає властивості сформованого білка. В основі первинної структури лежать пептидні зв’язки
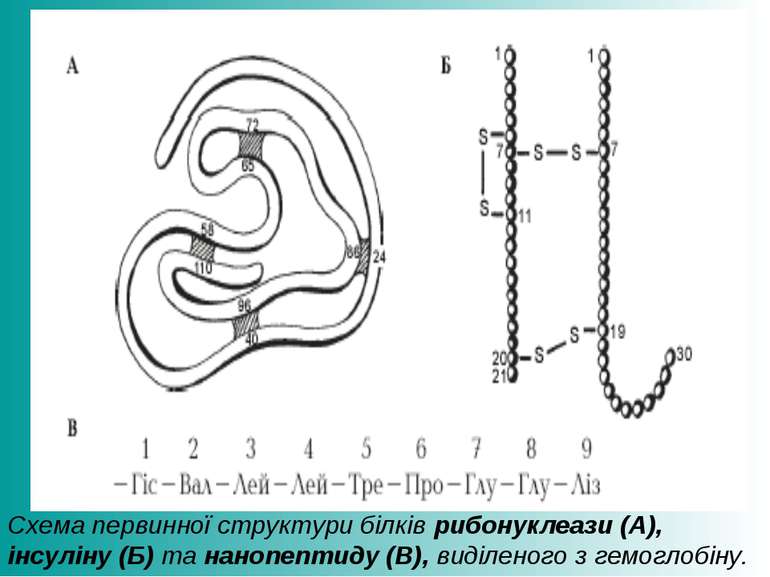
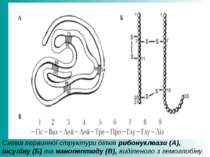
Схема первинної структури білків рибонуклеази (А), інсуліну (Б) та нанопептиду (В), виділеного з гемоглобіну.
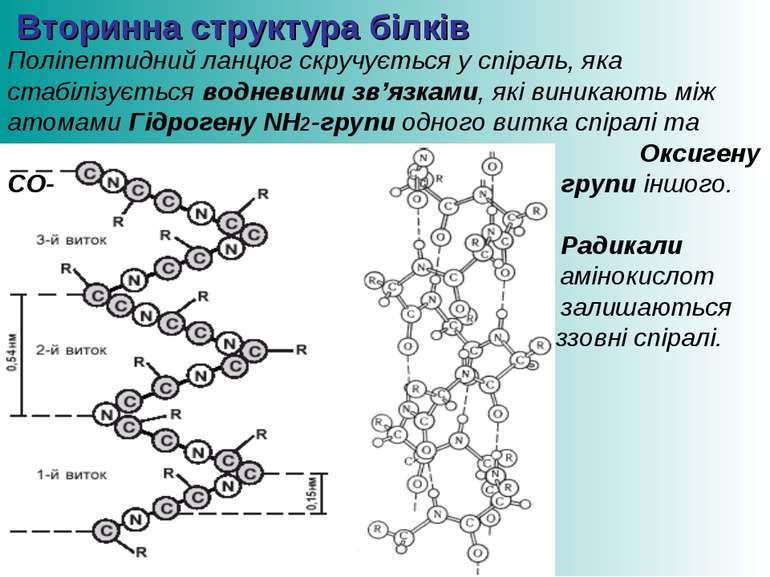
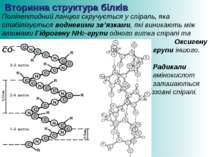
Вторинна структура білків Поліпептидний ланцюг скручується у спіраль, яка стабілізується водневими зв’язками, які виникають між атомами Гідрогену NH2-групи одного витка спіралі та Оксигену СО- групи іншого. Радикали амінокислот залишаються ззовні спіралі.
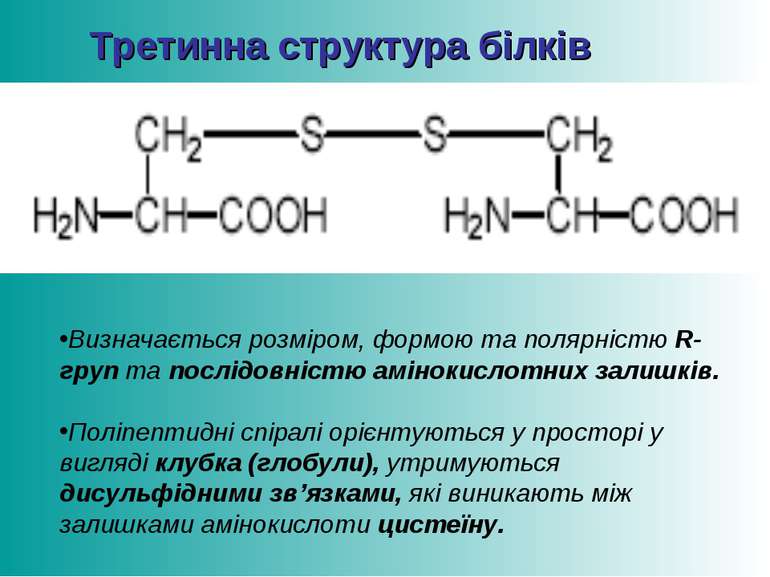
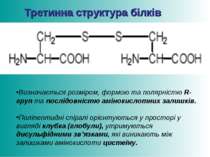
Третинна структура білків Визначається розміром, формою та полярністю R-груп та послідовністю амінокислотних залишків. Поліпептидні спіралі орієнтуються у просторі у вигляді клубка (глобули), утримуються дисульфідними зв’язками, які виникають між залишками амінокислоти цистеїну.
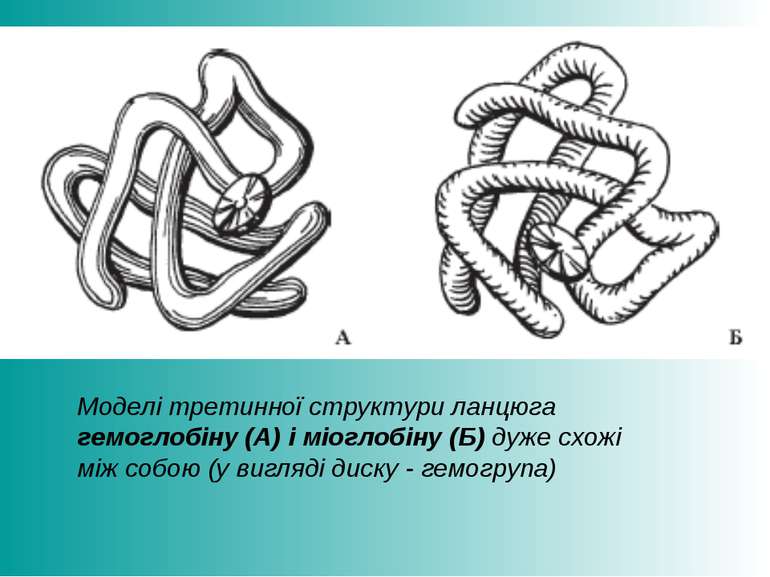
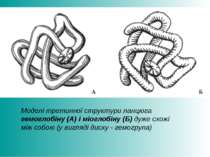
Моделі третинної структури ланцюга гемоглобіну (А) і міоглобіну (Б) дуже схожі між собою (у вигляді диску - гемогрупа)
Четвертинна структура білків Виникає внаслідок об’єднання окремих глобул, які в сукупності становлять функціональну одиницю. Стабілізація визначається гідрофобними, електростатичним взаємодіями, водневими зв’язками.
Колоїдно-осмотичні властивості білків Мала швидкість дифузії Нездатність проходити через напівпроникні мембрани Висока в'язкість розчинів та схильність до утворення гелів Здатність розсіювати промені видимого світла
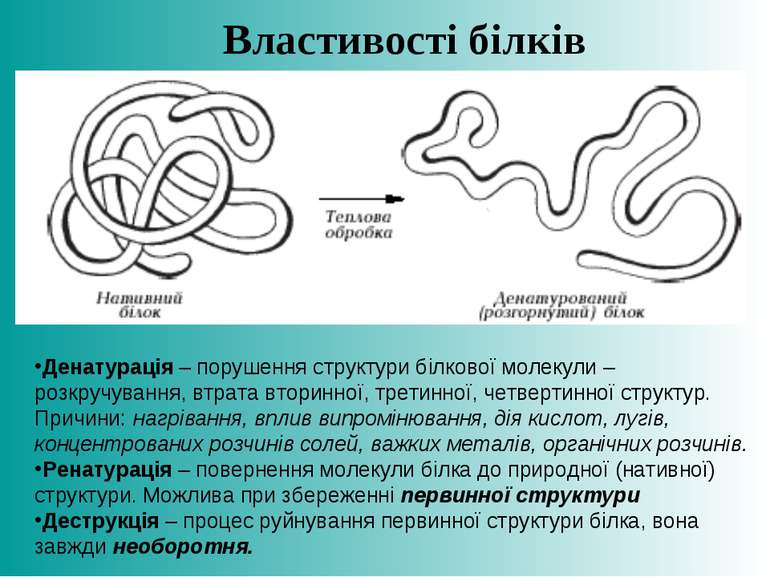
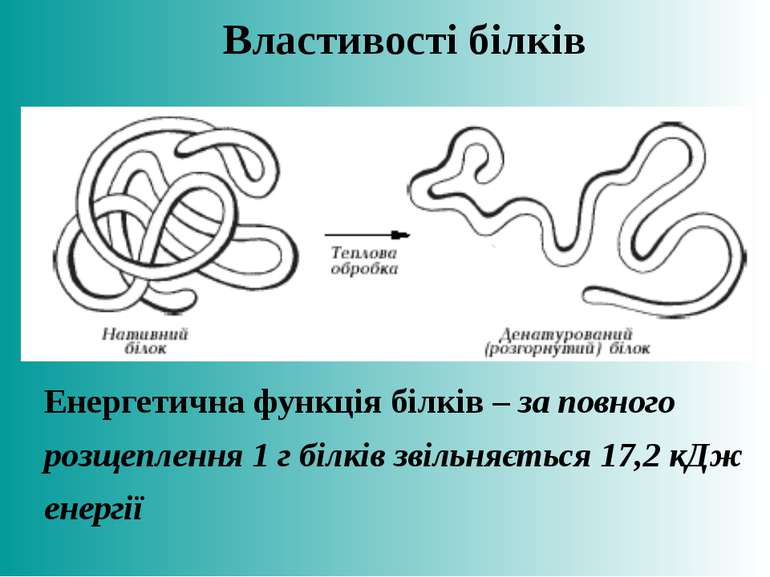
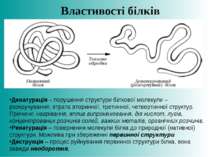
Денатурація – порушення структури білкової молекули – розкручування, втрата вторинної, третинної, четвертинної структур. Причини: нагрівання, вплив випромінювання, дія кислот, лугів, концентрованих розчинів солей, важких металів, органічних розчинів. Ренатурація – повернення молекули білка до природної (нативної) структури. Можлива при збереженні первинної структури Деструкція – процес руйнування первинної структури білка, вона завжди необоротня. Властивості білків
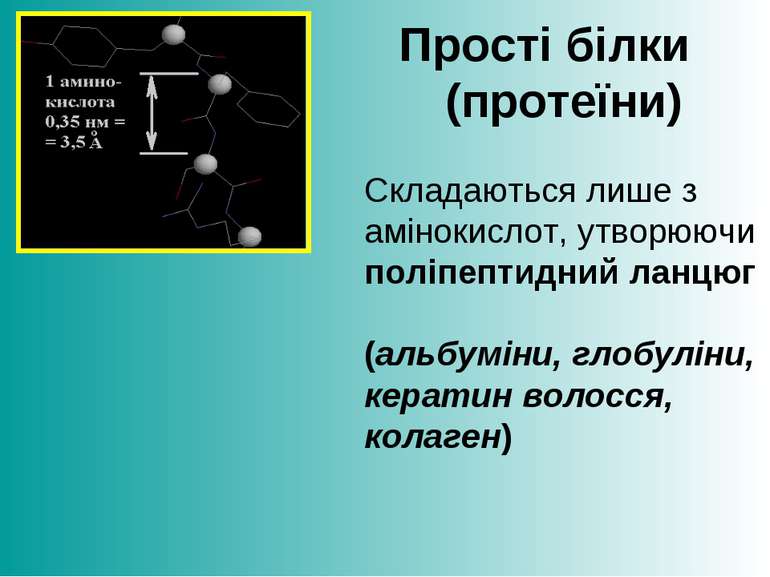
Прості білки (протеїни) Складаються лише з амінокислот, утворюючи поліпептидний ланцюг (альбуміни, глобуліни, кератин волосся, колаген)
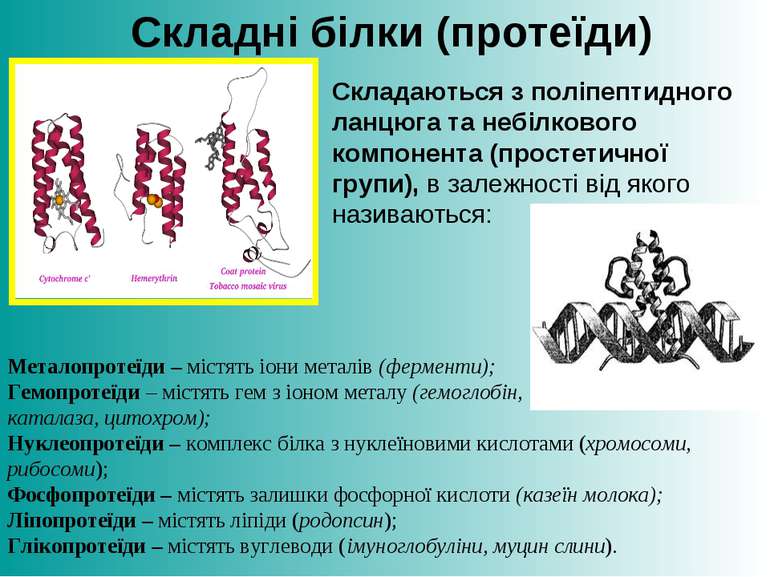
Складаються з поліпептидного ланцюга та небілкового компонента (простетичної групи), в залежності від якого називаються: Складні білки (протеїди) Металопротеїди – містять іони металів (ферменти); Гемопротеїди – містять гем з іоном металу (гемоглобін, каталаза, цитохром); Нуклеопротеїди – комплекс білка з нуклеїновими кислотами (хромосоми, рибосоми); Фосфопротеїди – містять залишки фосфорної кислоти (казеїн молока); Ліпопротеїди – містять ліпіди (родопсин); Глікопротеїди – містять вуглеводи (імуноглобуліни, муцин слини).
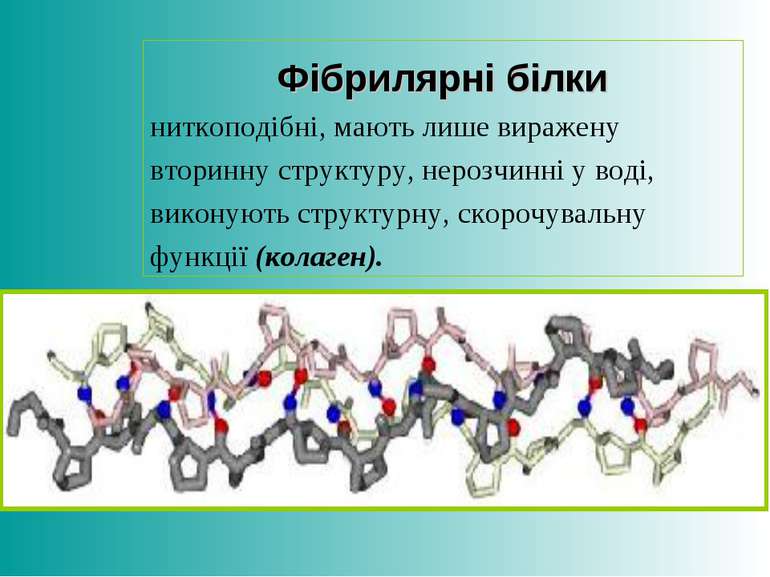
Фібрилярні білки ниткоподібні, мають лише виражену вторинну структуру, нерозчинні у воді, виконують структурну, скорочувальну функції (колаген).
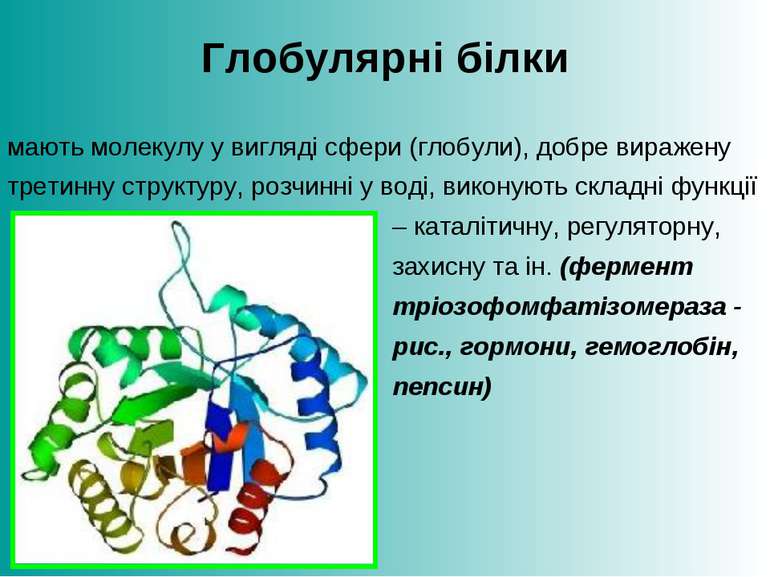
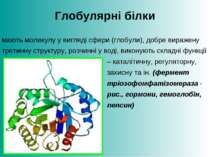
Глобулярні білки мають молекулу у вигляді сфери (глобули), добре виражену третинну структуру, розчинні у воді, виконують складні функції – каталітичну, регуляторну, захисну та ін. (фермент тріозофомфатізомераза - рис., гормони, гемоглобін, пепсин)
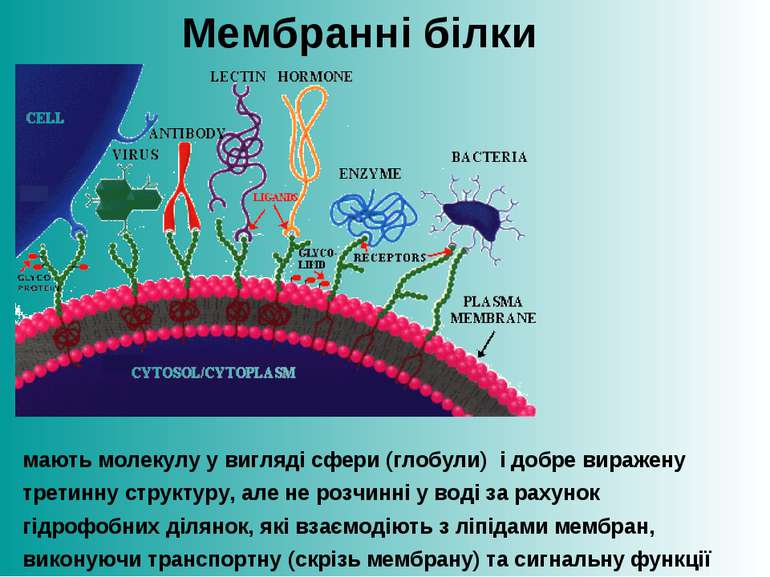
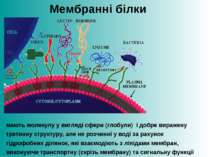
Мембранні білки мають молекулу у вигляді сфери (глобули) і добре виражену третинну структуру, але не розчинні у воді за рахунок гідрофобних ділянок, які взаємодіють з ліпідами мембран, виконуючи транспортну (скрізь мембрану) та сигнальну функції
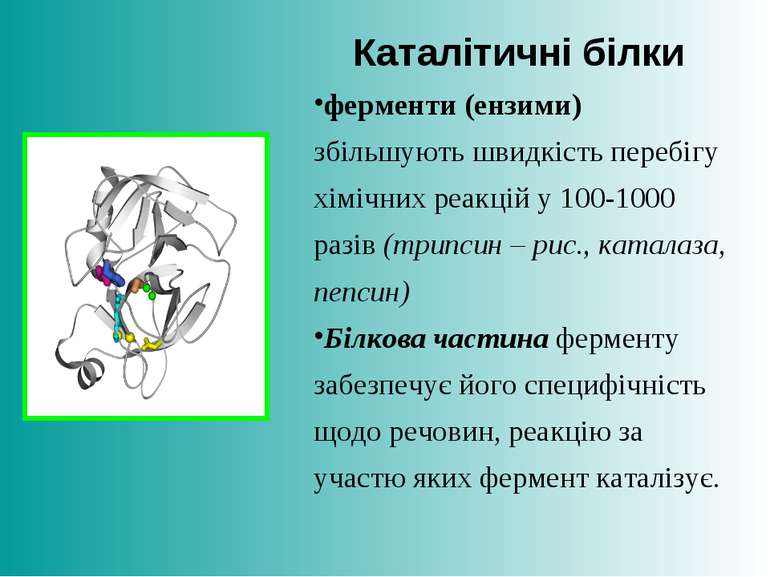
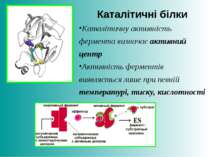
Каталітичні білки ферменти (ензими) збільшують швидкість перебігу хімічних реакцій у 100-1000 разів (трипсин – рис., каталаза, пепсин) Білкова частина ферменту забезпечує його специфічність щодо речовин, реакцію за участю яких фермент каталізує.
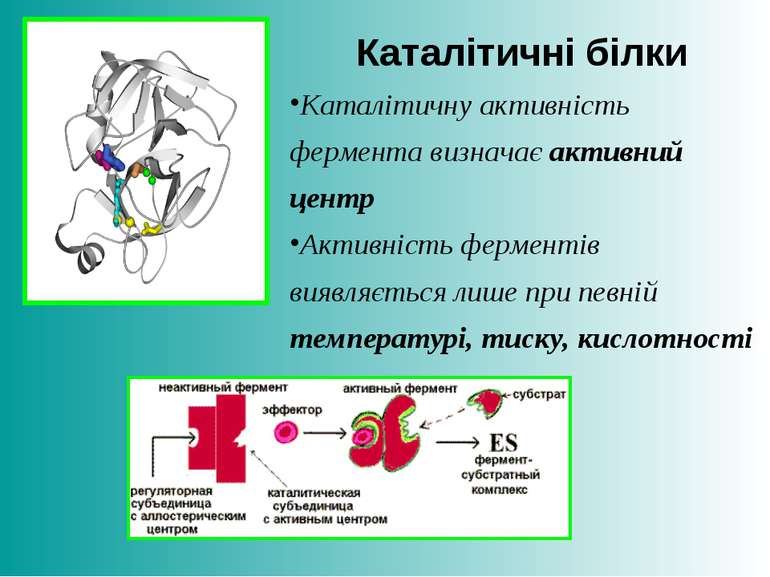
Каталітичні білки Каталітичну активність фермента визначає активний центр Активність ферментів виявляється лише при певній температурі, тиску, кислотності
КЛАСИФІКАЦІЯ ТА НОМЕНКЛАТУРА ФЕРМЕНТІВ За офіційною міжнародною класифікацією, ферменти, залежно від типу каталізованих реакцій поділяють на 6 класів: 1. Оксидоредуктази — ферменти, які каталізують окисно-відновні реакції. 2. Трансферази — ферменти, які каталізують міжмолекулярне перенесення різних хімічних груп. Гідролази, ферменти які каталізують реакції гідролітичного розщеплення внутрішньомолекулярних зв'язків. Ліази, які каталізують реакції негідролітичного розщеплення з утворенням подвійних зв'язків, і навпаки — приєднання груп у місцях подвійних зв'язків. 5. Ізомерази, які каталізують реакції ізомеризації. 6. Лігази (синтетази) — ферменти, які каталізують з'єднання двох молекул із використанням енергії фосфатного зв'язку. Джерелом енергії для таких реакцій служить АТФ або інші нуклеозидтрифосфати.
КЛАСИФІКАЦІЯ БІЛКІВ ЗА ФУНКЦІЯМИ Транспортні білки – переносять кисень, жирні кислоти, жири (гемоглобін, ліпопротеїди крові); Регуляторні білки – гормони білкової природи (адренокортикотропний гормон, інсулін); Токсичні білки – отрути білкової природи, найчастіше ферменти, за механізмом дії такі як зміїні отрути (дифтерійні токсини); Сигнальні білки – білки, що реагують на зовнішні сигнали (родопсин, рецептори смаку, нюху)
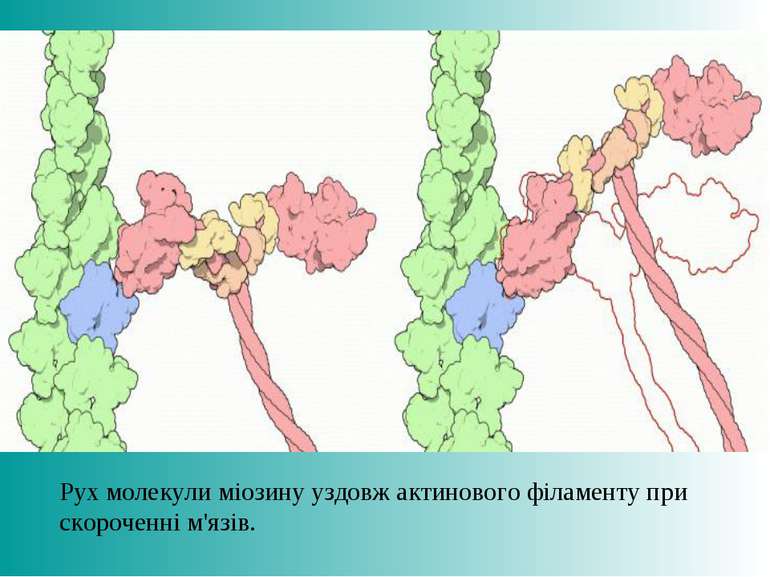
КЛАСИФІКАЦІЯ БІЛКІВ ЗА ФУНКЦІЯМИ Запасаючі білки – (альбумін яйця - овальбумін, казеїн молока); Будівельні білки – білки сполучної тканини (колаген), рогових утворень – волосся, нігтів (кератин); Скорочувальні білки – білки м’язової тканини (актин, міозин); Захисні білки – імуноглобуліни, фібриноген, тромбопластин, тромбін (зсідання крові)
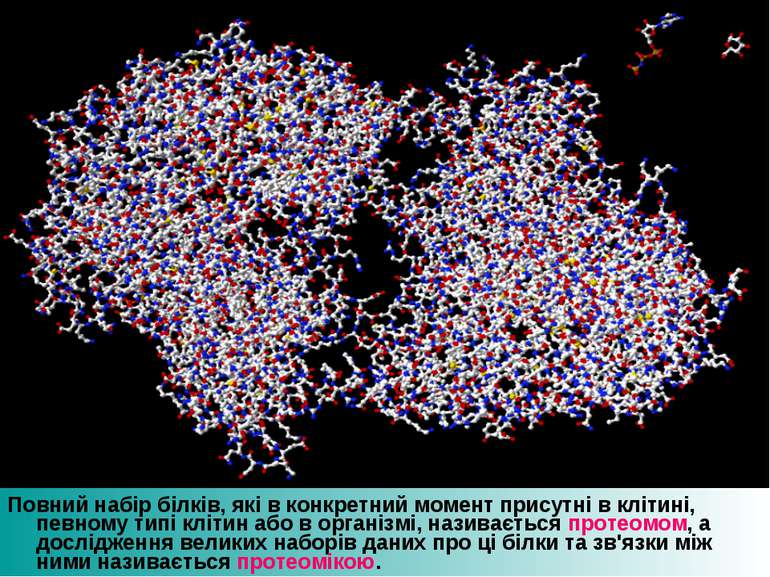
Повний набір білків, які в конкретний момент присутні в клітині, певному типі клітин або в організмі, називається протеомом, а дослідження великих наборів даних про ці білки та зв'язки між ними називається протеомікою.
Енергетична функція білків – за повного розщеплення 1 г білків звільняється 17,2 кДж енергії Властивості білків
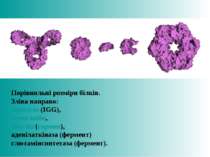
Порівняльні розміри білків. Зліва направо: антитіло (IGG), гемоглобін, інсулін (гормон), аденілаткіназа (фермент) глютамінсинтетаза (фермент).
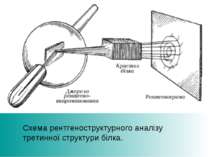
Визначення структури білків Переважна більшість відомих структур білків (біля 90 % в Банку даних білків) були визначені за допомогою рентгенівської кристалографії. Цей метод дозволяє визначення тривимірної структури електронної густини білка в кристалізованому стані, й таким чином вивести координати атомів у 3-х вимірах із певним рівнем роздільної здатності. Останнім часом також набирає популярності кріоелектронна мікроскопія, як дуже швидкий, хоча і низькоточний, метод визначення структур білків. Хоча цей метод і не здатний визначити розташування окремих амінокислот або деталі вторинної структури, він широко застосовується для дослідження великих білкових комплексів.
Кристали білків розмірами від 0,1 до 1 мм для кристалографії. Фотографія в поляризованому світлі.
Білки надходять в організм разом з їжею й служать основним джерелом амінокислот. Обов'язкове використання білків у їжі обумовлене потребою в незамінних амінокислотах, які не можуть синтезуватися людиною з інших речовин. Травлення починається з кислотної денатурації білків у шлунку. Денатуровані білки стають субстратом для протеаз, спочатку в шлунку, а потім у слаболужному середовищі тонкого кишечника. Продукти протеазного розщеплення — короткі пептиди й амінокислоти всмоктуються ентероцитами розташованими в епітелії тонкого кишечника. Увесь процес всмоктування білкових продуктів триває близько чотирьох годин. В ентероцитах частина пептидів розщеплюється до окремих амінокислот. Потім амінокислоти й пептиди розносяться по всьому тілу з потоком крові. Використання людиною
Регуляція транспорту й метаболізму амінокислот — складний, ще не досить вивчений процес. У ньому беруть участь різні системи організму, у тому числі НС, що відповідає за формування відчуття голоду й ситості в головному мозку. У медичній практиці виникають питання, пов'язані з персональною алергією до деяких білків. У більш складних випадках розробляються спеціальні білкові дієти. У деяких випадках використовують суміші чистих амінокислот. Вони викликають інтерес у спортсменів з метою нарощування м'язів. Суміш для нарощування м'язів (США) містить білки молочної сироватки.
Схожі презентації
Категорії