Презентація на тему:
Фізичні властивості кисню. Одержання кисню в лабораторії. Реакції розкладу. Поняття про каталізатори
Завантажити презентацію
Фізичні властивості кисню. Одержання кисню в лабораторії. Реакції розкладу. Поняття про каталізатори
Завантажити презентаціюПрезентація по слайдам:
Проста речовина кисень. Фізичні властивості кисню. Одержання кисню в лабораторії. Реакції розкладу. Поняття про каталізатори
Повторення вивченого 1)Як кисень утворюється в природі? 2)А чи можна одержати кисень у лабораторії? 3)А з яких речовин можна одержати кисень? 4)Як переконатися, що одержаний газ - це кисень?
Демонстрація 11. Одержання кисню з калій перманганату У пробірку насипаємо 0,5–1,0 г калій перманганату (близько 1/10 частини від об’єму пробірки), прикриваємо отвір пробірки жмутиком вати і закриваємо пробкою з газовідвідною трубкою. Закріплюємо пробірку в лапці штатива. 1)Як зібрати кисень, що виділятиметься з пробірки? 2)Кисень важчий чи легший за повітря? Mr (O2) = 32; Mr (повiтря) = 29.
Тож кисень витіснятиме повітря з пробірки, отже, газовідвідну трубку слід опустити на дно пробірки. Дотримуючись правил, нагріваємо пробірку, потім нагріваємо кристали калій перманганату. 1)Що спостерігаємо? 2)Чи можемо ми побачити, що кисень уже в колбі? 3)Згадаймо фізичні властивості кисню. 4)Як дізнатися, чи є в колбі кисень?
Демонстрація 14. Виявлення кисню Підносимо тліючу скіпку, вона яскраво загоряється. Висновок: кисень підтримує горіння, його можна одержати шляхом розкладу калій перманганату. Записуємо рівняння. 2KMnO4→K2MnO4+MnO2+O2 До якого типу належить ця реакція?
Демонстрація 12. Одержання кисню з гідроген пероксиду - Які ще речовини можна використовувати для одержання кисню? Використовуємо для нашого досліду гідроген пероксид H2O2. Наливаємо в пробірку 1,5-2,0 мл гідроген пероксиду, збираємо прилад, нагріваємо речовину.
Демонстрація 13. Збирання кисню Збирання кисню шляхом витиснення води можливо тому, що він не розчиняється у воді. Збираємо кисень у колбу через гідрозатвор. Вода не витісняється з колби, отже, кисень не виділяється. Поміщаємо в гідроген пероксид дрібку манган(IV) оксиду і знову нагріємо. У колбі-приймачі збирається кисень. Додавання манган(IV) оксиду прискорило реакцію розкладу гідроген пероксиду.
Речовини, що прискорюють хімічну реакцію, але не витрачаються в процесі реакції, називаються каталізаторами. MnO2 - каталізатор, він не витрачається в результаті реакції, а тільки прискорює її. Запишемо рівняння: Приклад каталізаторів - ферменти, що прискорюють процес травлення. Негативні каталізатори, що сповільнюють реакцію, називаються інгібіторами.
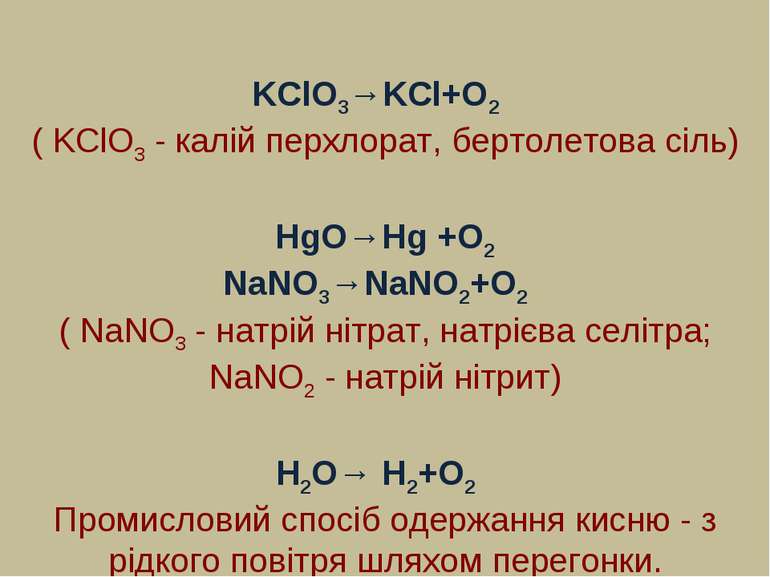
KClO3→KCl+O2 ( KClO3 - калій перхлорат, бертолетова сіль) HgO→Hg +O2 NaNO3→NaNO2+O2 ( NaNO3 - натрій нітрат, натрієва селітра; NaNO2 - натрій нітрит) H2O→ H2+O2 Промисловий спосіб одержання кисню - з рідкого повітря шляхом перегонки.
Повторення вивченого: 1)Які нові поняття ви сьогодні вивчали? 2)Що таке каталізатор? 3)Які реакції називаються реакціями розкладу? 4)Де можна використовувати лабораторні способи одержання кисню?
Домашнє завдання Прочитати параграф, виконати вправи. Творче завдання. Підготувати розповідь про просту речовину O3 - озон.
Схожі презентації
Категорії