Презентація на тему:
Оксиген. Кисень. Фізичні властивості кисню. Добування в лабораторії.
Завантажити презентацію
Оксиген. Кисень. Фізичні властивості кисню. Добування в лабораторії.
Завантажити презентаціюПрезентація по слайдам:
Оксиген. Кисень. Фізичні властивості кисню. Добування в лабораторії. Підготувала: вчитель хімії вищої категорії Черкун Марина Віталіївна
План Положення Оксигену у періодичній системі. Оксиген – хімічний елемент. Кисень – проста речовина. Історія відкриття кисню. Фізичні властивості кисню. Добування кисню в лабораторії. Способи збирання кисню.
Оксиген – хімічний елемент Хімічний символ – О Відносна атомна маса – Ar(О)=16 Валентність – ІІ Поширеність у природі: - літосфера – 46,6 % - гідросфера – 85,6 % - атмосфера – 20,91 %
Історія відкриття кисню 1772 р. - шведський учений Карл-Вільгельм Шеєле відкрив кисень, здійснивши такі перетворення: 1774 р. – кисень відкрив французький хімік Антуан Лоран Ловуазьє, проводячи досліди з нагрівання гідраргірум (ІІ) оксиду: 1774 р. – англійський хімік і філософ Джозеф Прістлі, не знаючи про відкриття попередників, знову відкрив кисень з тієї ж речовини, що й А. Лавуазьє 2MnO2 + 2H2SO4 = 2MnSO4 + 2H2O + O2 2NaNO3 = 2NaNO2 + O2 2HgO = 2Hg + O2
Історія відкриття кисню “ Очищене повітря ”, вогняне повітря “, “ діфлогістоване повітря “, “ життєвий газ “, “ райський газ “ – такими були назви кисню до того, як А.Лавуазьє назвав його киснем – тим, що народжує кислоти. У сучасній науці вважають, що першість відкриття кисню належить Шеєле і Прістлі, а назва – Лавуазьє.
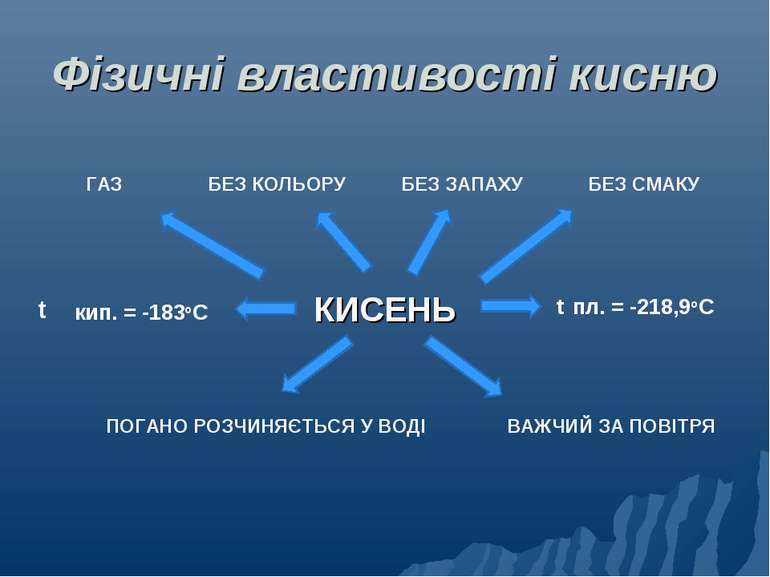
Фізичні властивості кисню КИСЕНЬ ГАЗ БЕЗ ЗАПАХУ БЕЗ СМАКУ БЕЗ КОЛЬОРУ ВАЖЧИЙ ЗА ПОВІТРЯ ПОГАНО РОЗЧИНЯЄТЬСЯ У ВОДІ кип. = -183оС пл. = -218,9оС t t
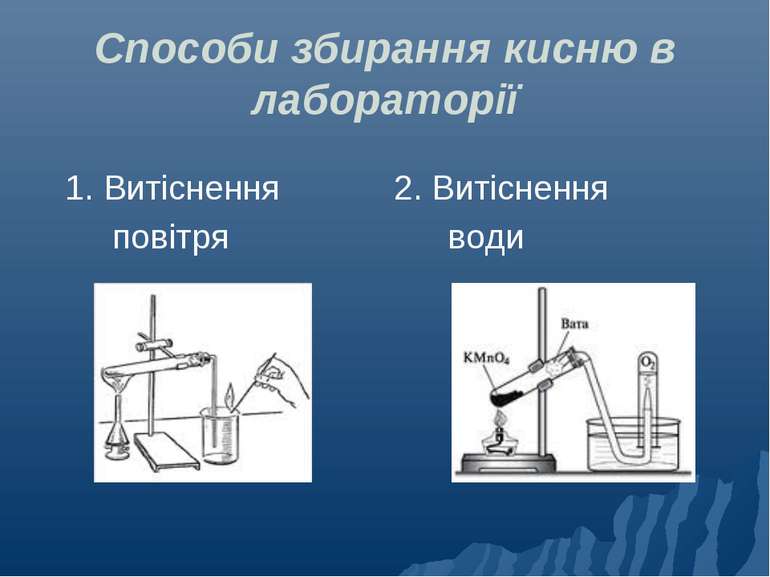
Добування кисню в лабораторії 2 КМnO4 = + + K2MnO4 MnO2 O2 2 H2O2 = H2O + 2 O2 HgO 2 = Hg + O2 2 2 Н2О = 2 Н2 + O2 MnO2 2 KClO3 = 2 KCl + 3 O2 MnO2 MnO2 - каталізатор
Перевір себе! 1.Хімчний елемент Оксиген позначається символом: а) N б) H в) O г) Cl 2. Агрегатний стан кисню за стандартних умов: а) твердий б) рідкий в) рідкий та твердий г)газуватий 3. Оксиген як хімічний елемент: а) підтримує дихання б) окислює органічні речовини в) входить до складу води г) підтримує горіння 4. Хімічна формула простої речовини кисню: а) N2 б) H2 в) O2 г) Cl2
Перевір себе! 5. За стандартних умов кисень у воді: а) добре розчинний б) мало розчинний в) нерозчинний г) розкладається 6. Кисень – проста речовина, яка: а) входить до складу піску б) входить до складу води в) підтримує дихання г) входить до складу гліни 7. Кисень можна збирати способом витіснення води, тому що він за стандартних умов: а) мало розчинний у воді б) важче за воду г) добре розчиняється у воді д) легший за воду 8. Якщо у пробірку з киснем внести тліючу скипку, вона: а) гасне б) горить менш інтенсивно в) горить без змін г) спалахує
Схожі презентації
Категорії