Презентація на тему:
панас мирний
Завантажити презентацію
панас мирний
Завантажити презентаціюПрезентація по слайдам:
Склад, властивості, застосування окремих представників вуглеводнів (метан, етан, етен, етин)
Метан Мета н — найпростіша органічна сполука вуглецю з воднем, природний безбарвний газ без запаху, хімічна формула — CH4.
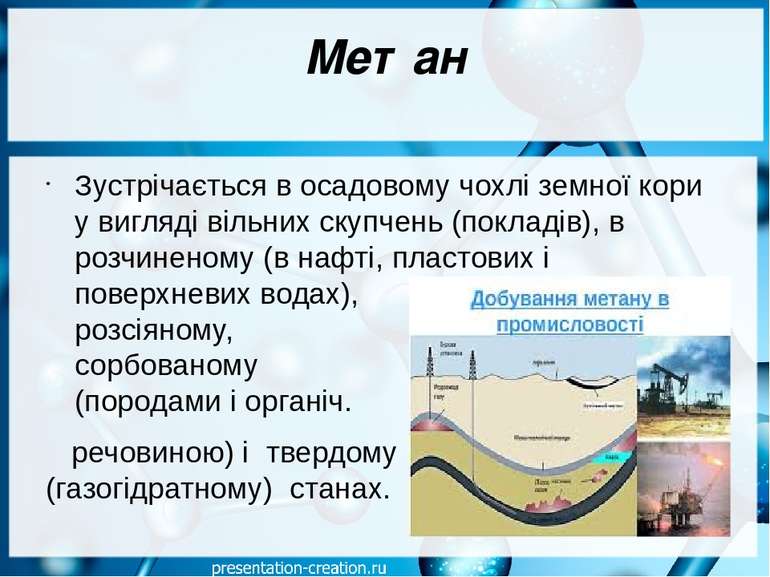
Метан Зустрічається в осадовому чохлі земної кори у вигляді вільних скупчень (покладів), в розчиненому (в нафті, пластових і поверхневих водах), розсіяному, сорбованому (породами і органіч. речовиною) і твердому (газогідратному) станах.
Метан Метан є основним компонентом: газів природних горючих (до 99,5 %), нафтових попутних (39—91 %), болотяних (понад 99 %) і рудникових (34—48 %) газів; присутній у газах грязьових вулканів (понад 95 %), спорадично зустрічається у вулканічних газах і в газах магматичних і метаморфічних порід.
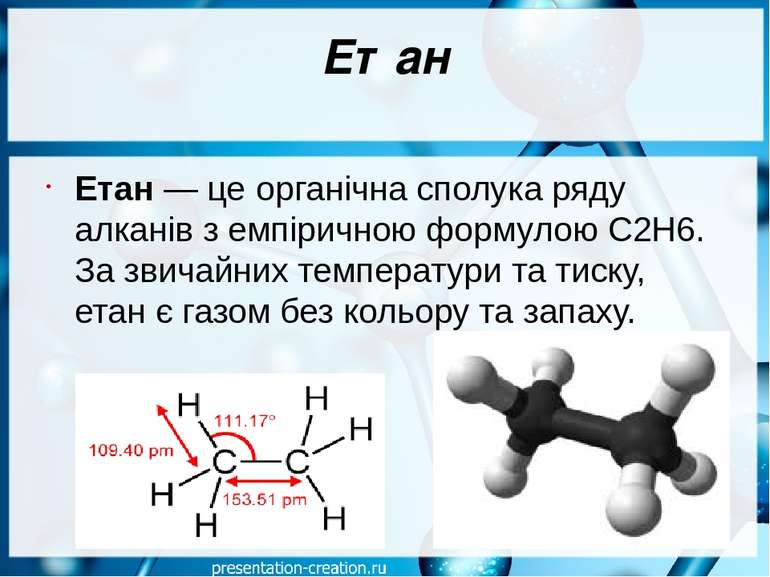
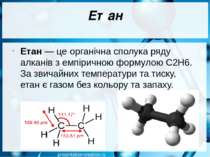
Етан Етан — це органічна сполука ряду алканів з емпіричною формулою C2H6. За звичайних температури та тиску, етан є газом без кольору та запаху.
Етан Етан та інші гомологи метану є складовою частиною природного газу. У різних покладах вміст етану коливається від 0,5% до 4%.
Етан У промисловому масштабі етан відокремлюють від природного газу як побічний продукт переробки нафти
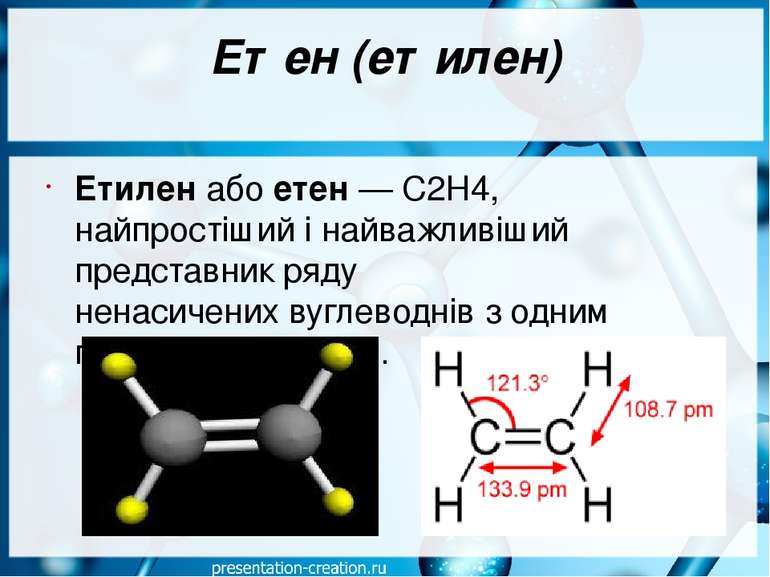
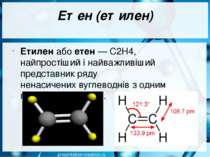
Етен (етилен) Етиле н або ете н — С2Н4, найпростіший і найважливіший представник ряду ненасичених вуглеводнів з одним подвійним зв'язком.
Етилен Етилен — безбарвний газ із слабким приємним запахом. Він трохи легший від повітря. У воді мало розчинний, а в спирті й інших органічних розчинниках розчиняється добре.
Етин (ацетилен) Ацетиле н (етин) — безбарвний газ, без запаху, легший за повітря. Хімічна формула
Етин (ацетилен) Ацетилен — при нормальних умовах — безбарвний газ без запаху, малорозчинний в воді, легший за повітря. При сильному охолодженні переходить відразу в білу кристалічну речовину, минаючи рідкий стан. При —83,6°С випаровується (сублімує), не розплавляючись.
Етин (ацетилен) При стисненні розкладається з вибухом, зберігають в балонах, заповнених активованим вугіллям, що просочене ацетоном, в якому ацетилен розчиняється під тиском в великих кількостях. Вибухонебезпечний. C2Н2 виявлений на Урані і Нептуні.
Метанол, етанол, гліцерин, їхні молекулярні та структурні формули, фізичні властивості. Функціональна гідроксильна група.
Спирт – це органічна сполука, молекула якої містить одну або декілька гідроксильних груп (ОН), сполучених з вуглеводневим радикалом. Спирт – який містить одну функціональну групу (ОН) – називається одноатомним. Загальна формула цього одноатомного спирту має наступний вигляд: СnH2n+1 ОН Представниками одноатомних спиртів є: Метанол – СН3ОН, етанол – С2Н5ОН
Спирт – який містить декілька функціональних груп (ОН)називається багатоатомним. Одним із представників багатоатомних спиртів є гліцерин, формула якого С3Н5(ОН)3
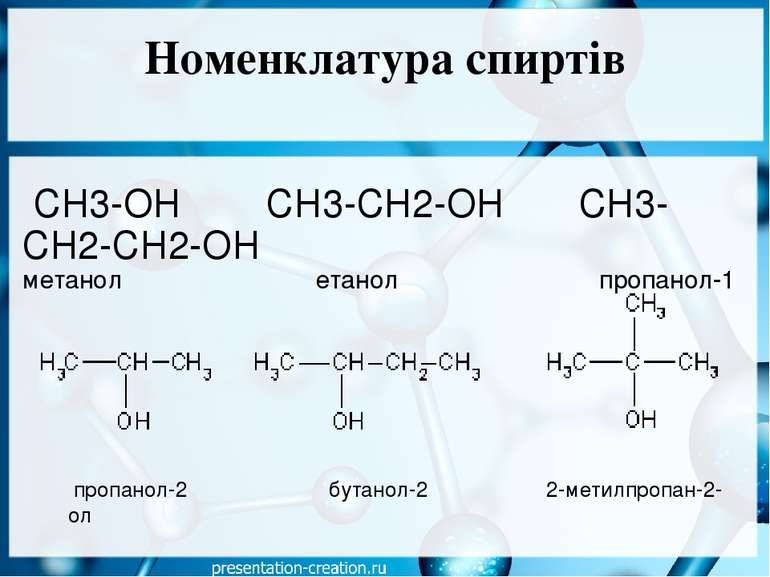
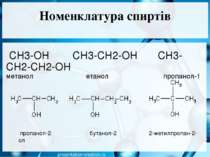
Номенклатура спиртів СН3-ОН СН3-СН2-ОН СН3-СН2-СН2-ОН метанол етанол пропанол-1 пропанол-2 бутанол-2 2-метилпропан-2-ол
Фізичні властивості Нижчі спирти (до C15) - рідини, вищі - тверді речовини. Метанол і етанол змішуються з водою в будь-яких співвідношеннях. З ростом молекулярної маси розчинність спиртів у воді падає. СН3-ОН СН3-СН2-ОН метанол етанол
Одноатомний спирт метанол Рідина без кольору з температурою кипіння 64С, характерним запахом Легше води. Горить безбарвним полум'ям. Отруйна дія метанолу заснована на ураженні нервової і судинної системи. Прийом всередину 5-10 мл метанолу призводить до важкого отруєння, а 30 мл і більше - до смерті.
Одноатомний спирт етанол Безбарвна рідина з характерним запахом і пекучим смаком, температурою кіпенія78С. Легше води. Змішується з нею в будь-яких відносинах. Легко запалюється, горить слабо світиться блакитним полум'ям
Трьохатомний спирт гліцерин (гліцерол) Гліцерин - безбарвна, в'язка, гігроскопічна рідина, необмежено розчинна у воді. Солодкий на смак, від чого і отримав свою назву (глікос - солодкий). Добре розчиняє багато речовин.
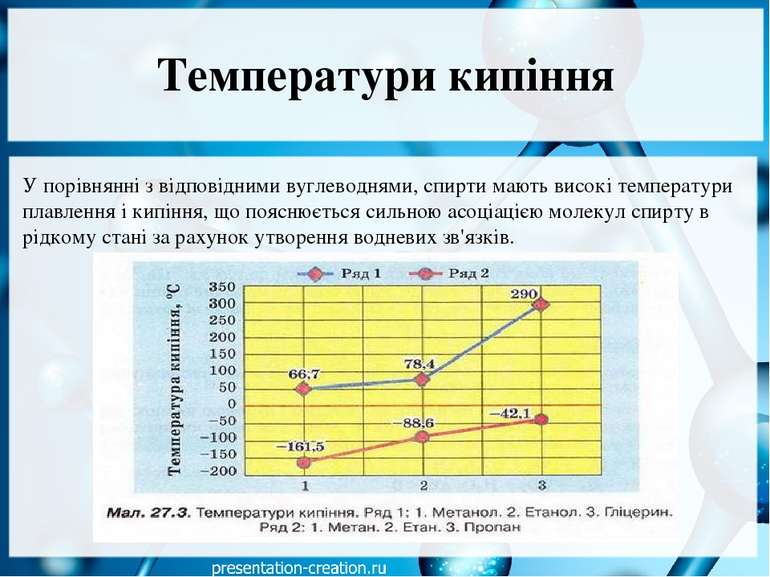
Температури кипіння У порівнянні з відповідними вуглеводнями, спирти мають високі температури плавлення і кипіння, що пояснюється сильною асоціацією молекул спирту в рідкому стані за рахунок утворення водневих зв'язків.
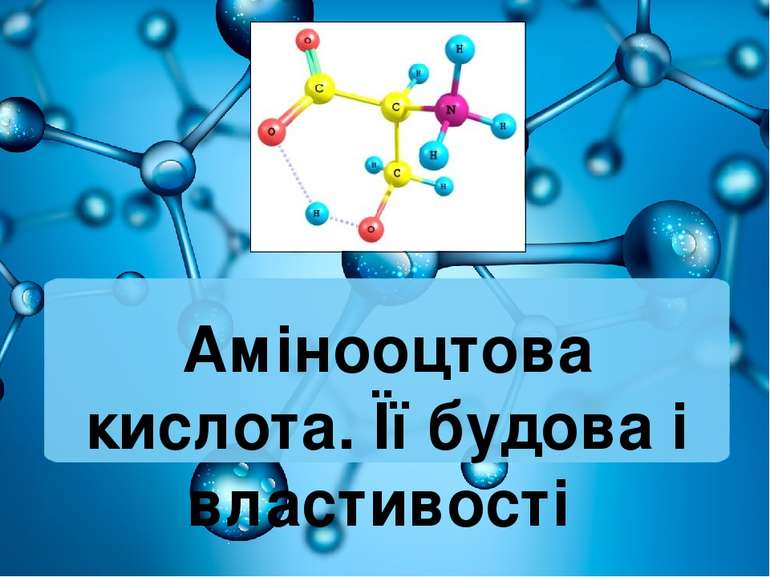
Найпростіший представник класу амінокислот має формулу H2N − CH2 −COOH — аміноетанова (або амінооцтова) кислота — перший член гомологічного ряду одноосновних насичених амінокислот.
Хімічні властивості амінооцтової кислоти Особливості хімічних властивостей зумовлені одночасною наявністю в молекулах двох функціональних груп: основної H2N − і кислотної COOH, тому амінокислоти за хімічними властивостями — амфотерні органічні сполуки.
Амінокислоти за кислотними властивостями сильніші за карбонові кислоти Як основи амінокислоти взаємодіють із кислотами (реакція приєднання): H2N − CH2 −COOH + HCl → [H3N − CH2 –COOH]+ Cl−
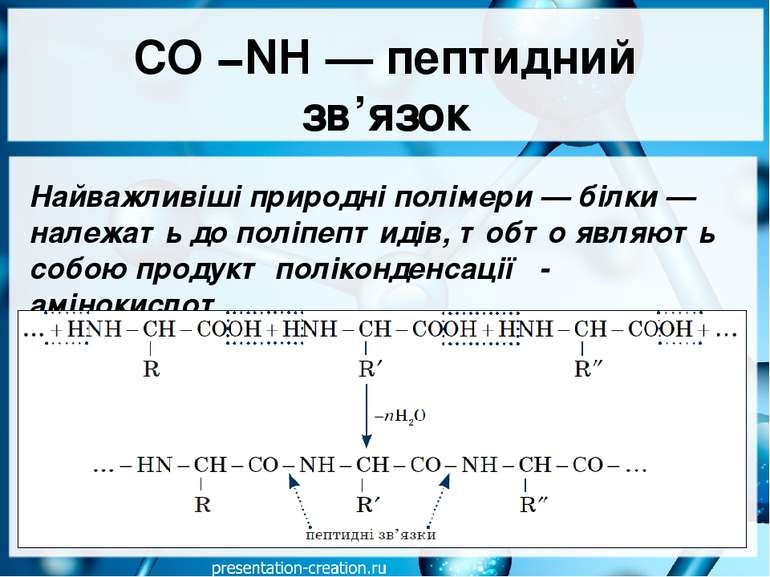
Важлива властивість амінокислот — здатність взаємодіяти одна з одною завдяки наявності двох функціональних груп. Міжмолекулярна взаємодія α-амінокислот приводить до утворення пептидів. У результаті взаємодії двох α-амінокислот утворюється дипептид.
CO −NH — пептидний зв’язок Найважливіші природні полімери — білки — належать до поліпептидів, тобто являють собою продукт поліконденсації α-амінокислот.
Одержання амінокислот Гідроліз білків Дія амоніаку на галогенозаміщені карбонові кислоти: ClCH2 − COOH + 2H3N → H2N −CH2 − COOH + NH4Cl
Схожі презентації
Категорії