Презентація на тему:
Захист даних і продовження терміну дії патентних прав в Україні
Завантажити презентацію
Захист даних і продовження терміну дії патентних прав в Україні
Завантажити презентаціюПрезентація по слайдам:
Захист даних і продовження терміну дії патентних прав Вимоги ТРІПС і положення ТРІПС-плюс Карлос Корреа
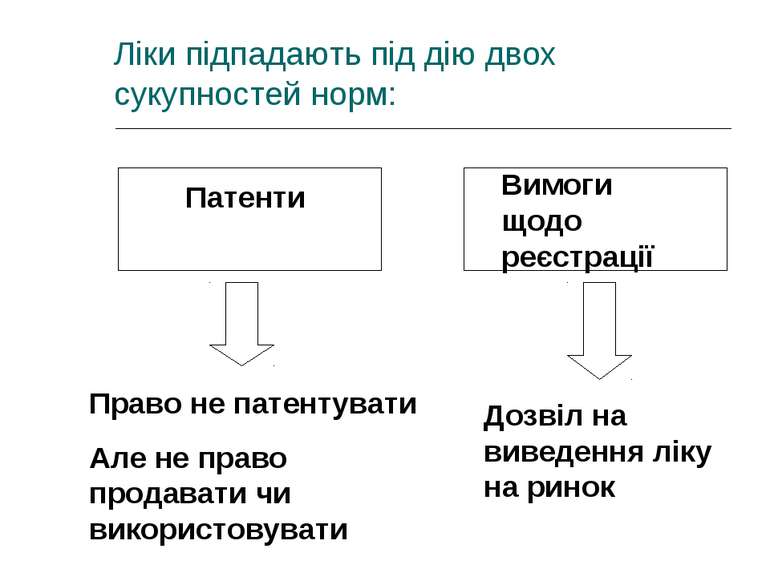
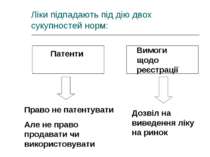
Ліки підпадають під дію двох сукупностей норм: Патенти Вимоги щодо реєстрації Право не патентувати Але не право продавати чи використовувати Дозвіл на виведення ліку на ринок
Стаття 39 п. 3 ТРІПС Члени, вимагаючи як умову отримання дозволу на збут фармацевтичної продукції або продукції сільсько-господарської хімії, у якій використовуються нові хімічні речовини, надання нерозголошуваних даних випробувань або інших даних, отримання яких потребує значних зусиль, повинні захищати такі дані від нечесного комерційного використання. Крім того, Члени повинні захищати такі дані від розкриття, окрім тих випадків, коли це необхідно для захисту населення або якщо не вжито заходів для забезпечення захисту таких даних від нечесного комерційного використання.
“Нечесне комерційне використання” - Орган із регулювання лікарських засобів (ОРЛЗ) не може вимагати ці дані (затвердження за посиланням). Навіть якщо ОРЛЗ усе ж використовує ці дані, це не є комерційним використанням.
Ексклюзивність даних Упродовж періоду ексклюзивності даних органи влади не можуть використовувати дані випробувань чи покладатися на них для реєстрації еквівалентів-генериків.
Поки триває період ексклюзивності даних: Виробники генериків повинні надавати власні дані, щоб довести безпечність та ефективність. => Їм доведеться повторювати клінічні випробування та інші тести. Або ж вони можуть увійти на ринок тільки після закінчення періоду ексклюзивності даних.
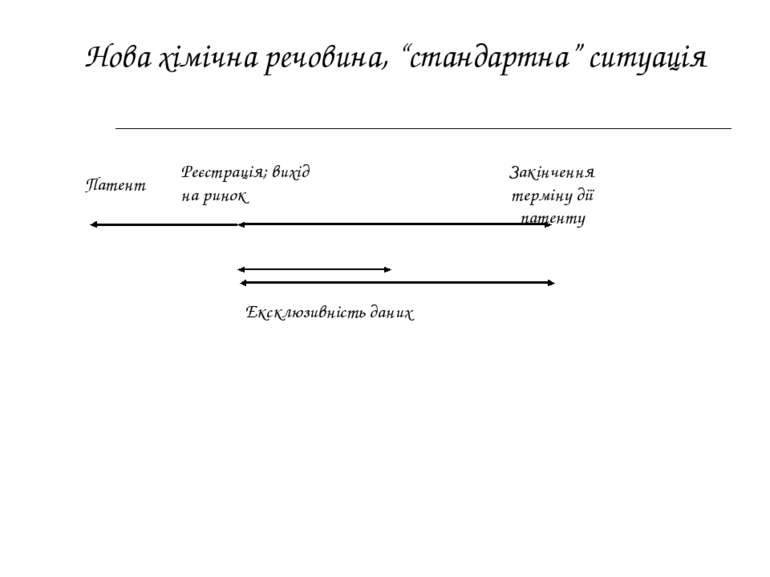
Патент Реєстрація; вихід на ринок Закінчення терміну дії патенту Ексклюзивність даних Нова хімічна речовина, “стандартна” ситуація
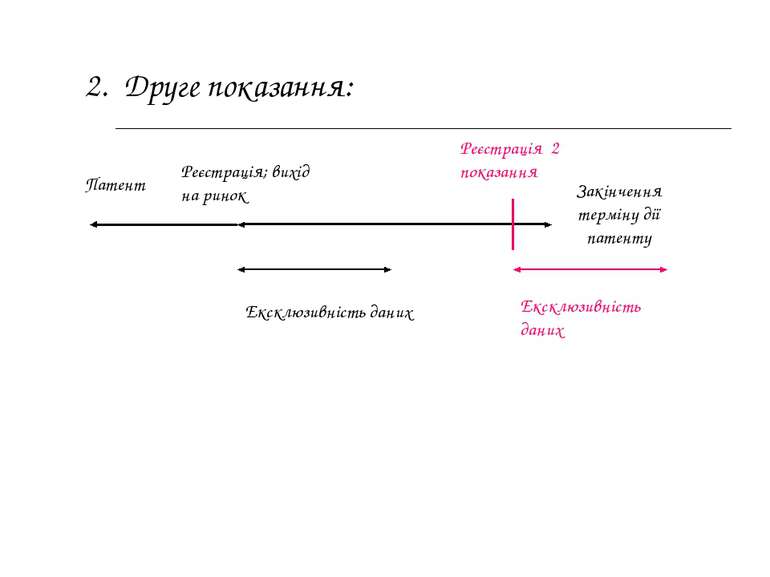
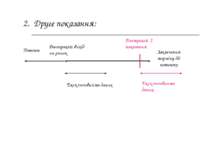
Патент 2. Друге показання: Реєстрація 2 показання Ексклюзивність даних Реєстрація; вихід на ринок Закінчення терміну дії патенту Ексклюзивність даних
Патент Реєстрація; вихід на ринок Закінчення терміну дії патенту Ексклюзивність даних 1. НХР, обов'язкове ліцензування:
Директива 2004/27/EC Стаття 10 1. .. Без шкоди для законодавства щодо охорони промислової та комерційної власності заявник не повинен надавати результати доклінічних тестів і клінічних випробувань, якщо він може продемонструвати, що лікарський засіб є генериком референтного лікарського засобу, який санкціонується чи санкціонований за статтею 6 на строк не менше восьми років у державі-члені чи у Співтоваристві. Генеричний лікарський засіб, санкціонований за цим положенням, не випускається на ринок доти, доки не мине десять років від дати видачі першого дозволу на референтний засіб.
Директива 2004/27/EC 5. На додаток до положень, викладених у п. 1, там, де заявка подається на нове показання для усталеної речовини, надається період ексклюзивності даних тривалістю один рік (не наростаючим підсумком), за умови, що стосовно нового показання проведені значні доклінічні або клінічні дослідження.
Директива 2004/27/EC Стаття 10а У порядку часткового відступлення від статті 8(3)(i) та без шкоди для законодавства щодо охорони промислової та комерційної власності заявник не повинен надавати результати доклінічних тестів і клінічних випробувань, якщо він може продемонструвати, що активні речовини лікарського засобу використовуються на загальноприйнятій основі у Співтоваристві протягом принаймні десяти років із визнаною ефективністю та прийнятним рівнем безпечності з точки зору умов, викладених у Додатку І. У цьому випадку результати тестів та випробувань замінюються відповідною науковою літературою.
Захист даних: Директива 2004/27/EC: 8+2+1 -Не дає органам влади розглядати заявки на генерики протягом 8 років. -Збут генериків може бути дозволений тільки через 10 років. -Один додатковій рік для нових показань для відомих продуктів.
Регламент (EC) № 1901/2006 Європейського Парламенту і Ради від 12 грудня 2006 р. щодо продуктів для педіатричного застосування -Дозвіл на збут для педіатричного застосування (ДЗБЗ): 10 років ексклюзивності ринку. -Лікарський засіб, що отримав ДЗБЗ, може користуватися існуючою фірмовою назвою відповідного санкціонованого виробу.
Регламент Європейського Парламенту і Ради (EC) № 141/2000 від 16 грудня 1999 р. про лікарські засоби для лікування рідкісних захворювань -Діагностика, профілактика і лікування захворювання, що вражає менш ніж п'ятьох осіб на кожну тисячу населення Співтовариства. -Ексклюзивні права на збут на десять років. На вимогу держави-члена цей термін може бути скорочений до шести років, якщо ця держава може констатувати, що умови, які виправдовують класифікацію цього лікарського засобу як засобу для лікування рідкісного захворювання, більше не виконуються або що ціна, стягувана за цей лікарський засіб, є надмірною. -Ексклюзивність не перешкоджає збутові другого лікарського засобу, якщо власник дозволу на збут першого засобу для лікування рідкісного захворювання надав згоду другому заявникові або якщо він не може постачати достатні кількості даного лікарського засобу, або якщо інший лікарський засіб виявляється безпечнішим, ефективнішим або в іншому аспекті клінічно кращим, ніж перший засіб.
Україна: Закон “Про лікарські засоби”, стаття 9 “Якщо лікарський засіб зареєстрований в Україні, забороняється протягом п'яти років з дати такої реєстрації (незалежно від строку чинності будь-якого патенту, який має відношення до лікарського засобу) використовувати реєстраційну інформацію для подання заяви про державну реєстрацію іншого лікарського засобу, крім випадків,коли право посилатись або використовувати таку інформацію одержано в установленому порядку”.
Продовження терміну дії патенту США для компенсації затримки в затвердженні лікарських засобів (Звід законів США, р. 35§156) -Максимум: п'ять років -Загальний період ефективної патентної охорони не може перевищувати 14 років (початковий термін дії патенту, скорочений на термін регуляційного тестування, плюс продовження)
Регламент Ради (EEC) № 1768/92 від 18 червня 1992 р. Виріб захищається основним чинним патентом. Виріб, такий як лікарський засіб, отримує дозвіл на збут. Виріб уже не є предметом свідоцтва. Дозвіл на збут – перший дозвіл для виведення виробу на ринок як лікарського засобу. Свідоцтво поширюється на виріб так само, як і патент, яким він користується. Свідоцтво не може надаватися на строк більше 5 років. Тривалість охорони, наданої патентом і свідоцтвом, не може перевищувати загалом 15 років для першого дозволу на збут, виданого власнику.
Вплив ТРІПС-плюс на ціну ліків у Коста-Ріці у 2030 р. -Кількість нових продуктів, які підпадають під дію ексклюзивних прав: з 9% у 2010 р. до 28% у 2030 р. -Річне зростання видатків на соціальне забезпечення: 31%.
Колхіцин: наслідки ексклюзивності даних -Широкодоступний як генеричний препарат у США з 19-го століття: препарат другої лінії для лікування подагри. -Тести за участю 185 пацієнтів, один тиждень: скорочений режим дозування (менше негативних ефектів): 3 роки ексклюзивності даних. Сімейна середземноморська лихоманка (ССЛ) (генетичне запальне порушення): 7 років ексклюзивності за Законом про засоби для лікування рідкісних захворювань. - Судові позови на предмет усунення інших різновидів колхіцину з ринку. -Підвищення ціни більш ніж у 50 разів – з $0,09 до $4,85 за таблетку.
Схожі презентації
Категорії