Презентація на тему:
ПОВЕРХНЕВІ ЯВИЩА АДСОРБЦІЯ
Завантажити презентацію
ПОВЕРХНЕВІ ЯВИЩА АДСОРБЦІЯ
Завантажити презентаціюПрезентація по слайдам:
План Поверхневий натяг. Рівняння Гіббса. Адсорбція газів. Адсорбція з розчинів Адсорбція іонів. Хроматографія
Поверхневі явища Це процеси, які проходять на межі розділення фаз в гетерогенних системах. За агрегатним станом контактуючих фаз поверхні поділу класифікуть на: рухомі межі поділу: рідина-газ, рідина-рідина нерухомі межі поділу: тверде тіло-газ, тверде тіло-рідина Властивості молекул в поверхневому шарі і в об*ємі системи істотно відрізняються між собою.
Властивості молекул в поверхневому шарі і в об*ємі системи істотно відрізняються між собою. Поверхневі молекули рідини завжди перебувають під дією сили, яка намагається втягнути їх всередину, тобто. поверхня рідини намагається скоротитися.
Поверхнева енергія Gs Важливою характеристикою поверхневої фази є поверхнева енергія Gs – різниця середньої енергії частинки, яка знаходиться на поверхні, і частинки, що знаходиться в об*ємі фази G = σ S
Поверхневий натяг σ Для характеристики поверхні разділу, що відділяє дану фазу від іншої, вводиться поверхневий натяг σ – відношення поверхневої енергії до площі поверхні поділу фаз
Методи визначення поверхневого натягу Метод капілярного підняття рівня рідини; Максимального тиску бульбашок газу на рідину (метод Рібендера); Підрахунку краплин (сталагмометричний метод); Відриву кільця; Втягування пластинки (метод Вільгельмі).
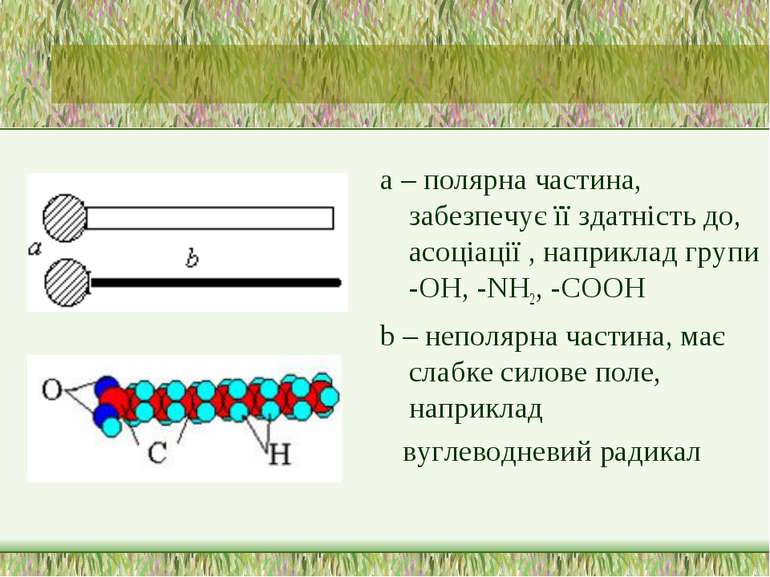
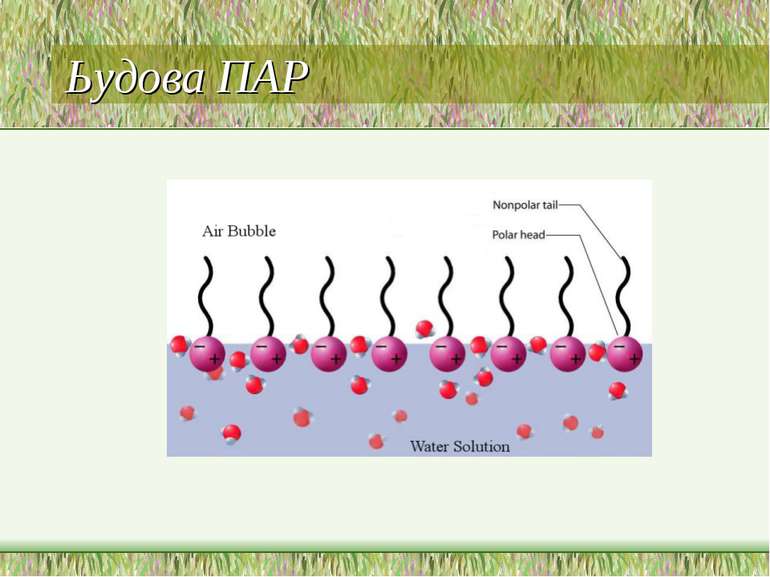
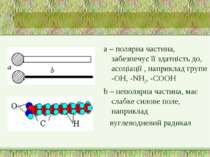
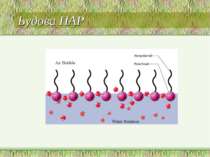
Поверхнево-активні речовини (ПАР) ПАР - це сполуки, які адсорбуються на поверхні разділу фаз і зменшують поверхневий натяг води. Американські вчені Ленгмюр і Гаркінс висунули припущення, що ПАР мають дифільну будову, тобто. складаються з частин - полярної і неполярної.
а – полярна частина, забезпечує її здатність до, асоціації , наприклад групи -ОН, -NH2, -СООН b – неполярна частина, має слабке силове поле, наприклад вуглеводневий радикал
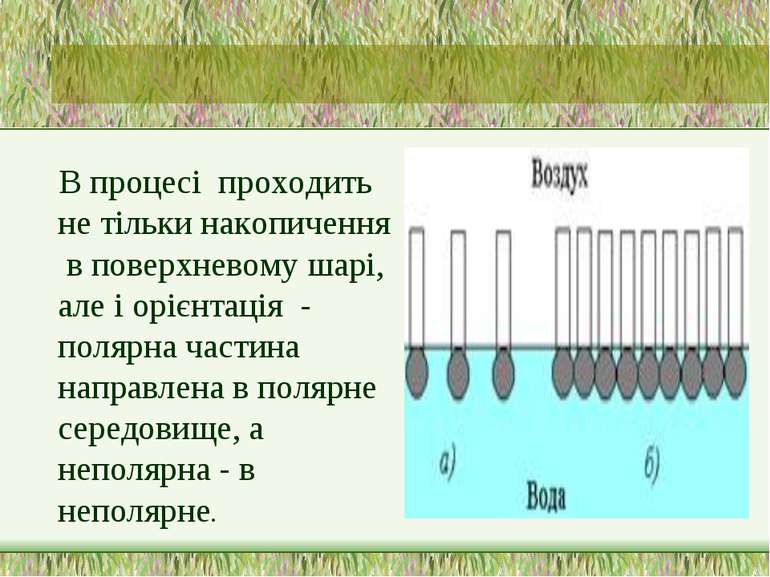
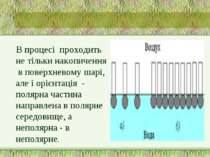
В процесі проходить не тільки накопичення в поверхневому шарі, але і орієнтація - полярна частина направлена в полярне середовище, а неполярна - в неполярне.
Речовини, додавання яких до розчинника зменшує поверхневий натяг, называються поверхнево-активними (ПАР) Речовини, додавання яких збільшує або не змінює поверхневий натяг – поверхнево-інактивними (ПіАР).
ПАР До поверхнево-активних належать органічні сполуки: жирні кислоти, солі жирних кислот (мило), сульфокислоти, спирти, аміни, білки. До поверхнево-інактивних належать неорганічні кислоти, луги, солі.
Правило Дюкло -Траубе В гомологичному ряду при малих концентраціях збільшення вуглецевого данцюга на одну групу СН2 збільшує поверхневу активність в 2,5 – 3.5 рази.
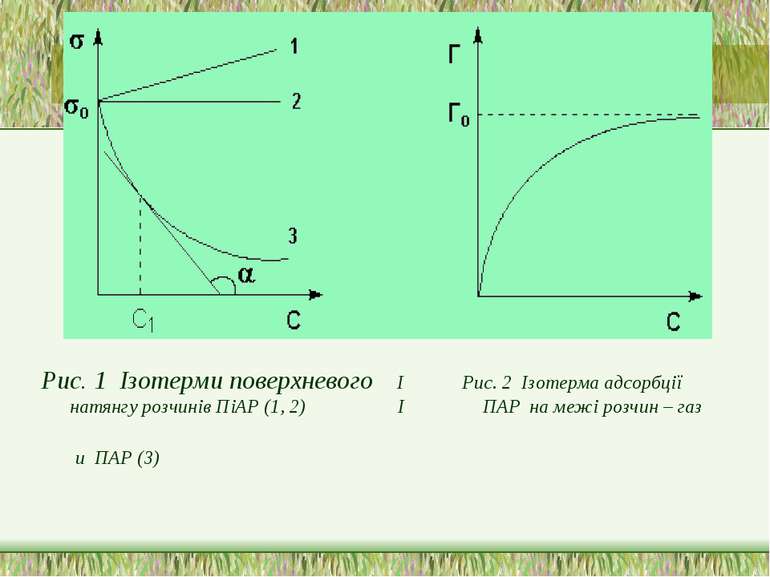
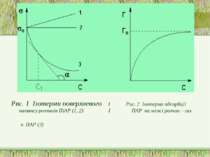
Рис. 1 Ізотерми поверхневого І Рис. 2 Ізотерма адсорбції натянгу розчинів ПіАР (1, 2) І ПАР на межі розчин – газ и ПАР (3)
Адсорбція -зміна концентрації компонентів в поверхневому шарі порівняно з об*ємом фази. В розчинах поверхнево-активних речовин взаємодія між молекулами ПАР та диполями води слабша, ніж між молекулами розчинника, тому молекули ПАР виштовхуються з об'єму розчину в поверхневий шар. Проходить позитивна адсорбція: Г > 0 Поверхнево інактивні речовини добре розчинні у воді і взаємодія їх із розчинником сильніша, ніж між молекулами розчинника, тому вони прагнуть піти з поверхні в глибину розчину. В результаті проходить негативна адсорбція: Г < 0
Рівняння Гіббса Американський вчений Гіббс вивів рівняння, яке пов'язує величину адсорбції з концентрацією поверхнево-активної речовини та поверхневим натягом розчину поверхнева активність
Сорбція Сорбція – поглинання однієї речовини іншою речовиною Сорбент – це є та речовина, яка поглинає іншу речовину. Сорбтив або сорбат – це є та речовина, яка поглинаєься. Адсорбція - зміна концентрації компонентів в поверхневому шарі порівняно з об*ємом фази.
Cорбція Якщо внести у водний розчин оцтової кислоти порошок активованого вугілля, то на поверхні твердої фази відбудеться накопичення молекул розчиненої речовини. Причому далі поверхневого шару це переміщення молекул не відбувається. Аналогічне явище буде спостерігатися при контакті вугілля з повітрям, в якому є фосген, хлор, або інші гази у стані, далекому від насичення.
Cорбція Інший приклад. Якщо порошок оксиду кальцію привести у контакт із діоксидом вуглецю, то збільшення концентрації газу у поверхневому шарі буде супроводжуватися хімічною реакцією з утворенням нової твердої фази — карбонату кальцію. Крім цього, діоксид вуглецю буде проникати із поверхневого шару всередину зерен порошку, утворюючи і там карбонат кальцію. Отже, процес відбувається не тільки на поверхні, але й в об'ємі системи. .
Активоване вугілля - цей адсорбуючий засіб, який отримують з копалин або деревного вугілля. Спеціальне тонкопористый активоване вугілля роблять шляхом термічної обробки без доступу повітря з деяких полімерів. Корисні властивості вугілля були відомі ще в Стародавньому Єгипті, де деревне вугілля використовували в медичних цілях вже за 1,5 тис. років до н.е. Древні римляни також користувалися вугіллям для очищення води, пива і вина. Адсорбція газів деревним вугіллям була відкрита ще в 1773 році шведським хіміком Шеєле, а адсорбція речовин з розчинів за допомогою активованого вугілля - в 1785 році російським хіміком Ловицем. З цього ж часу активоване вугілля стали застосовувати в якості протиотрути для зв'язування отрут, що потрапили в шлунково-кишковий тракт, а також для адсорбції газів при здутті живота (метеоризмі).
Основна властивість активованого вугілля - висока сорбційна здатність, обумовлена великою кількістю пір в його поверхні. Величина пір залежить від технології обробки використовуваних для його приготування продуктів. Активоване вугілля добре адсорбує газоподібні речовини, токсини і органічні сполуки. Слабо адсорбує кислоти і луги (у тому числі солі заліза, ціаніди, метанол). Не дратує слизові оболонки. При місцевому застосуванні в пластирі збільшує швидкість загоєння виразок. Вугілля активований не токсичний, добре виводиться з організму, не всмоктуючись при цьому в кишковику. Повністю виводиться з каловими масами через 7-10 годин забарвлюючи їх в чорний колір.
Фізична адсорбція проявляється за рахунок Ван-дер-Васльсових взаємодій. Вона характеризується зворотністю і зменшенням адсорбції при підвищенні температури. Хімічна адсорбція (хемосорбція) здійснюється за хімічної взаємодії молекул адсорбента и адсорбата.
Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата. Хемосорбция обычно необратима; химическая адсорбция, в отличие от физической, является локализованной, т.е. молекулы адсорбата не могут перемещаться по поверхности адсорбента. Повышение температуры способствует её протеканию.
Cорбція Усі подібні процеси називають сорбційними. Отже, сорбцією називають зміну концентрації одного або декількох компонентів у гетерогенній системі. Сорбентами називаються речовини, що поглинають інші речовини, незалежно від їх агрегатного стану і ступеня дисперсності. Наприклад, тверді сорбенти — активоване вугілля, силікагель; рідкий сорбент — краплі емульсії; газоподібний сорбент — бульбашки піни).
Cорбція Адсорбцією називається процес самочинної зміни концентрації компонента у поверхневому шарі, порівняно із об'ємом фази. Зміні концентрації речовини у поверхневому шарі, яка проходить в результаті дії міжмолекулярних сил, буде перешкоджати тепловий рух молекул, що намагається вирівняти концентрацію компонента в усіх частинах системи. Внаслідок дії цих протилежних факторів у системі через деякий час встановлюється адсорбційна рівновага, при якій концентрація речовини у поверхневому шарі буде більшою (позитивна адсорбція) або меншою (негативна адсорбція), порівняно з її концентрацією у об'ємі фази.
Cорбція Процеси, які завершуються в поверхневому шарі, можна розділити на адсорбцію та поверхневі хімічні реакції. Процеси, які проходять не тільки на поверхні, але й у об'ємі твердого сорбенту, поділяють на абсорбцію, хемосорбцію і капілярну конденсацію. Прикладом абсорбції може служити поглинання водню платиною або нікелем. Хемосорбція спостерігається при поглинанні диоксиду вуглецю оксидом кальцію, вона супроводжується збільшенням кількості фаз у системі. Капілярна конденсація відбувається при контакті пористих сорбентів із парою, яка легко конденсується: води, спирту, бензолу та інших рідин.
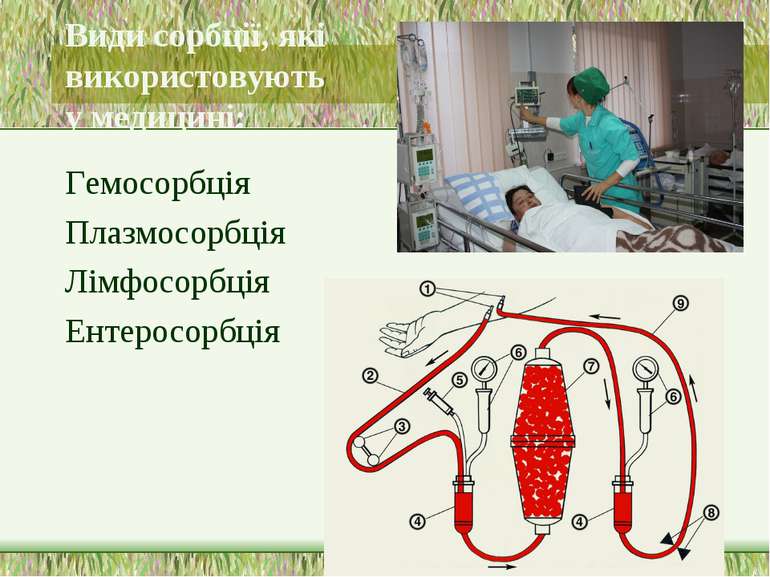
Види сорбції, які використовують у медицині: Гемосорбція Плазмосорбція Лімфосорбція Ентеросорбція
Адсорбція з розчинів Молекулярна, адсорбуються електроліти Іонна, адсорбуються сильні електроліти Правило вирівнювання полярності фаз Ребіндера: розчинена речовина тим краще адсорбується, чим більша різниця полярностей між нею і розчинником.
Іонна адсорбцІя Це хімічна взаємодія між іонами розчиненої речовини з твердою поверхнею адсорбента. Іонна адсорбція проходить за двома механізмами: 1)вибіркова адсорбція 2) іонообмінна адсорбція
Правило Пескова Фаянса Перше правило. На поверхні кристалічного твердого тіла з розчину електроліту специфічно адсорбується іон, який здатний добудовувати його кристалічну решітку або може утворювати з одним з іонів, що входять в склад кристала, малорозчинну сполуку.
Правило Пескова Фаянса Друге правило. На твердій поверхні адсорбента адсорбуються тільки ті іони, знак заряду яких протилежний знаку заряду поверхні адсорбента
іонообмінна адсорбція іонообмінна адсорбція - це процес обміну іонів з одинаковим зарядом який проходить між адсорбентом і адсорбатом в точно еквівалентних співвідношеннях. Адсорбенти, на яких проходить процес обміну іонів називають іонітами (іонообмінниками).
Хроматографічний метод Хроматографічний метод є фізико-хімічним методом розділення компонентів складних сумішей газів, парів, рідин або розчинених речовин, що грунтується на використанні сорбційних процесів в динамічних умовах. Хроматографічне розділення грунтується на явищах адсорбції і десорбції, рівновазі між цими явищами для речовини у рухомій і нерухомій фазах.
Хроматографічний метод Окрім свого головного завдання – якісного та кількісного аналізу складних сумішей, – хроматографічні методи вирішують і наступні завдання: а) ідентифікація речовин і встановлення відмінностей між ними; б) розділення складних сумішей на окремі компоненти з препаративною метою; в) випробовування речовини на однорідність, на чистоту; г) очистка речовин від домішок; д) концентрування речовини і її виділення з розведених розчинів чи сумішей.
Cорбція Залежно від агрегатного стану рухомої фази розрізняють рідинну хроматографію і газову хроматографію. Газова хроматографія поділяється на газоадсорбційну і газорідинну.
хроматографія За механізмом розділення є такі види хроматографії: адсорбційна розподільна йонообмінна ексклюзійна осаджувальна афінна.
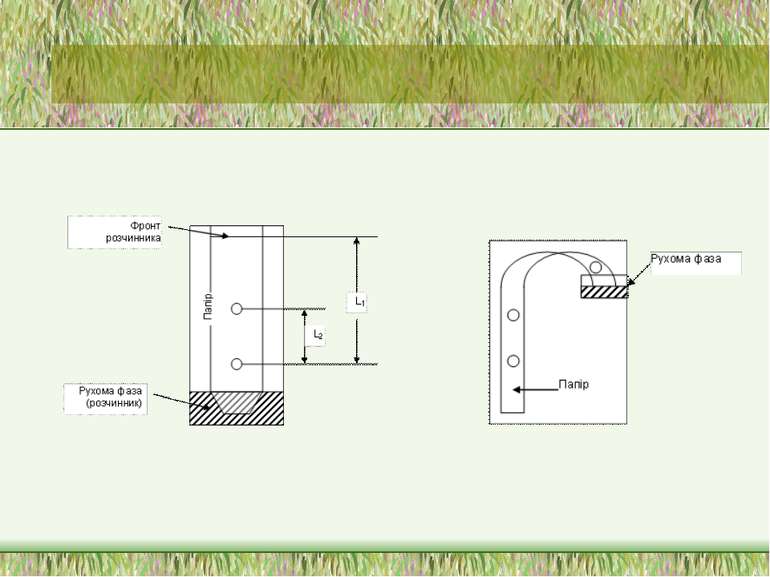
хроматографія залежно від методу розділення розрізняють: Колонкову Тонкошарову Паперову хроматографії
Схожі презентації
Категорії