Презентація на тему:
ВСТУП ДО ОБМІНУ РЕЧОВИН БІОЕНЕРГЕТИКА
Завантажити презентацію
ВСТУП ДО ОБМІНУ РЕЧОВИН БІОЕНЕРГЕТИКА
Завантажити презентаціюПрезентація по слайдам:
ВСТУП ДО ОБМІНУ РЕЧОВИН БІОЕНЕРГЕТИКА Біоенергетика, або біохімічна термодинаміка, займається досліджненням енергетичних перетворень, що супроводжують біохімічні реакції. Її головні принципи дозволяють пояснити, чому трапляються одні реакції та неможливі інші. Небіологічні системи можуть здійснювати роботу за рахунок теплової енергії, біологічні – за рахунок енергії хімічних процесів. В чому полягає важливість вивчення цієї теми для майбутніх лікарів і фармацевтів? Уся неохідна для життєдіяльності енергія повинна потрапляти в організм у вигляді палива – харчових продуктів. Знання того, як організм вивільнює цю енергію є основою для порозуміння процесів нормального харчування. Вичерпання енергетичних ресурсів призводить до голодної смерті, а запасання надлишкової енергії у вигляді харчовин речовин – до ожиріння. Корекція порушень обмінних процесів за допомогою фармацевтичних засобів також повинна враховувати енергетичні потреби організму. Всі хімічні реакції в живих клітинах підпорядковуються законам термодінамики. Перший закон : енергія не створюється з нічого та не зникає, вона лише перетворюється в еквівалентних кількостях з одного виду в інший, тобто внутрішня енергія системи залишається постійною. Самовільно хімічні процеси можуть проходити лише в одному напрямку – досягнення рівноваги, тобто максимальної ентропії. Ентропія – це міра хаосу, неупорядкованості. Другий закон: ентропія при самовільних процесах зростає. Самовільно неупорядкована система ніколи не перетвориться в упорядковану. Для цього перетворення треба витратити додаткову енергію. Напрямок перебігу реакцій можна визначити на практиці за допомогою вільної енергії системи, котру можна вимірити. G = Н - T S G - це та частина енергії системи, котру можна використовувати для виконання роботи; Т S - зв’язана енергія, котра не може бути використана на роботу; Н - ентальпія – внутрішня енергія системи (може бути вимірена експериментально) Енергетичний стан будь-якої системи виражається цією формулою якщо G < 0, то реакція екзергонічна, тобто перебігає самовільно з вивільненням енергії (ці реакції постачають клітинам енергію); якщо G > 0, то реакція ендергонічна, тобто відбувається з використанням зовнішньої енергії; якщо G = 0, - це стан рівноваги.. 1
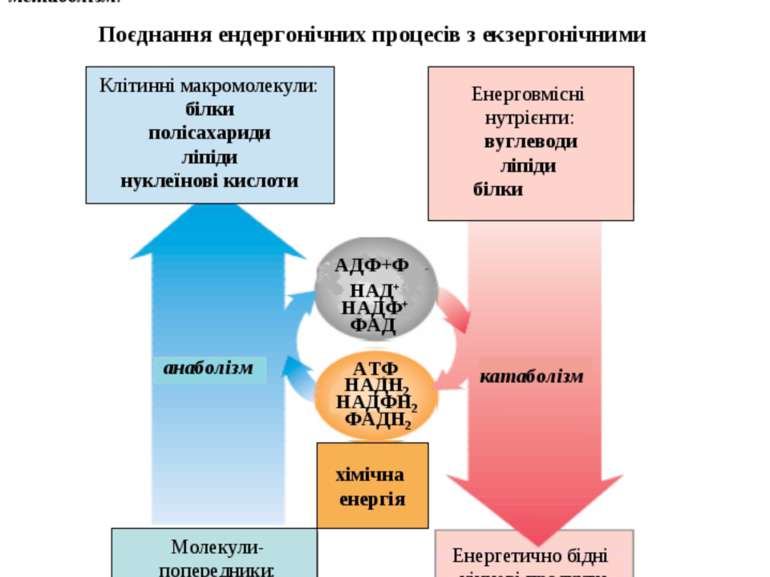
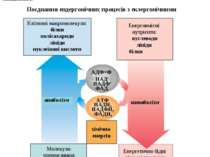
Поєднання ендергонічних процесів з екзергонічними Життєво необхідні процеси – реакції синтезу, скорочення м’язів, проведення нервових імпульсів, активний транспорт – отримують енергію шляхом хімічного поєднання з окисними реакціями, тобто існує поєднання екзергонічних реакцій з ендергонічними. До екзергонічних реакцій належать катаболічні реакції - реакції розщеплення або окиснення “паливних” молекул (енерговмісних нутрієнтів), котрі надходять в організм у складі харчових продуктів. До ендергонічних реакцій належать анаболічні реакції - реакції синтезу складних біоорганічних сполук – клітинних макромолекул. Сукупність усіх біохімічних перетворень хімічних речовин у живому організмі - це метаболізм. Катаболічні шляхи вивільнюють енергію у вигляді АТФ, а також НАДН2, НАДФН2 і ФАДН2 . Ця енергія може використовуватися в анаболічних реакціях для синтезу клітинних макромолекул із низькомолекулярних сполук. 2 АДФ+Ф АТФ
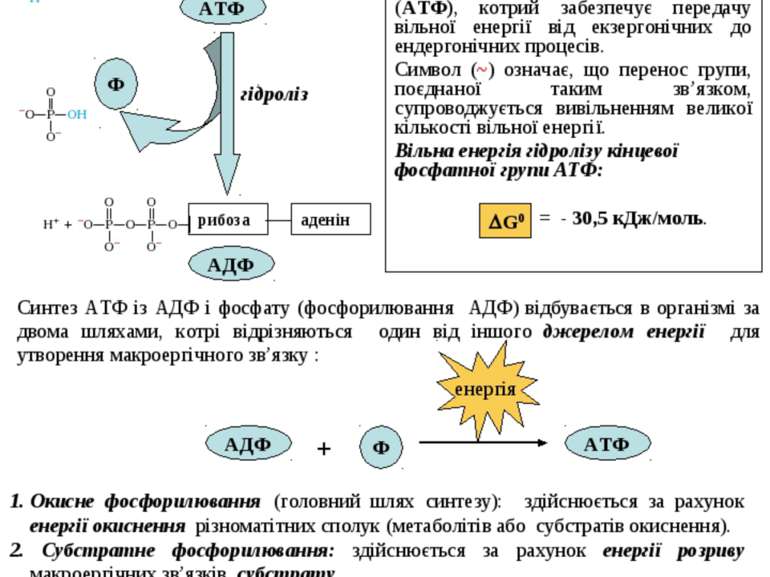
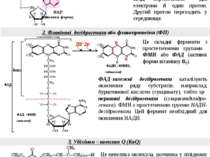
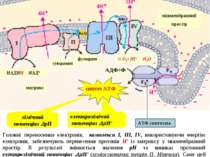
Головним макроергом у живих організмах є аденозинтрифосфат (АТФ), котрий забезпечує передачу вільної енергії від екзергонічних до ендергонічних процесів. Символ (~) означає, що перенос групи, поєднаної таким зв’язком, супроводжується вивільненням великої кількості вільної енергії. Вільна енергія гідролізу кінцевої фосфатної групи АТФ: = - 30,5 кДж/моль. Синтез АТФ із АДФ і фосфату (фосфорилювання АДФ) відбувається в організмі за двома шляхами, котрі відрізняються один від іншого джерелом енергії для утворення макроергічного зв’язку : Для поєднання цих процесів необхідний посередник. У процесі екзергонічних реакцій синтезуються сполуки з високим енергетичним потенціалом ~Е, котрі вже далі використовуються в ендергонічних реакціях. Таким шляхом трапляється передача хімічної енергії від екзергонічного до ендергонічного процесу.Сполуки з високим енергетичним потенціалом, макроергічні сполуки (~Е), – це біомолекули з високою стандартною вільною енергією перенесення кінцевої фосфатної групи. Окисне фосфорилювання (головний шлях синтезу): здійснюється за рахунок енергії окиснення різноматітних сполук (метаболітів або субстратів окиснення). 2. Субстратне фосфорилювання: здійснюється за рахунок енергії розриву макроергічних зв’язків субстрату. Крім АТФ, існують й інші макроерги. Це метаболіти вуглеводного, ліпідного та амінокислотного обмінів, а також фосфагени (креатинфосфат), котрі виступають як резервуари макроергічних зв’язків: Макроергічні сполуки: фосфоенолпіруват - 61,9 кДж/моль карбамоїлфосфат - 51, 4 кДж/моль 1,3-дифосфогліцерат - 49,3 кДж/моль креатинфосфат - 43,1 кДж/моль 3
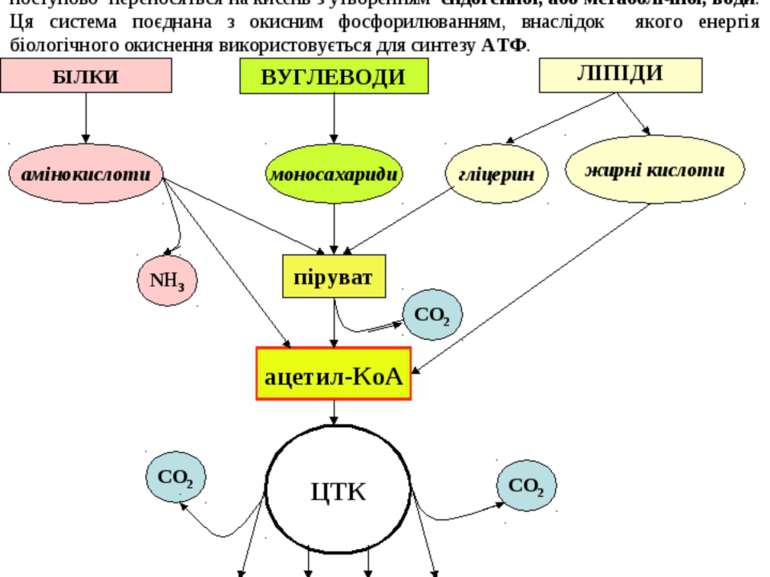
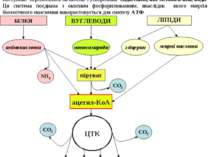
Слід розуміти, що енергія вивільняється лише з продуктів розпаду харчувальних речовин, котрі утворюються внаслідок обміну речовин. Обмін речовин в організмі людини складається з наступних послідовних стадій: 1. Надходження харчувальних речовин - білків, жирів, вуглеводів - у складі продуктів харчування. 2. Перетравлення харчувальних речовин у шлунково-кишковому тракті до простих сполук, здатних до всмоктування у слизовій оболонці кишечника. 3. Транспорт продуктів перетравлення до певних органів і тканин за допомогою крові та лімфи. 4. Внутрішньоклітинний метаболізм - проміжний обмін. 5. Виведення з організму кінцевих продуктів обміну речовин: вуглекислого газу, води, сечовини, солей амонію. Таким чином, завдяки накопиченню енергії у специфічних фосфатних зв’язках АТФ стає можливим її перенесення в живих клітинах. Але оскільки жива клітина не є рівноваговою системою, хімічна енергія може накопичуватися у макроергічних зв’язках після її вивільнення із харчувальних речовин. Стадії катаболізму біологічних молекул 1 стадія (специфічна), підготовча - макромолекули вуглеводів, білків, ліпідів розщеплюються до простих мономерів. Це гідролітична стадія або стадія перетравлення у шлунково-кишковому тракті. Реакції не супроводжуються суттєвим вивільненням енергії ( лише до 1% енергії субстратів, що вивільняється у вигляді тепла). 2 стадія (специфічна) - це ферментативні реакції розщеплення речовин, котрі утворилися в першій стадії. На другій стадії утворюється певна кількість енергії (до 20%), котра частково вивільняється у вигляді тепла, а частково акумулюється у макроергічних ( ~) зв’язках АТФ . Реакції цієї стадії відбуваються в клітинах в анаеробних умовах (у цитоплазмі та частково в мітохондріях). Головні метаболічні процеси цієї стадії: для моносахаридів - гліколіз, внаслідок котрого утворюється піруват, а із нього - ацетил ~КоА для жирних кислот - бета-окиснення, кінцевим продуктом якого є ацетил~КоА для гліцерину - перетворення в піруват, а далі - в ацетил~КоА для амінокислот і нуклеотидів – дезамінування з вивільненням аміаку та перетворенням безазотових вуглецевих скелетів в ацетил~КоА Таким чином, ацетил~КоА – кінцевий продукт другої стадії катаболізму. 4
ЛІПІДИ 3 стадія (спільна для всіх видів обміну речовин) - окиснення ацетил~КоА до кінцевих продуктів – вуглекислого газу та води. Ця стадія локалізована в клітинних енергетичних станціях - мітохондріях, і складається із двох процесів: циклу трикарбонових кислот (ЦТК), внаслідок котрого утворюється СО2, а атоми водню використовуються для відновлення коферментів НАД і ФАД. Водень - це універсальне енергетичне паливо, що використовується у дихальному ланцюгу для утворення енергії та води. система транспорту електронів в мембранах мітохондрій, в якій атоми водню поступово переносяться на кисень з утворенням ендогенної, або метаболічної, води. Ця система поєднана з окисним фосфорилюванням, внаслідок якого енергія біологічного окиснення використовується для синтезу АТФ. 5 енергия
Шляхи використання кисню в реакціях біологічного окиснення Існує чотири типи реакцій окиснення органічних субстратів , в котрих використовується кисень. 1. Оксидазний шлях (80-90% споживання кисню) Продукти – окиснений субстрат, вода та енергія. Реализується у мітохондріях у дихальному ланцюзі. 2. Оксигеназний шлях (8-12% споживання кисню): - за допомогою монооксигеназ: один атом кисню включається у субстрат, другий – у молекулу води; - за допомогою діоксигеназ: обидва атоми кисню включаються у субстрат Це вільне, непоєднане з синтезом АТФ окиснення природних або неприродних субстратів (ксенобіотиків) відбувається в мікросомах печінки, кори наднирників. Воно називається мікросомальним окисненням. Шляхом мікросомального окиснення із холестерину утворюються жовчні кислоти, стероїдні гормони, а в печінці знешкоджуються ксенобіотики, в тому числі лікарські препарати, токсини екзо- та ендогенного походження. Мікросомальні ланцюги – це короткі ланцюги транспорту протонів та електронів, джерелом котрих є відновлений НАДФ, а активатором кисню – цитохром Р-450. 3. Пероксидазний шлях: це шлях відновлення кисню до пероксиду водню за допомогою пероксидутворюючих ферментів – флавопротеїнів. За цим шляхом окиснюються біогенні аміни, амінокислоти. Перекис водню – це токсична речовина, але у фагоцитуючих клітинах, наприклад, лейкоцитах, її утворення необхідне для знешкодження патогенних бактерій. 4. Вільнорадикальне окиснення відбувається під дією активних форм кисню (АФК), що утворюються шляхом одноелектронного відновлення кисню. До АФК належать: - супероксид-аніон; - перекис водню; - гідроксильний радикал; - синглетний кисень. АФК – це дуже реакційноздатні молекули, котрі самовільно прискорюють ланцюгові реакції перекисного окиснення ліпідів (ПОЛ) та шляхом окиснення модифікують структуру інших макромолекул: білків, нуклеїнових кислот. Процеси споживання кисню активно відбуваються у мембранах, особливо у ділянках із ненасиченими жирними кислотами у складі фосфоліпідів. У номальних клітинах таким чином відбувається оновлення мембран, регулюється їхня проникність. При надмірній активації ПОЛ виникають незворотні зміни, котрі призводять до загибелі клітин. Супероксид-аніон активує утворення в тканинах NО-радикалу, котрий сприяє вазодилатації. Після перетворення останнього в пероксинітрит індукується апоптоз – запрограмована смерть клітин. За допомогою антиоксидантів клітини захищають себе від дії радикалів кисню. Антиоксидант вітамін Е обриває ланцюгову реакцію перекисного окиснення жирних кислот шляхом утворення з радикалами неактивних форм. Його синтетичний аналог – ацетат токоферолу – використовується в медицині. 6
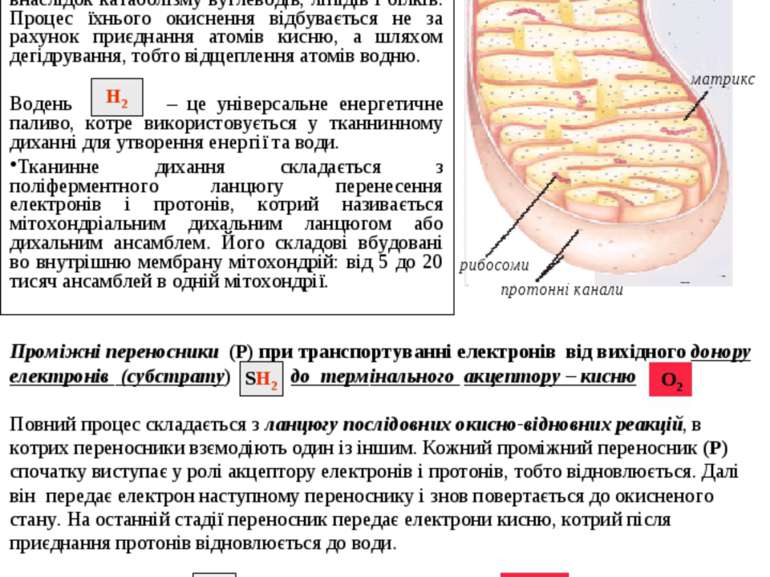
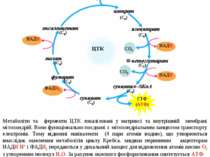
Біологічне окиснення Біологічне окиснення, що супроводжується споживанням кисню з наступним утворенням енергії та води, називається тканинним диханням. Це багатостадійний процес перенесення атомів водню (протонів і електронів) від субстарту до кисню з утворенням води та вивільненням енергії. Субстрати окиснення утворюються внаслідок катаболізму вуглеводів, ліпідів і білків. Процес їхнього окиснення відбувається не за рахунок приєднання атомів кисню, а шляхом дегідрування, тобто відщеплення атомів водню. Водень – це універсальне енергетичне паливо, котре використовується у тканнинному диханні для утворення енергії та води. Тканинне дихання складається з поліферментного ланцюгу перенесення електронів і протонів, котрий називається мітохондріальним дихальним ланцюгом або дихальним ансамблем. Його складові вбудовані во внутрішню мембрану мітохондрій: від 5 до 20 тисяч ансамблей в одній мітохондрії. Проміжні переносники (Р) при транспортуванні електронів від вихідного донору електронів (субстрату) до термінального акцептору – кисню Повний процес складається з ланцюгу послідовних окисно-відновних реакцій, в котрих переносники взємодіють один із іншим. Кожний проміжний переносник (Р) спочатку виступає у ролі акцептору електронів і протонів, тобто відновлюється. Далі він передає електрон наступному переноснику і знов повертається до окисненого стану. На останній стадії переносник передає електрони кисню, котрий після приєднання протонів відновлюється до води. SH2 О2 SH2 Н2 7 відновл. відновл. відновл. відновл. матрикс
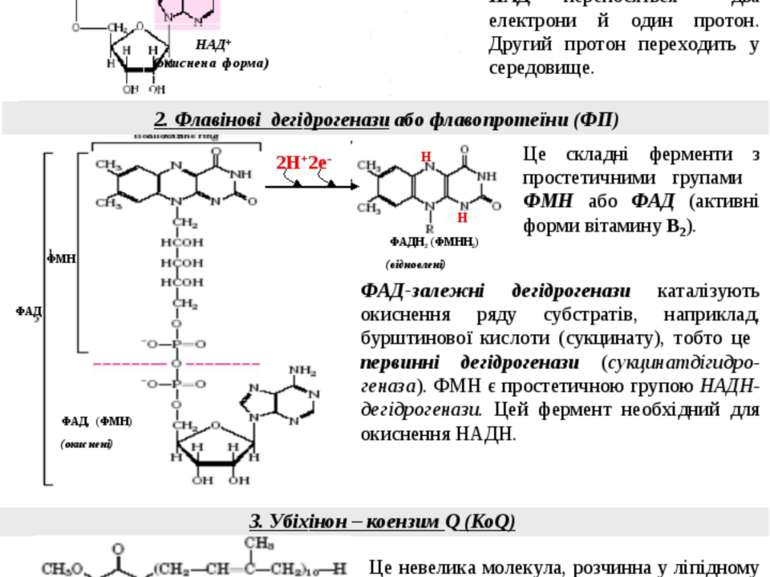
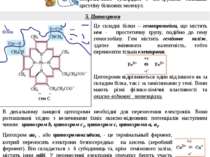
3. Убіхінон – коензим Q (КоQ) 2. Флавінові дегідрогенази або флавопротеїни (ФП) Це складні ферменти з простетичними групами ФМН або ФАД (активні форми вітамину В2). 1. НАД-залежні дегідрогенази Це невелика молекула, розчинна у ліпідному шарі мембрани завдяки неполярному боковому ланцюгу. КоQ легко переміщується всередині мембрани. Назва “убіхінон” виникла завдяки його розповсюдженості у природі. Коензим Q є колектором протонів і електронів від відновлених коферментів ФМНН2 і ФАДН2. Його відновлена форма - КоQН2. ФМН НАД+ (окиснена форма) + НАДН (відновлена форма) 2Н+2е- Н+ Н .. Це складні ферменти, котрі безпосередньо каталізують реакції окиснення субстратів (первинні дегідрогенази). НАД+, активна форма вітаміну РР, - кофермент цих ферментів. Від субстрату на НАД+ переносяться два електрони й один протон. Другий протон переходить у середовище. ФАД ФМН Н Н 2Н+2е- ФАДН2 (ФМНН2) (відновлені) ФАД-залежні дегідрогенази каталізують окиснення ряду субстратів, наприклад, бурштинової кислоти (сукцинату), тобто це первинні дегідрогенази (сукцинатдігидро-геназа). ФМН є простетичною групою НАДН-дегідрогенази. Цей фермент необхідний для окиснення НАДН. ФАД, (ФМН) (окиснені) КоQ (окиснений) КоQН2 (відновлений) 8 R
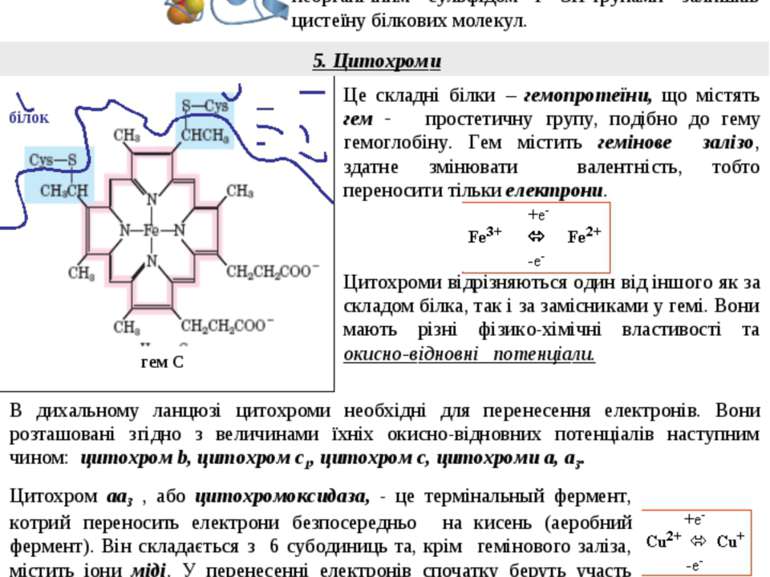
4. Залізо-сірчані білки (FeS – білки) Це складні білки, котрі містять негемінове залізо та сірку. Ці білки локалізовані в ліпідному шарі мембран. Вони можуть зворотньо окиснюватися та відновлюватися, тобто переносити електрони. Подібні окисно-відновні системи стабільні лише у складі білків. Вони можуть мати від 2 до 6 іонів заліза, котрі утворюють комплекси різного складу з неорганічним сульфідом і SH-групами залишків цистеїну білкових молекул. Усі учасники ланцюгу перенесення електронів структурово об’єднані в чотири окисно-відновні системи – мультиферменті комплекси I – IV, вбудовані у ліпідний матрикс внутрішньої мембрани мітохондрій. Процес окиснення починається з перенесення протонів і електронів з субстрата, що окиснюється, на НАД+ або ФАД. Це залежить від природи субстрату. білок 5. Цитохроми білок гем С Це складні білки – гемопротеїни, що містять гем - простетичну групу, подібно до гему гемоглобіну. Гем містить гемінове залізо, здатне змінювати валентність, тобто переносити тільки електрони. Цитохроми відрізняються один від іншого як за складом білка, так і за замісниками у гемі. Вони мають різні фізико-хімічні властивості та окисно-відновні потенціали. Цитохром аа3 , або цитохромоксидаза, - це термінальный фермент, котрий переносить електрони безпосередньо на кисень (аеробний фермент). Він складається з 6 субодиниць та, крім гемінового заліза, містить іони міді. У перенесенні електронів спочатку беруть участь іони заліза цитохромів а й а3, а далі - іон міді цитохрому а3. В дихальному ланцюзі цитохроми необхідні для перенесення електронів. Вони розташовані згідно з величинами їхніх окисно-відновних потенціалів наступним чином: цитохром b, цитохром с1, цитохром с, цитохроми а, а3. Молекулярна організація ланцюгу перенесення електронів SH2 9
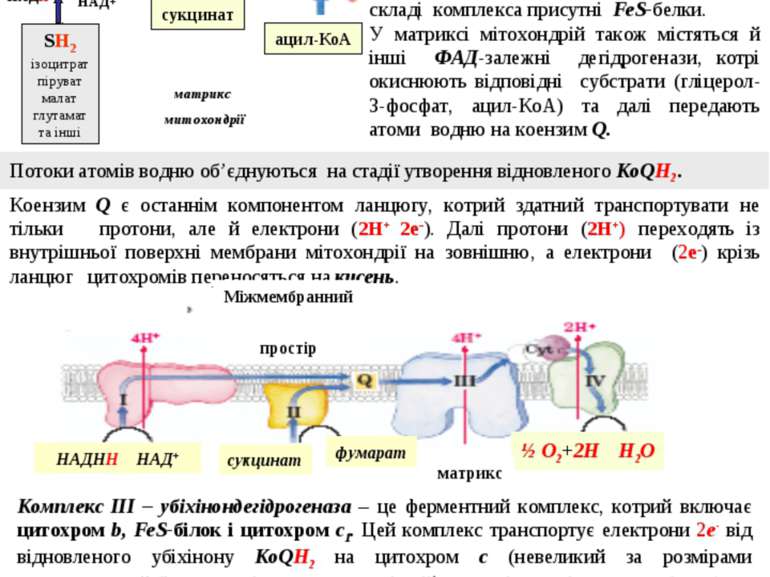
Комплекс I – НАДН-дегідрогеназа – флавопротеїн, що містить ФМН. Цей фермент окиснює НАДН і передає два атоми водню (2Н+ 2е-) на коензим Q. Комплекс також містить FeS-білки. Комплекс III – убіхінондегідрогеназа – це ферментний комплекс, котрий включає цитохром b, FeS-білок і цитохром с1. Цей комплекс транспортує електрони 2е- від відновленого убіхінону КоQН2 на цитохром с (невеликий за розмірами водорозчинний білок, що міститься на зовнішній стороні внутрішньої мембрани). НАДН сукцинат ацил-КоА мембрана гліцерол- 3-фосфат SH2 ізоцитрат піруват малат глутамат та інші У матриксі мітохондрій також містяться й інші ФАД-залежні дегідрогенази, котрі окиснюють відповідні субстрати (гліцерол-3-фосфат, ацил-КоА) та далі передають атоми водню на коензим Q. Комплекс II – сукцинатдегідрогеназа – флавопротеїн, що містить ФАД. Цей фермент окиснює сукцинат і транспортує два атоми водню (2Н+ 2е-) на коензим Q. У складі комплекса присутні FeS-белки. Коензим Q є останнім компонентом ланцюгу, котрий здатний транспортувати не тільки протони, але й електрони (2Н+ 2е-). Далі протони (2Н+) переходять із внутрішньої поверхні мембрани мітохондрії на зовнішню, а електрони (2е-) крізь ланцюг цитохромів переносяться на кисень. Комплекс IV – цитохром с-оксидаза – ферментний комплекс, що складається з цитохромів а й а3. Ці ферменти здійснюють останню стадію біологічного окиснення – відновлення електронами ( 2е- ) молекулярного кисню: 2е + ½ О2 О2- Відновлений кисень О2- реагує з вільними протонами (2Н+ ) матриксу. В результаті реакції утворюється ендогенна, або метаболічна, вода: 2Н+ + О2- Н2О Потоки атомів водню об’єднуються на стадії утворення відновленого КоQН2 . матрикс митохондрії 10 НАД+ ФАД ФАД ФАД ФМН Fe-S
Редокс-потенціал пари НАД+/НАДН = - 0,32 В, що свідчить про високу здатність віддавати електрони. Редокс-потенціал пари кисень/вода = + 0,82 В, що свідчить про високу спорідненість до електронів. При проходженні по дихальному ланцюгу пари електронів вивільняється енергія, більша частина котрої (60%) розсіюється у вигляді тепла, а інша акумулюється у макроергічниз зв’язках АТФ, а саме поглинається в реакції синтезу АТФ-окисному фосфорилюванні. Напрямок перенесення протонів і електронів визначають окисно-відновні потенціали. Для забезпечення спонтанного перенесення компоненти окисно-відновного ряду повинні розташовуватися згідно зі збільшенням величин потенціалів. энергія -0,32 +0,82 Загальна різниця редокс-потенціалів дорівнює 1,14 В. Цьому відповідає зміна вільної енергії G = - 220 кДж/моль. Ця загальна величина енергії реакції розподіляється на невеликі та більш зручні «пакети», величини котрих визначаються за різницею окисно-відновних потенціалів відповідних проміжних продуктів. Припускається, що цей розподіл на пакети забезпечує дихальному ланцюгу дивовижно високий вихід енергії, що складає приблизно 60%. 11
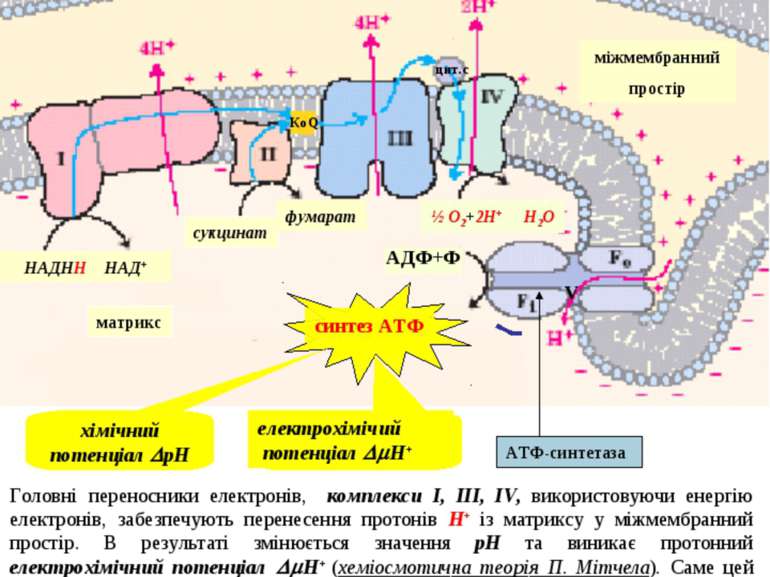
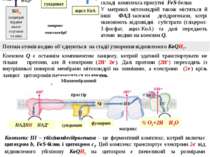
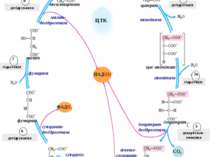
Це фосфорилювання називається окисним, тому що енергія, що необхідна для утворення макроергічного зв’язку, генерується у процесі окиснення, тобто руху протонів і електронів по мітохондріальному ланцюгу транспорту електронів. Головні переносники електронів, комплекси I, III, IV, використовуючи енергію електронів, забезпечують перенесення протонів Н+ із матриксу у міжмембранний простір. В результаті змінюється значення рН та виникає протонний електрохімічний потенціал Н+ (хеміосмотична теорія П. Мітчела). Саме цей потенціал є рушійною силою синтезу АТФ із АДФ і Ф. Синтез АТФ поєднаний зі зворотним потоком протонів Н+ із міжмембранного простіру у матрикс. Внутрішня мембрана мітохондрій непроникна для цього потоку. Завдяки спеціальній ферментній системі, що називається протонною АТФ-азою або АТФ-синтетазою (комплекс V), здійснюється зворотний рух протонів. Після досягнення певної величини Н+ активується АТФ-аза. В ній відкривається канал, крізь який протони повертаються у матрикс із міжмембранного простіру, а енергія Н+ використовується для синтезу АТФ. матрикс міжмембранний простір НАДНН НАД+ сукцинат фумарат синтез АТФ хімічний потенціал рН електрохімічий потенціал Н+ ½ О2+2Н+ Н2О АДФ+Ф АТФ-синтетаза V Механізм окисного фосфорилювання 44 цит.с КоQ
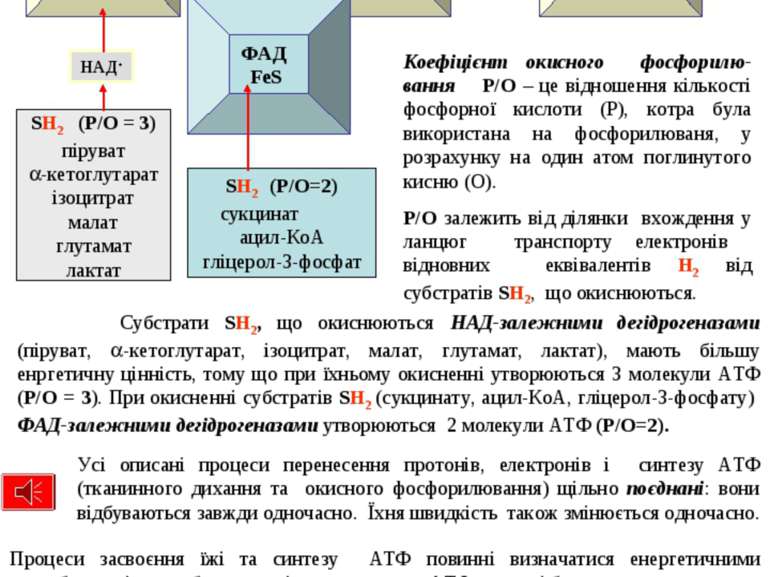
Субстрати SH2, що окиснюються НАД-залежними дегідрогеназами (піруват, -кетоглутарат, ізоцитрат, малат, глутамат, лактат), мають більшу енргетичну цінність, тому що при їхньому окисненні утворюються 3 молекули АТФ (P/O = 3). При окисненні субстратів SH2 (сукцинату, ацил-КоА, гліцерол-3-фосфату) ФАД-залежними дегідрогеназами утворюються 2 молекули АТФ (P/O=2). Кожний зі трьох комплексів (I, III, IV) забезпечує протонний градієнт, необхідний для активації АТФ-синтетази та синтезу 1 молекули АТФ. Коефіцієнт окисного фосфорилю-вання P/O – це відношення кількості фосфорної кислоти (Р), котра була використана на фосфорилюваня, у розрахунку на один атом поглинутого кисню (О). P/O залежить від ділянки вхождення у ланцюг транспорту електронів відновних еквівалентів H2 від субстратів SH2, що окиснюються. Процеси засвоєння їжі та синтезу АТФ повинні визначатися енергетичними потребами клітин, тобто синтез і використання АТФ повинні бути погодженими. При збільшенні в клітині споживання АТФ поідвищується швидкість надходження АДФ в мітохондрії, що означає зростання швидкості синтезу АТФ. Це призводить до збільшення швидкості транспорту протонів: зростає швидкість дихання. Така кореляція, а саме пришвидшення окисного фосфорилювання та дихання при підвищенні концентрації АДФ називається дихальним контролем. Дихальний контроль – це співвідношення АТФ/АДФ: при його зменшенні підвищується інтенсивність дихання. Усі описані процеси перенесення протонів, електронів і синтезу АТФ (тканинного дихання та окисного фосфорилювання) щільно поєднані: вони відбуваються завжди одночасно. Їхня швидкість також змінюється одночасно. 45
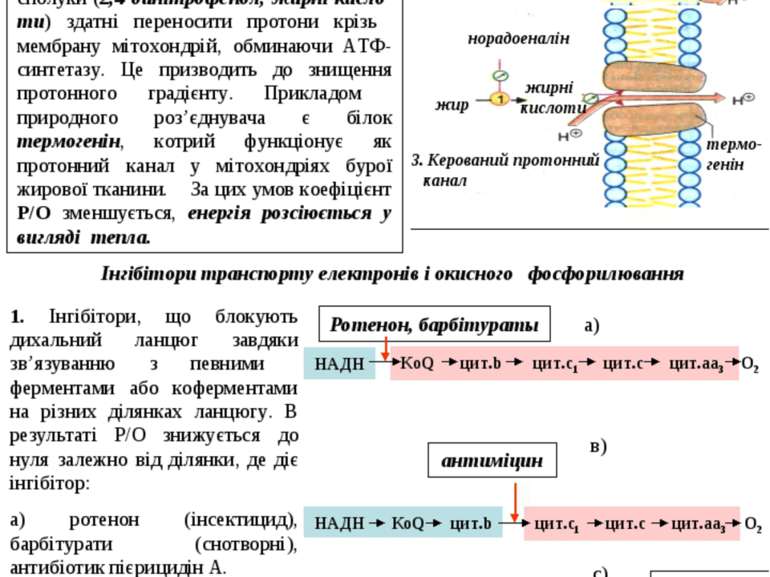
1. Інгібітори, що блокують дихальний ланцюг завдяки зв’язуванню з певними ферментами або коферментами на різних ділянках ланцюгу. В результаті Р/О знижується до нуля залежно від ділянки, де діє інгібітор: а) ротенон (інсектицид), барбітурати (снотворні), антибіотик пієрицидін А. б) антиміцин (антибіотик). в) CN-, CO, H2S. У деяких випадках поєднання фосфо-рилювання та дихання порушується, в мітохондріях виникає “неконтрольоване” дихання. Це може бути спричинено пошкодженням мембран мітохондрій, а також дією речовин, котрі функціонально роз’єднують окиснення та фосфори-лювання – роз’єднувачів. Ці ліпофільні сполуки (2,4-динітрофенол, жирні кисло-ти) здатні переносити протони крізь мембрану мітохондрій, обминаючи АТФ-синтетазу. Це призводить до знищення протонного градієнту. Прикладом природного роз’єднувача є білок термогенін, котрий функціонує як протонний канал у мітохондріях бурої жирової тканини. За цих умов коефіцієнт Р/О зменшується, енергія розсіюється у вигляді тепла. Інгібітори транспорту електронів і окисного фосфорилювання 2. Інгібітори окисного фосфорилювання: олігоміцин – антибіотик, гальмує функцію АТФ-синтетази (не діє на тканинне дихання). 46 2. Рухомі танспортери 1. Пощкодження мембрани жир жирні кислоти норадоеналін 3. Керований протонний канал термо- генін
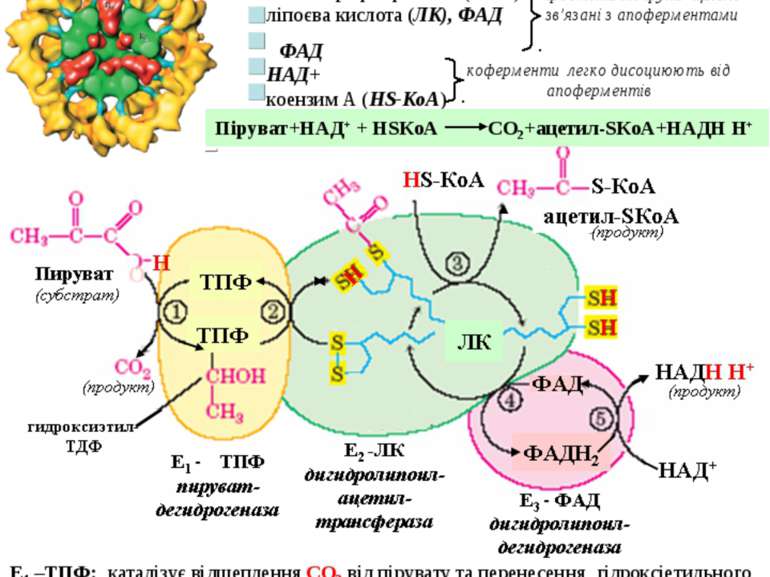
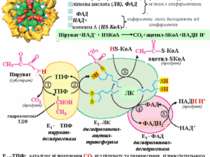
Загальні шляхи катаболізму 1. Окиснювальне декарбоксилювання пірувату Це процес відщеплення СО2 від пірувату та перенесення ацетильного залишку на коензим А з наступним утворенням ацетил-КоА. Процес здійснюється за участю мультиферментого піруватдегідрогеназного комплексу (ПДГ). тіамінпірофосфат (ТПФ) ліпоєва кислота (ЛК), ФАД ФАД НАД+ коензим А (HS-КоА) Комплекс складається з трьох ферментів (Е1 , Е2 , Е3) та п’яти кофакторів: Піруват+НАД+ + НSКоА СО2+ацетил-SКоА+НАДН Н+ О Е1 –ТПФ: каталізує відщеплення СО2 від пірувату та перенесення гідроксіетильного залишку на ТПФ. Е2 –ЛК: переносить гідроксіетильний залишок від ТПФ на простетичну групу – ЛК, При цьому дисульфідний зв’язок розривається, а ацетильний залишок і водень приєднуються до ЛК. Далі ацетильный залишок переноситься з ЛК на НSКоА з утворенням ацетил-SКоА, а ЛК відновлюється до дигідро-ЛК. Е3-ФАД каталізує дегідрування дигідро-ЛК, котра знов окиснюється. Атоми водню відновлюють ФАД. На останній стадії атоми водню переносяться на НАД+ з утворенням НАДН Н+. простетичні групи щільно зв’язані з апоферментами коферменти легко дисоциюють від апоферментів 47
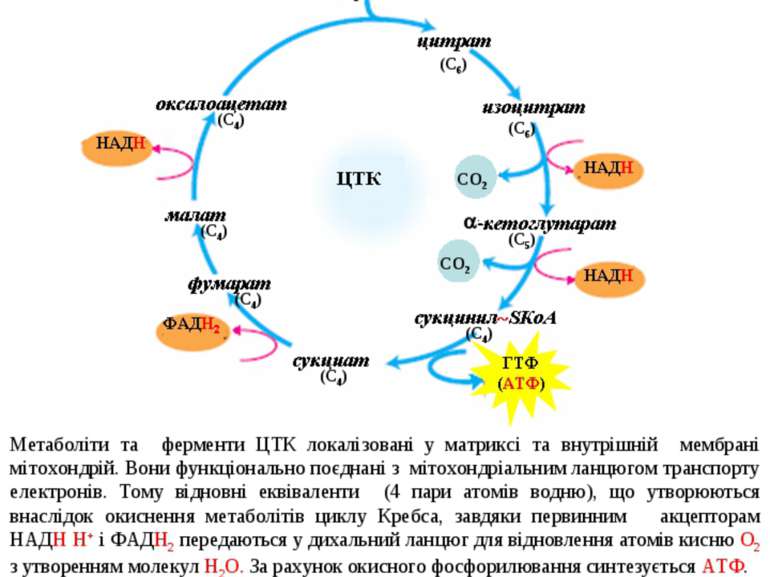
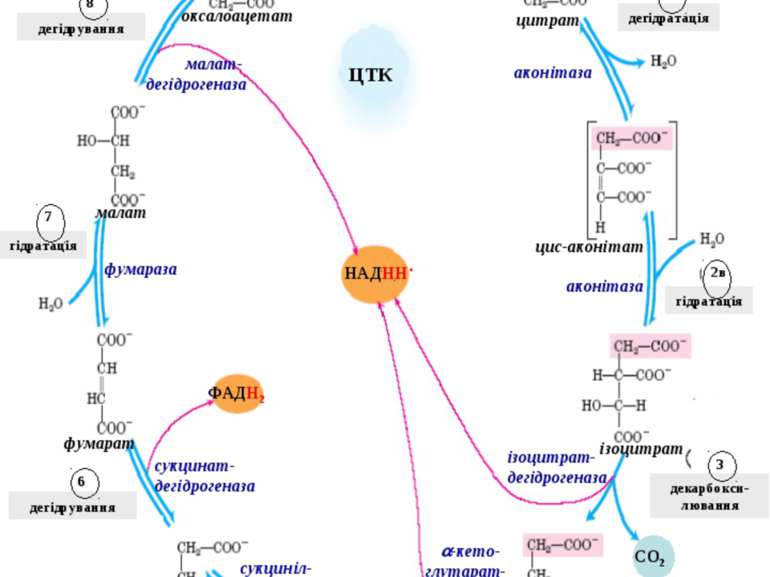
- 2. Цикл трикарбонових кислот Цикл трикарбонових кислот (цикл Кребса, цитратний цикл) – це циклічна послідовність ферментативних реакцій, внаслідок яких ацетил-SКоА, продукт катаболізму білків, ліпідів і вуглеводів, окиснюється до вуглекислого газу СО2 з утворенням атомів водню (Н), що використовуються для відновлення первиннних акцепторів ланцюгу транспорту електронів: НАД+ і ФАД. Метаболіти та ферменти ЦТК локалізовані у матриксі та внутрішній мембрані мітохондрій. Вони функціонально поєднані з мітохондріальним ланцюгом транспорту електронів. Тому відновні еквіваленти (4 пари атомів водню), що утворюються внаслідок окиснення метаболітів циклу Кребса, завдяки первинним акцепторам НАДН Н+ і ФАДН2 передаються у дихальний ланцюг для відновлення атомів кисню О2 з утворенням молекул Н2О. За рахунок окисного фосфорилювання синтезується АТФ. Ацетил-КоА – «активна оцтова кислота» (містить 2 атоми вуглецю С2), утворюється внаслідок окиснювального декарбоксилювання пірувату. В першій реакції вона конденсується з чотирьохвуглецевим оксалоацетатом (С4) з утворенням шестивуглецевого цитрату (С6). Далі від цитрату послідовно відщепляються два атоми вуглецю у вигляді двох молекул СО2,. Внаслідок цього знов регенерується оксалоацетат (С4). Таким чином, сумарне рівняння ЦТК має наступний вигляд: СН3СООН + 2Н2О 2СО2 + 8Н 48
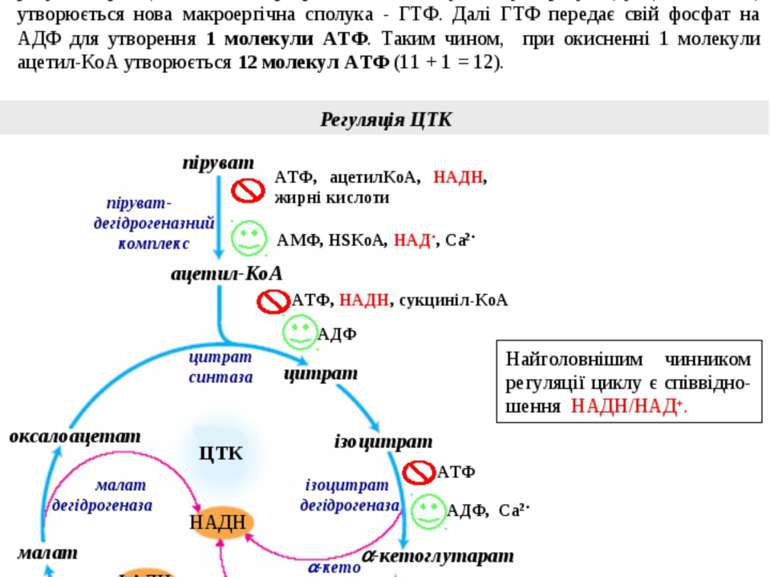
Регуляція ЦТК Енергетичний баланс ЦТК У ЦТК при окисненні однієї молекули «активного ацетату» утворюються відновні коферменти: 3 молекули НАДН+Н+ і 1 молекула ФАДН2. Далі вони окиснюються у дихальному ланцюзі. За рахунок окисного фосфорилювання утворюється по 3 молекули АТФ на кожний НАДН+Н+ і 2 молекули АТФ – на ФАДН2. Таким чином, за рахунок окисного фосфорилювання утворюється 11 молекул АТФ (3х3 + 2х1 = 11). Крім того, у циклі Кребса існує реакція субстратного фосфорилювання, в котрій за рахунок розщеплення макроергічного зв’язку субстрату (сукциніл SКоА) утворюється нова макроергічна сполука - ГТФ. Далі ГТФ передає свій фосфат на АДФ для утворення 1 молекули АТФ. Таким чином, при окисненні 1 молекули ацетил-КоА утворюється 12 молекул АТФ (11 + 1 = 12). 50
Схожі презентації
Категорії