Презентація на тему:
Етичні аспекти проведення клінічних досліджень в сучасній Україні
Завантажити презентацію
Етичні аспекти проведення клінічних досліджень в сучасній Україні
Завантажити презентаціюПрезентація по слайдам:
* Міністерство охорони здоров’я України Центральна комісія з питань етики Етичні аспекти проведення клінічних досліджень в Україні Доповідач – Голова Комісії, д.мед.н., професор В.М. Корнацький Київ – 2011
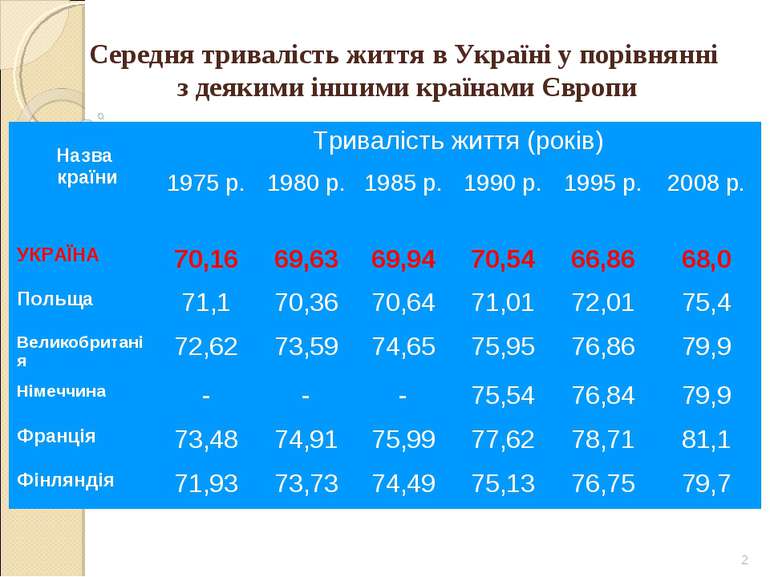
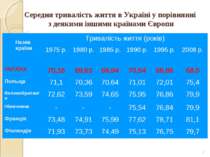
* Середня тривалість життя в Україні у порівнянні з деякими іншими країнами Європи Назва країни Тривалість життя (років) 1975 р. 1980 р. 1985 р. 1990 р. 1995 р. 2008 р. УКРАЇНА 70,16 69,63 69,94 70,54 66,86 68,0 Польща 71,1 70,36 70,64 71,01 72,01 75,4 Великобританія 72,62 73,59 74,65 75,95 76,86 79,9 Німеччина - - - 75,54 76,84 79,9 Франція 73,48 74,91 75,99 77,62 78,71 81,1 Фінляндія 71,93 73,73 74,49 75,13 76,75 79,7
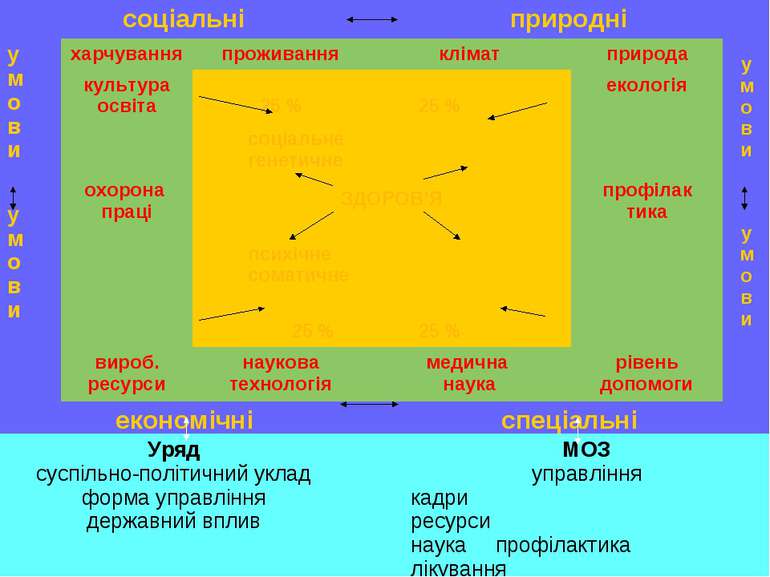
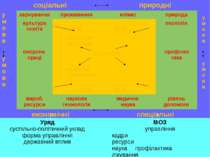
* соціальні природні у м о в и харчування проживання клімат природа у м о в и культура освіта 25 % 25 % екологія соціальне генетичне ЗДОРОВ’Я психічне соматичне у м о в и охорона праці профілак тика у м о в и 25 % 25 % вироб. ресурси наукова технологія медична наука рівень допомоги економічні спеціальні Уряд суспільно-політичний уклад форма управління державний вплив МОЗ управління кадри ресурси наука профілактика лікування здоров’я == здоров’я
покладений в основу стандартів проведення досліджень за участю людини, підкреслюючи його добровільну згоду. Передумови GCP. Етика Досліди нацистів на ув’язнених Нюрнберзький Кодекс, 1947 Всесвітня Медична Асоціація, 1964 Гельсінська декларація Рекомендацїї для лікарів по проведенню біомедичних досліджень за участю людини в якості об’єкту дослідження Переглянута: Японія (1975), Італія (1984), Гонконг (1989), ПАР (1996), Едінбург, Шотландія (2000), Сеул, Корея (2008) Генеральна асамблея ООН: Міжнародна конвенція з цивільних та політичних прав (1976) Міжнародна рада медичних товариств (CIOMS)
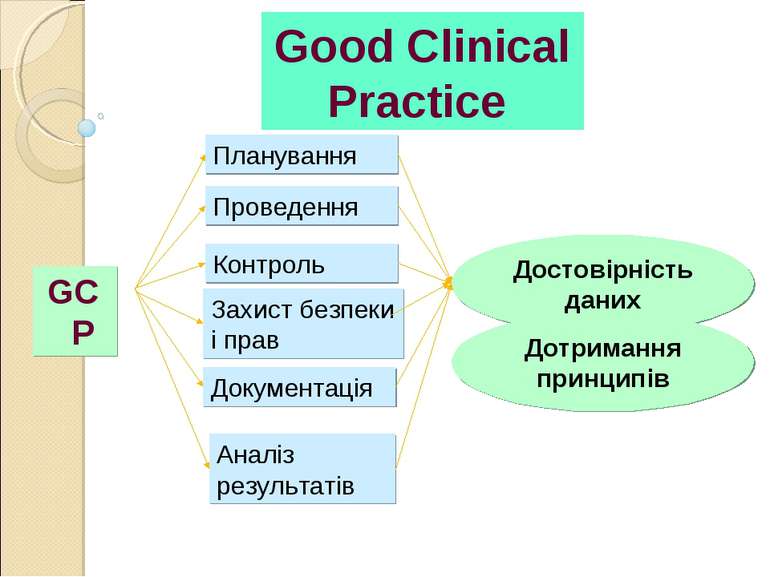
Good Clinical Practice GCP Планування Проведення Контроль Аналіз результатів Достовірність даних Документація Захист безпеки і прав Дотримання принципів
1. КД слід проводити у відповідності з етичними принципами Гельсінської декларації, правилами GCP та діючими нормативними вимогами. 2. До початку КД проведена оцінка співвідношення передбачуваного ризику та користі для досліджуваного та суспільства виправдовує. Принципи ICH GCP
3. Права, безпека та благополуччя досліджуваних важливіші за інтереси науки та суспільства. 4. Дані доклінічного та клінічного вивчення досліджуваного ЛЗ повинні бути достатніми для обгрунтування КД, яке планується. 5. КД повинно бути науково обгрунтоване, детально та чітко описане в протоколі дослідження. 6. КД слід проводити згідно протоколу, який погоджений Етичним комітетом. Принципи ICH GCP
7. Тільки кваліфікований лікар може взяти відповідальність за надання досліджуваному медичної допомоги та прийняття рішень. 8. Всі особи, які приймають участь в проведенні КД, повинні мати освіту, професійну підготовку та досвід, що відповідають виконуваним функціям. Принципи ICH GCP
9. До включення досліджуваного в КД необхідно отримати його добровільну інформовану згоду. 10. Реєстрація, обробка та зберігання інформації, отриманої в ході КД, повинні забезпечити коректне представлення, інтерпретацію та верифікацію даних. 11. Необхідно забезпечити конфіденційність як документів, так і досліджуваного та його приватного життя, що гарантовані діючими нормативними вимогами. Принципи ICH GCP
12. Виробництво та зберігання досліджуваного ЛЗ, а також використання його здійснюється у відповідності до правил Належної виробничої практики (Good Manufacturing Practice - GMP). Препарат повинен використовуватись згідно протоколу КД. 13. Повинна застосовуватись система процедур, що забезпечує якість КД в усіх його аспектах. Принципи ICH GCP
Кількість клінічних досліджень у країнах світу * США 4949 Ізраїль 294 Німеччина 1020 Бразилія 275 Канада 944 Данія 274 Франція 747 Угорщина 262 Великобританія 703 Японiя 262 Іспанія 627 Мексика 257 Італія 591 Швейцарiя 247 Бельгія 472 Індія 243 Австралія 463 Аргентина 240 Нідерланди 447 Україна 230 Польща 407 Румунія 204 Росія 344 ПАР 192 Швеція 343 Фінляндія 185 Австрія 324 Китай 171 Чехія 295 Греція 157
* Причини смертності населення Смертність (клінічна практика) Лікарські помилки 14/100 000 Побічна дія 37/100 000 Всього 51/100 000 ДТП Отруєння Нещасні випадки Смертність (клінічні дослідження) Лікарські помилки 1/100 000 Побічна дія 4/100 000 Всього 5/100 000 15/100 000 8/100 000 7/100 000
* Центральна комісія з питань етики у своїй роботі керується документами: 1. Міжнародних декларацій 1948-2008 рр. 2. Наказами від 23.09.2009 р. № 690, від 16 лютого 2009 року № 95. 3. Положенням, затвердженим наказами від 23.09.2009 р. № 690 та від 22.03.2007 р. № 142.
* 1) Етична експертиза клінічних досліджень лікарських засобів : - на етапі планування (експертиза та затвердження матеріалів клінічних досліджень); - моніторування клінічних досліджень: - не рідше одного разу на рік; - за рішенням Комісії (не рідше 1 разу в квартал). 2) Моніторування проведення клінічних досліджень лікарських засобів Центральною та локальними комісіями з питань етики. Діяльність Центральної комісії з питань етики МОЗ України здійснюється за напрямками:
* Дослідження лікарських засобів здійснюється за умови: - безпеки учасників пропонованого дослідження; - захисту прав учасників та їх страхування.
* Безпека оцінюється: - дизайном дослідження; - відповідністю бази дослідження і кваліфікацією дослідників; - категорією суб’єктів дослідження. Висновок приймається протягом, як правило, до 30-60-ти днів.
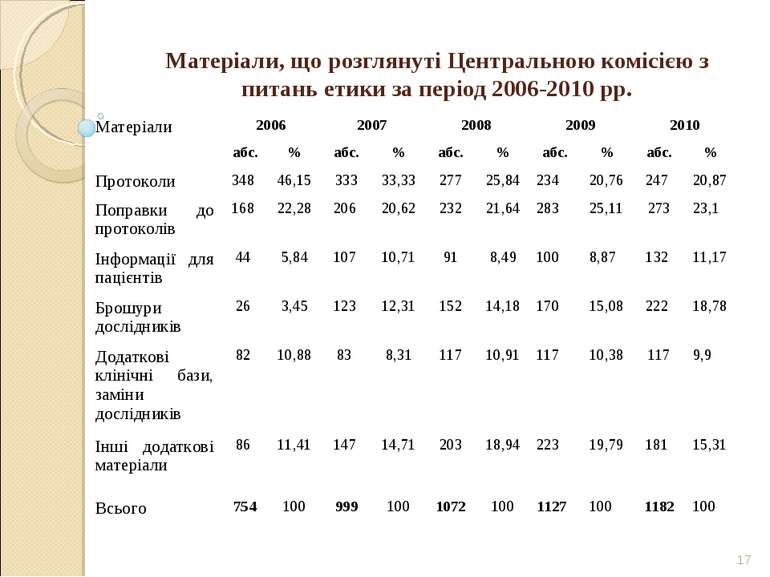
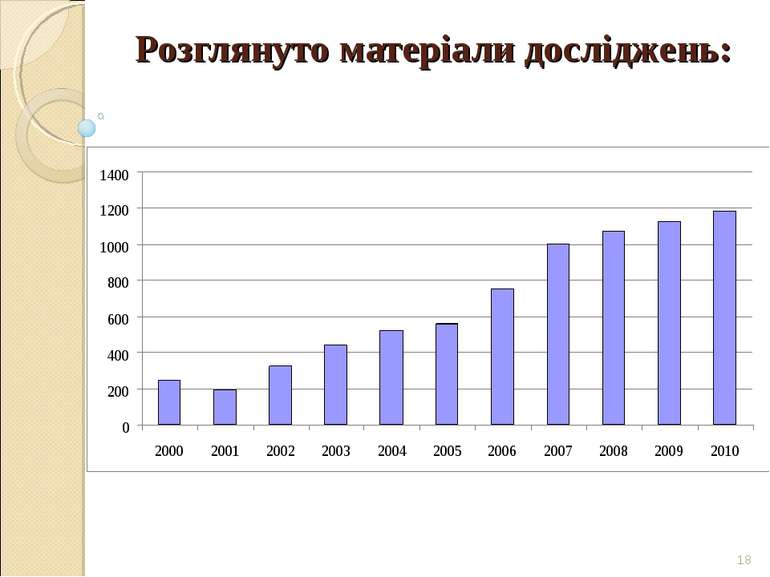
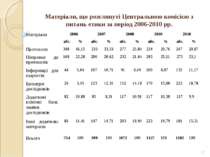
* Матеріали, що розглянуті Центральною комісією з питань етики за період 2006-2010 рр. Матеріали 2006 2007 2008 2009 2010 абс. % абс. % абс. % абс. % абс. % Протоколи 348 46,15 333 33,33 277 25,84 234 20,76 247 20,87 Поправки до протоколів 168 22,28 206 20,62 232 21,64 283 25,11 273 23,1 Інформації для пацієнтів 44 5,84 107 10,71 91 8,49 100 8,87 132 11,17 Брошури дослідників 26 3,45 123 12,31 152 14,18 170 15,08 222 18,78 Додаткові клінічні бази, заміни дослідників 82 10,88 83 8,31 117 10,91 117 10,38 117 9,9 Інші додаткові матеріали 86 11,41 147 14,71 203 18,94 223 19,79 181 15,31 Всього 754 100 999 100 1072 100 1127 100 1182 100
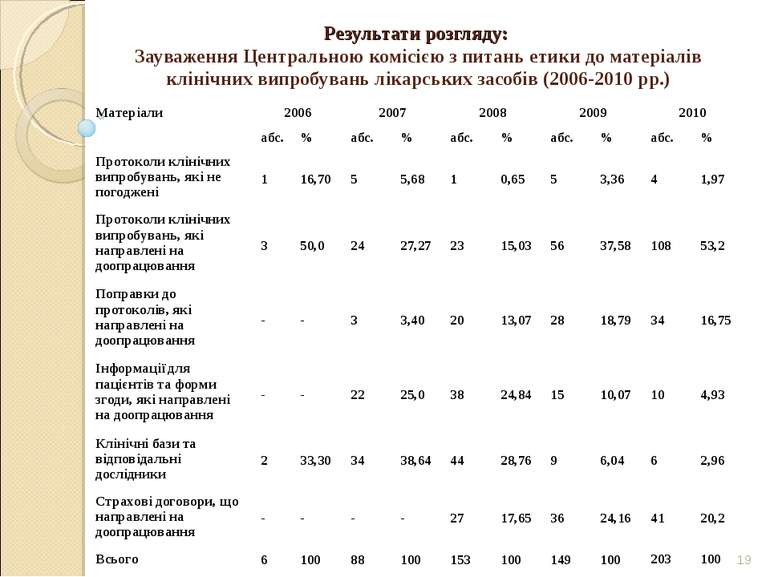
* Результати розгляду: Зауваження Центральною комісією з питань етики до матеріалів клінічних випробувань лікарських засобів (2006-2010 рр.) Матеріали 2006 2007 2008 2009 2010 абс. % абс. % абс. % абс. % абс. % Протоколи клінічних випробувань, які не погоджені 1 16,70 5 5,68 1 0,65 5 3,36 4 1,97 Протоколи клінічних випробувань, які направлені на доопрацювання 3 50,0 24 27,27 23 15,03 56 37,58 108 53,2 Поправки до протоколів, які направлені на доопрацювання - - 3 3,40 20 13,07 28 18,79 34 16,75 Інформації для пацієнтів та форми згоди, які направлені на доопрацювання - - 22 25,0 38 24,84 15 10,07 10 4,93 Клінічні бази та відповідальні дослідники 2 33,30 34 38,64 44 28,76 9 6,04 6 2,96 Страхові договори, що направлені на доопрацювання - - - - 27 17,65 36 24,16 41 20,2 Всього 6 100 88 100 153 100 149 100 203 100
* Основні зауваження розгляду: дизайн дослідження; невідповідність бази дослідження і кваліфікації дослідників; недостатня інформованість пацієнтів; невідповідність умов страхування.
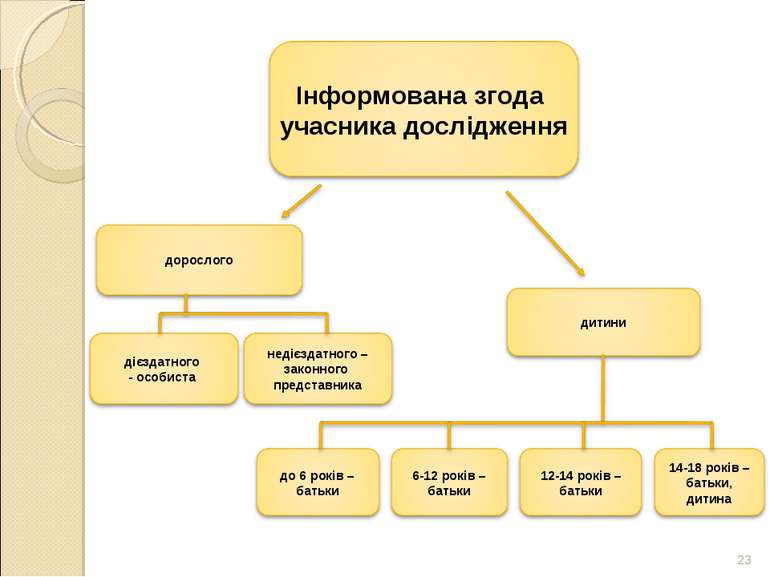
* Перелік питань, які повинні бути зазначені у письмовій інформації учасника дослідження, визначається у відповідності GCP, Наказу МОЗ від 23.09.2009 р. № 690 і рекомендаціями Центральної комісії з питань етики. Інформована згода є обов’язковою.
* Відповідальність дослідників Ст. 141 Кримінального кодексу: “Проведення клінічних випробувань лікарських засобів без письмової згоди пацієнта або його законного представника, або стосовно неповнолітнього чи недієздатного, якщо ці дії спричинили смерть або інші тяжкі наслідки – карається обмеженням волі на строк від 3 до 5 років або позбавленням волі на той самий строк”
* Базові документи та законодавче регулювання З А К О Н У К Р А Ї Н И. Основи законодавства України про охорону здоров'я. Стаття 39. Обов'язок надання медичної інформації Лікар зобов'язаний пояснити пацієнтові в доступній формі стан його здоров'я, мету запропонованих досліджень і лікувальних заходів, прогноз можливого розвитку захворювання, в тому числі наявності ризику для життя і здоров'я. Пацієнт має право знайомитися з історією своєї хвороби та іншими документами, що можуть слугувати для подальшого лікування. В особливих випадках, коли повна інформація може завдати шкоди здоров'ю пацієнта, лікар може її обмежити. В цьому разі він інформує членів сім'ї або законного представника пацієнта, враховуючи особисті інтереси хворого. Таким же чином лікар діє, коли пацієнт перебуває в непритомному стані.
* Базові документи та законодавче регулювання З А К О Н У К Р А Ї Н И. Основи законодавства України про охорону здоров'я. Стаття 43. Згода на медичне втручання. Згода об’єктивно інформованого дієздатного пацієнта необхідна для вживання методів діагностики, профілактики та лікування. Якщо останній не досяг чотирнадцятирічного віку чи був визнаний судом недієздатним або за фізичним станом не може повідомити про своє рішення, медичне втручання можливе за згодою батьків або інших законних представників пацієнта. Щодо осіб віком від чотирнадцяти до вісімнадцяти років чи визнаних судом обмежено дієздатними таке втручання проводиться за їх згодою та згодою їх батьків або інших законних представників.
* ст.8 Закону України про лікарські засоби «Пацієнт (доброволець) або його законний представник повинен отримати інформацію щодо суті та можливих наслідків випробувань, властивостей лікарського засобу, його очікуваної ефективності, ступеня ризику. Керівник клінічних випробувань лікарського засобу зобов’язаний зупинити клінічні випробування чи окремі його етапи у разі виникнення загрози здоров’ю або життю пацієнта (добровольця) у зв’язку з їх проведенням, а також за бажанням пацієнта (добровольця) або його законного працівника»
* Організаційно-методична і наукова робота: участь у проведенні: Національних Конгресів з біоетики і конференцій; створення Національного реєстру етичних комісій; видання Посібників «Основи діяльності етичних комісій» і «Нормативно-правова база проведення клін. досліджень та діяльності етичних комісій»; Розробка методичних рекомендацій “Страхування клінічних випробувань лікарських засобів в Україні»; видання монографії “Етичні аспекти досліджень лікарських засобів”; підготовлено 7 інформаційних листів; щоквартальне проведення лекцій-тренінгів щодо дотримання принципів GCP при проведенні клінічних досліджень лікарських засобів; розробка проектів нормативних документів; виконання наукової роботи (дисертаційного дослідження).
* Проблеми та пропозиції: А Акредитація та ліцензування клінічних баз на право проведення клінічних досліджень, створення реєстру дослідників із інформацією про їх фаховий рівень. Обґрунтованість плацебо-контрольованих досліджень: особливо у дітей; у недієздатних пацієнтів та при гострих формах захворювання. Законодавче визначення дієздатності учасників дослідження, а також включення в дослідження пацієнтів у невідкладних станах.
* Обґрунтованість плацебо-контрольованих досліджень. “Використання плацебо чи відсутність лікування можливе в дослідженнях, коли не існує ніякого доказового методу втручання; або Коли існують непереборні науково обґрунтовані методологічні причини необхідності застосування плацебо для визначення ефективності чи безпечності втручання і пацієнти, які отримують плацебо чи не отримують лікування, не будуть наражатись ризику нанесення серйозної чи необоротної шкоди здоров’ю. Необхідно приймати крайні міри безпечності, щоб не зловживати таким варіантом”. (Гельсінська декларація ВМА, 2008 р.)
* Б Державне регулювання умов страхування у відповідності міжнародній практиці. Страхування всіх учасників дослідження – досліджуваних та дослідників - медичних працівників. (підготовлені методичні рекомендації, які потребують законодавчо-нормативного регулювання)
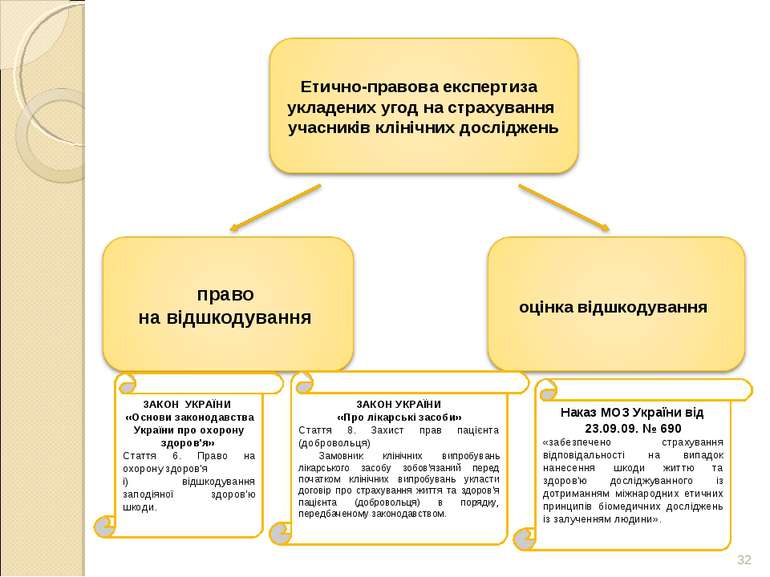
* * ЗАКОН УКРАЇНИ «Основи законодавства України про охорону здоров'я» Стаття 6. Право на охорону здоров'я і) відшкодування заподіяної здоров'ю шкоди. ЗАКОН УКРАЇНИ «Про лікарські засоби» Стаття 8. Захист прав пацієнта (добровольця) Замовник клінічних випробувань лікарського засобу зобов'язаний перед початком клінічних випробувань укласти договір про страхування життя та здоров'я пацієнта (добровольця) в порядку, передбаченому законодавством. Наказ МОЗ України від 23.09.09. № 690 «забезпечено страхування відповідальності на випадок нанесення шкоди життю та здоров'ю досліджуванного із дотриманням міжнародних етичних принципів біомедичних досліджень із залученням людини».
* Наказ МОЗ України від 23.09.2009 № 690 Страховому захисту підлягають усі пацієнти (здорові добровольці), які мають намір взяти участь у клінічних випробуваннях і які у встановленому порядку підписують інформовану згоду; Тривалість дії договору страхування не може бути меншої тривалості, ніж саме клінічне дослідження; Не допускається дострокове розірвання сторонами договору страхування без повідомлення Центральної комісії з питань етики та Центру; При встановленні розміру відшкодування на одну особу має враховуватися краща світова практика та можливі реальні витрати в інтересах досліджуваного; При укладанні договору страхування не допускається встановлення штучних перешкод та обмежень у виплаті страхового відшкодування: визначення нереальних строків повідомлення страхової компанії про страховий випадок, попереднє підтвердження його та розміру збитків рішенням суду або висновками органів охорони здоров’я, встановлення франшизи, тощо.
* Наказ МОЗ України від 23.09.2009 № 690 При виникненні будь-якої побічної реакції, що може розцінюватися як страховий випадок, відповідальний дослідник має невідкладно, але не пізніше ніж протягом 2 днів, інформувати про це спонсора (КДО). Спонсор (КДО) протягом 7 календарних днів з моменту, коли це стало відомо, повинен направити відповідне повідомлення до страхової компанії та Центральної комісії з питань етики. Досліджуваний (на власний розсуд) або законний представник, у разі його відсутності – близькі родичі можуть й ініціативно (що має бути зазначено в інформованій згоді) протягом 9 днів повідомити страхову компанію, що виступає гарантом його прав, про факт настання побічної реакції для оцінки її як страхового випадку.
* * Відсутність страхування всіх пацієнтів, яких планується залучити в дослідження. Відсутність страхування контрольної групи пацієнтів при проведенні клінічного дослідження. Страхування не всіх ризиків, пов'язаних із застосування досліджуваного препарату та медичних процедур. Наявність франшизи в договорі страхування. Необхідність корекції договору страхування при проведенні досліджень за участю недієздатних пацієнтів та пацієнтів в критичних та невідкладних станах. Відсутність інформації в договорі відносно страхової суми та страхових випадків. При збільшенні кількості досліджуваних відсутність їх страхування. Невідповідність строку дії страхового договору тривалості дослідження. Наявність умов договору страхування, що унеможливлюють виплату страхового відшкодування.
* Методичні рекомендації Центральної комісії з питань етики МОЗ України “Страхування клінічних випробувань лікарських засобів в Україні (відповідальності замовника на випадок нанесення шкоди життю та здоров'ю досліджуваним)»
* 1. Здійснювати страхування відповідальності на випадок нанесення шкоди життю та здоров’ю всіх без виключення учасників клінічних досліджень лікарських засобів не менше як на весь період їх проведення; 2. Мінімальна сума страхування не може бути меншою від суми мінімальної заробітної плати протягом 10 років; 3. Страхові виплати повинні здійснюватись у випадках будь-якої загрози здоров’ю і життю будь-якого учасника дослідження лікарського засобу на території України; 4. Умови страхування щодо порядку компенсації є невід ’ємною складовою інформованої згоди учасника дослідження
* В Організація систематичного навчання дослідників, членів етичних комісій, працівників контрактно-дослідницьких організацій і страхових компаній на базі закладів післядипломної освіти. Створення регіональних центрів тренінгів по GCP, погоджених МОЗ.
* Г Створення асоціації дослідників лікарських засобів в Україні з метою координації роботи, захисту їх прав, підвищення кваліфікації і страхування як складової Всеукраїнського лікарського товариства. Нормативне врегулювання системи оплати праці та розрахунків клінічних баз випробувань лікарських засобів.
Схожі презентації
Категорії