Презентація на тему:
АНТИБІОТИКОРЕЗИСТЕНТНІСТЬ. ПОГЛЯД НА МЕДИЧНУ ПРОБЛЕМУ
Завантажити презентацію
АНТИБІОТИКОРЕЗИСТЕНТНІСТЬ. ПОГЛЯД НА МЕДИЧНУ ПРОБЛЕМУ
Завантажити презентаціюПрезентація по слайдам:
Національний медичний університет ім. О.О. Богомольця Кафедра фармакології та клінічної фармакології Чекман І.С., професор зав. кафедри 6 квітня 2011 р. АНТИБІОТИКОРЕЗИСТЕНТНІСТЬ. ПОГЛЯД НА ПРОБЛЕМУ
* Nota Bene! “Діючи на мікроорганізми, не слід забувати, що вони мають також свої інтереси” І.П. Павлов (1849–1936), російський вчений, лауреат Нобелівської премії.
* Антибіотики Препарати природного або напівсинтетичного походження, що проявляють протимікробну дію, в основі якої лежить принцип антагонізму. Термін антибіоз (життя проти життя) запропонував Л. Пастер на основі відкриття цього явища І.І. Мечніковим.
* Вчені та антибіотики Значний внесок в розвиток вчення про антибіотики внесли зарубіжні та українські вчені: О. Флемінг, Х. Флорі, Е. Чейн, Г.Гаузе, Р.Дюбо, Н. Фліпін, Д. Клеменс, З. Єрмольєва, В. Деркач, С. Ваксман, С. Навашин, О. Чорномордик, В. Тульчинська.
* Резолюція ВООЗ Основною причиною зменшення ефективності протимікробних препаратів (сульфаніламіди, протималярійні, протисифілітичні, протигрибкові, протилямбліозні, протитрихоматозні, антибіотики та інші) – резистентність мікроорганізмів. Боротьба з резистентністю мікробів до протимікробних препаратів – головне завдання 2011 року.
Антибоітикорезистентність Глобальна проблема сучасної медичної науки і практики, що сприяє значному зниженню ефективності лікування інфекційних захворювань!
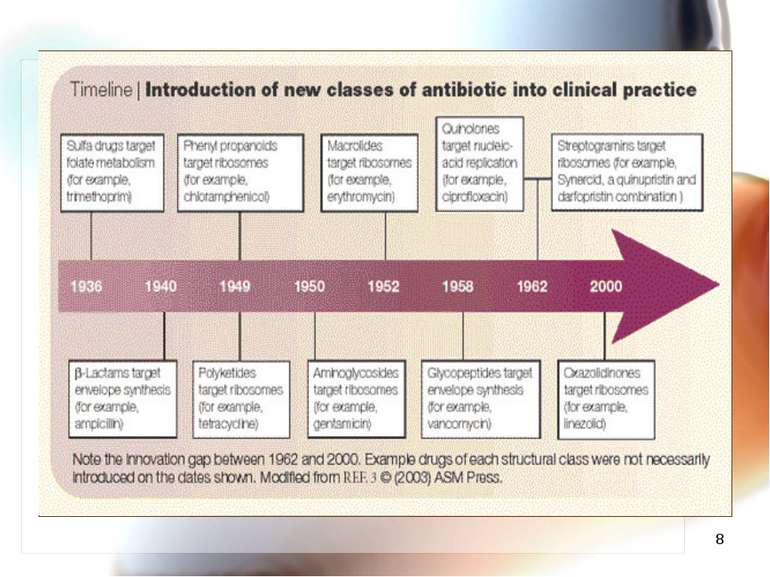
* Епоха антибіотиків. Історичний аспект. Відкриття антибіотиків у 40-50 роках ХХ століття та широке застосування даних препаратів у медичній практиці сприяло значному покращенню лікування хворих з інфекційними захворюваннями. Досягнення були значними!
* Інфекційні захворювання переможені - вважали 50 років тому 1955-1960 роки ХХ століття вчені світу вважали: “Час закрити книгу інфекційних захворювань”. 1975 р. інфекційні захворювання не були в десятці причин смерті. Наростаюча резистентність до антибіотиків ігнорувалась. 1995 р. інфекційні хвороби 3-ті за частотою причин смертності. Інфекційні захворювання не переможені! На жаль!
* Негативні аспекти антибіотикотерапії 1. Алергічні реакції 2. Токсичні реакції (подразнююча дія на тканини, флебіти, ураження слухового нерва, гепатити). 3. Імунобіологічні реакції (кандидоз, дисбактеріоз). 4. Тератогенна дія, ембріотоксичність. 5. Розвиток стійких штамів мікроорганізмів – найбільш важливий негативний аспект антибіотикотерапії.
* Раціональна фармакотерапія: 1. Вибір найбільш активного і найменш токсичного препарату та етіотропність забезпечують протимікробний ефект при захворюваннях, викликаних мікроорганізмами, які чутливі до антибіотика. 2.Резистентності мікроорганізмів до антибіотика. 3. Своєчасність призначення антибіотика, вибір оптимального способу введення, дозовий режим антибіотика забезпечує постійну терапевтичну концентрацію медикаменту в органах і тканинах організму та ефективність антибіотикотерапії.
* Раціональна фармакотерапія: 4.Особливості фармакокінетики та фармакодинаміки антибіотиків. Встановлення тривалості лікування. Моніторинг і профілактика негативних побічних реакцій. 5. Переносимість і можливість виникнення побічних ефектів: безпечність антибіотикотерапії. Контроль за виліковуванням. Вирішення питання доцільності комбінованої антибіотикотерапії.
* Раціональна фармакотерапія: 6. При застосуванні антибіотиків необхідно враховувати вік хворого, функціональні особливості організму, особливо таких органів як печінка, нирки, кишечник, серцево-судинна система, органи дихання. 7. Організм ↔ антибіотик ↔ ефективність ↔ безпечність ↔ ціна (фармекономіка). Антибіотикорезистентність не переможено!
* Профілактика побічних реакцій 1. Обстеження хворого (медикаментозний анамнез). 2. Шлях введення антибіотику, доза та лікарська форма. 3. Застосування препаратів, які зменшують розвиток побічних ефектів (вітамінних препаратів, пробіотиків, препаратів системної ензимотерапії та інших). 4. Розробка раціональних схем антибіотикотерапії. Проблему антибіотикорезистенності не вирішено!
* Причини антибіотикорезистентності Загальнобіологічні – фармакологічні. Медичні. Соціальні. Економічні. Біоетичні.
* безрецептурний ліберальний відпуск антибіотиків надмірне і неналежне їх призначення необґрунтоване застосування при різних інфекціях одного й того ж популярного “модного” препарату необґрунтована хірургічна перед- та післяопераційна профілактика Поширення резистентних штамів у лікарні внаслідок недостатності гігієни Медичні причини зростання резистентності до антибіотиків
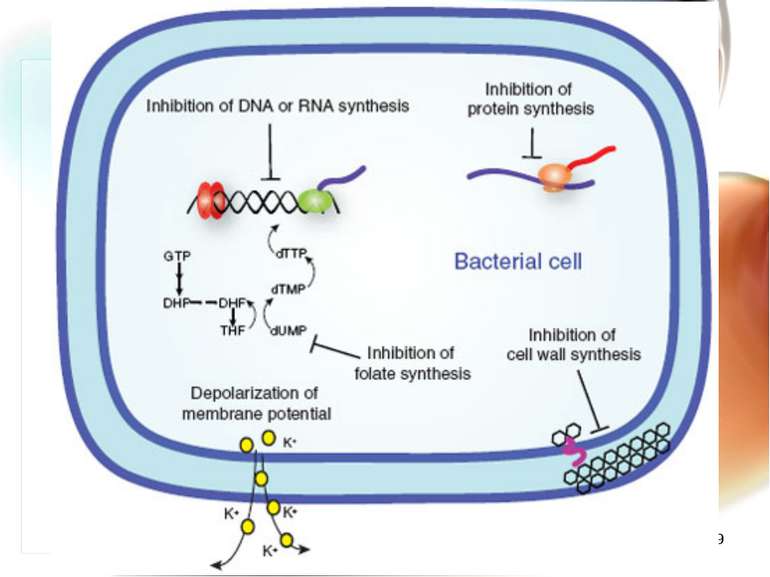
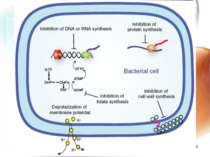
* Механізми розвитку антибіотикорезистентності 1. Мікроорганізм швидко змінює обмін речовин при яких антибіотик не має “своєї” мішені (наприклад, рибосома). 2. Змінюється генетична структура ДНК, РНК мікроорганізму, з якими антибіотик не може взаємодіяти. 3. Розвиваються морфологічно нові мікроорганізми зі своєрідним обміном речовин: синтезують нові ферменти, які руйнують антибіотики. Сили не рівні – перемагає мікроорганізм. Розвивається антибіотикорезистенність!
Резистентність мікроорганізмів Стійкість основних збудників інфекційних захворювань (коки, палички, спірохети та інші) складає від 20 до 100 %. Сидоренко С.В. І співавтори, 2008 р. Російська Федерація
Мікроорганізми новонароджених 96 % виділених штамів мікроорганізмів новонароджених (Enterobacter та Proteus) проявляють одночасну стійкість до 7-16 антибіотиків. Авдєєва Л.В. І співавтори, 2008 р. Інститут мікробіології та вірусології НАН України.
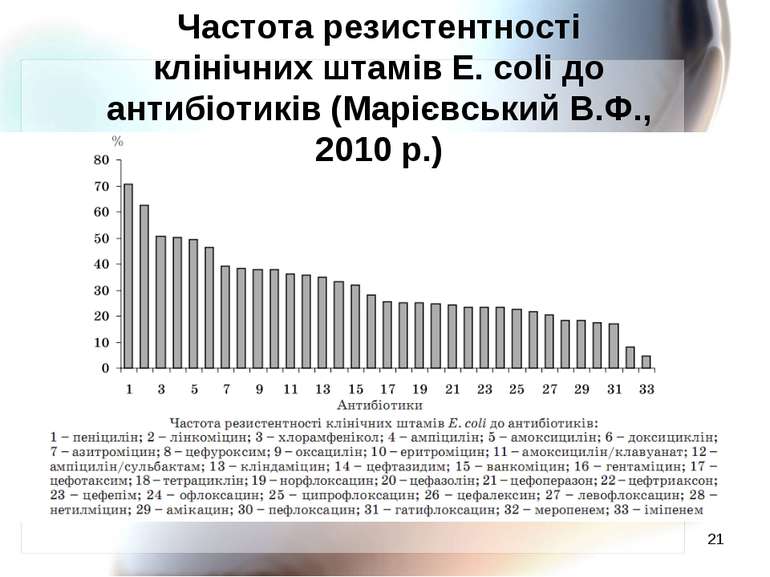
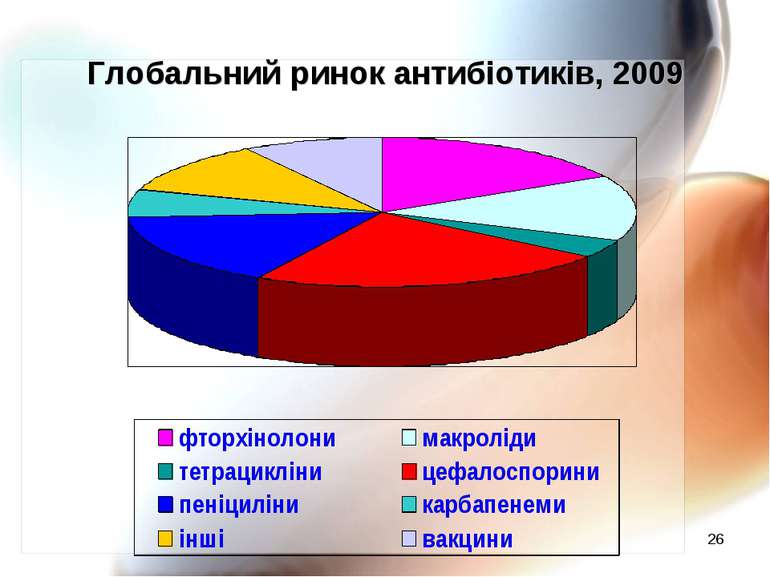
* Частота резистентності клінічних штамів E. coli до антибіотиків (Марієвський В.Ф., 2010 р.)
* Причини призначення антибіотиків лікарями не за показаннями Вплив реклами. Недостатня підготовка лікаря. Надмірні вимоги пацієнта до лікування. Hendeles L., 1996
* світова статистика майже у 50 % випадків призначення антибіотиків є безпідставним: вони не потрібні даному пацієнтові, або ж використовуються в результаті невірно поставленого діагнозу, або ж всупереч існуючим рекомендаціям Приклади – безпідставне призначення антибіотиків при риніті, ларингіті, гострому неускладненому бронхіті
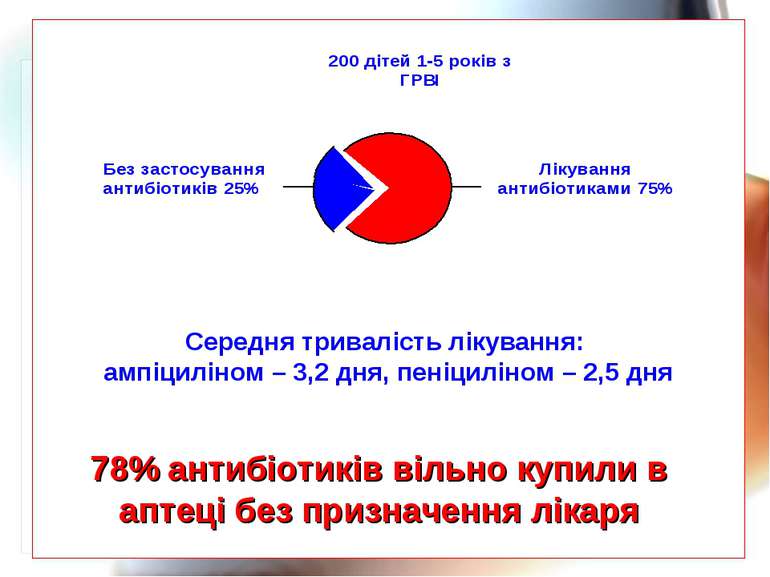
* 78% антибіотиків вільно купили в аптеці без призначення лікаря Середня тривалість лікування: ампіциліном – 3,2 дня, пеніциліном – 2,5 дня
* Обсяги продажу ЛЗ (листопад 2007 – жовтень 2008) – всього 441,1 млрд $ Частка антибіотиків у світових продажах (%) Америка Європа Японія Решта світу Україна у 2006 р. витрати на медикаменти - 8 млрд $ (34 % всіх витрат на охорону здоров’я)
* Комплаєнс 20–50% пацієнтів не використовують антибіотики так, як призначив лікар Кількість прийомів ЛЗ протягом доби: при одноразовому прийомі препарату комплаєнс досягається у 80 % випадків, при дворазовому — у 68 %, при триразовому — у 38 % випадків
* Соціальні причини зростання резистентності до антибіотиків неосвіченість суспільства у питаннях застосування антибіотиків застосування антибіотиків у сільському господарстві, у домашніх умовах (продукти, напої, косметика тощо) постійна глобальна міграція людей (також птахів), а з ними – резистентних бактерій одна з причин антибіотикорезистентності – використання антибіотиків як стимуляторів росту та харчових добавок на фермерських господарствах…
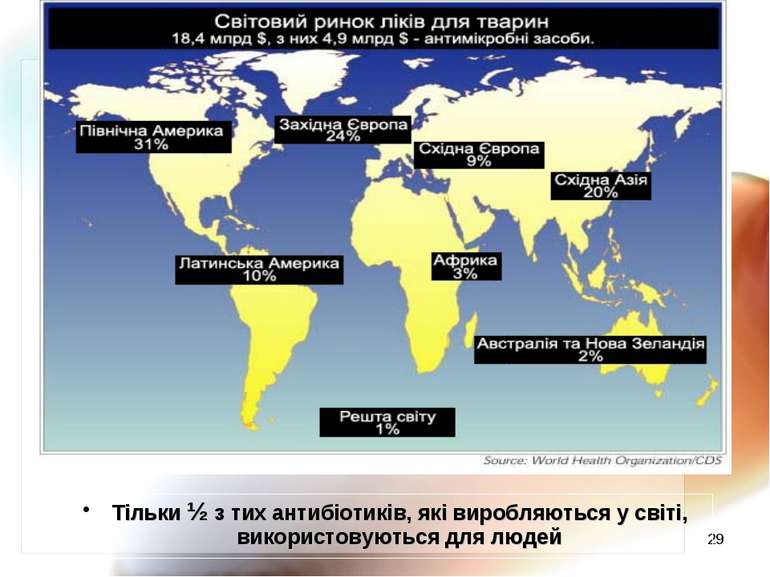
* Антибіотики, які використовуються у ветеринарії Amoxicillin, Amprolium, Avoparcin, Baquiloprim, Cephalexin, Chlortetracycline, Clavulanic acid, Clindamycin, Cypermethrin, Cyromazine, Diclazuril, Dihydrostreptomycin, Emamectin benzoate, Enrofloxacin, Fenbendazole, Flavomycin, florfenicol, Ivermectin, Lasalocid Na, lincomycin, Maduramicin, Neomycin, Nicarbazin, Nitroxynil, Oxolinic acid, Oxytetracycline, Procaine benzylpencillin, Salinomycin Na, Sarafloxicin, Sulphadiazine, Tetracycline, tilmicosin, Triclabendazole, Trimethoprim (Boxall et al, 2003)
* Забруднення довкілля антибіотиками виділяються у довкілля у незміненому вигляді: 75 % тетрациклінів, які використовують фермери у тварин, 80 % амоксициліну – із сечею, цефтріаксон та цефтазидим – з потом
* РЕГУЛЯТОРНІ ЗАХОДИ Європейський союз та більшість розвинених країн світу ввели строгі обмеження щодо використання антибіотиків у фермерських господарствах в якості харчових добавок для здорових тварин
* Шляхи подолання негативних аспектів антибіотикотерапії – резистентності мікроорганізмів! Розробка раціональної антибіотикотерапії. Профілактика побічних реакцій. Розробка комбінованих форм АБ. Синтез нових антибіотиків. Синтез принципово нових сполук з протимікробною дією. Препарати нанометалів (срібло, мідь). Створення нанокомпозитів металів з протимікробною дією.
* Комбіновані препарати Ампіокс (ампіцилін+оксацилін), (УКР) Клонаком (амоксицилін+клоксацилін) Амоксиклав(Амоксицилін+клавулан). Клавулан пригнічує активність бета-лактамаз, що призводить до потенціювання дії антибіотика і зменшення його розщеплення цим ферментом. Сулацилін (ампіцилін+сульбактам-інгібітор беталактамаз. Тазоцин (піперацилін+тазобактам- інгібітор бета-лактамази). Антибіотикорезистентність залишилась!
* Синтез нових антибіотиків Синтез антибіотиків другого, третього, четвертого і п’ятого поколінь, а також нових хімічних груп (тетрацикліни, цефалоспорини, макроліди, аміноглікозиди, лінкоміцини, фторхінолони, монобактами, карбапенеми, поліміксини та інші). Антибіотикорезистентність розвивалась, на жаль, і до нових антибіотиків.
Бактеріофаги та пробіотики Одночасне застосування з антибіотиками бактеоріофагів та пробіотиків підвищує протимікробну активність антибіотиків, зменшуючи розвиток стійких штамів. Салманов А.Г., Марієвський В.Ф., Доан С.І., 2010, Інститут епідеміології та інфекційних захворювань НАМН України.
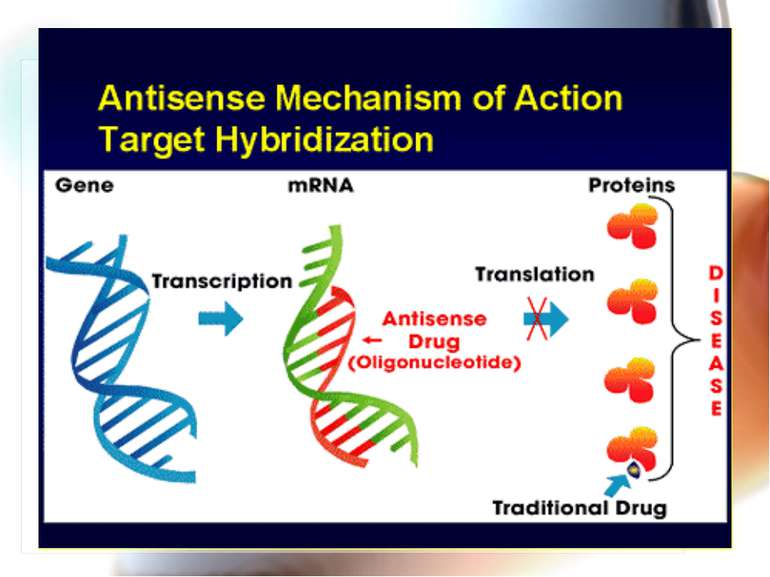
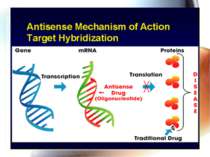
* Antisense technology (антисенс-ланцюг – ланцюг дволанцюгової нуклеїнової кислоти) – антисенсова технологія дозволяє створювати нові антибактеріальні препарати, але їх немає у практичного лікаря. Антисенсові агенти Комплементарні фрагменти ДНК, пептиди нуклеїнових кислот, олігонуклеотиди, що зв’язуються з генами, відповідальними за вірулентність, і попереджують їх транскрипцію Перевага – подібні антимікробні агенти, на відміну від класичних антибіотиків, високоселективно блокують специфічний протеїн – мішень, зменшуючи вірулентність, але не впливають на ріст мікроорганізмів, що сповільнює розвиток резистентості
* Розшифрування універсального механизму РНК-інтерференції (RNA interference)(пригнічення експресії генів двохланцюговою РНК) - «генної цензури» ВІдключення за допомогою двохланцюгової РНК експресії генів, що призводить до пригнічення синтезу білків, які ними кодуються. Молекули двохланцюгової РНК при попаданні у клітину дають сигнал до початку роботи групи ферментів, які спочатку ріжуть ДНК на короткі фрагменти, потім розплітають їх на окремі нитки і за їх допомогою видаляють з матричної РНК ділянки, які підлягають ліквідуванню. Створення антивірусних засобів, антибактеріальних агентів. Нобелівська премія 2006 р. з фізіології і медицини — Ендрю Файр з Медичної школи Стенфордського університету (зліва) та Крейг Мелло з Медичної школи Массачусетського університету
* Вирішення проблеми антибіотикорезистентності має розвиватися по таким напрямкам: Поглиблене вивчення фізіологічних і біохімічних властивостей мікроорганізмів з метою знайти їх „Ахілесову п’яту” та розробку препаратів, які впливають на ці механізми функціонування збудників інфекційних захворювань. Синтез протимікробних препаратів нових хімічних груп, які суттєво відрізняються від відомих антибіотиків. 3. Розробка нанопрепаратів срібла, міді, вісмуту та інших металів. Згідно дослідженням вітчизняних і зарубіжних вчених препарати нанометалів проявляють виражену протимікробну дію, в тому числі ефективні і до штамів, резистентних до антибіотиків.
* Кількість друкованих робіт з нанометалів по даним Інтернет на 1.02.2011 р. Наноматеріали Всього статей Статті до 2006р. Статті 2006-2011 р. Нанозолото (Nanogold) 1418 743 715 Наносрібло (Nanosilver) 417 191 226 Нанозалізо (Nanoiron) 372 192 180 Наномідь (Nanocopper) 220 108 112 Наноцинк (Nanozinc) 369 122 247 Нанотехнології вісмуту (Nanobismuth) 49 10 39
* Національний медичний університет – дослідження з нанонауки З 1.01.2008 за ініціативи академіка Б.Є. Патона та академіка В.Ф. Москаленка вперше в Україні створена спільна лабораторія Інституту електро-зварювання ім. Є.О.Патона та Національного медичного університету ім. О.О. Богомольця з нанофармакології. При НМУ рішенням Вченої Ради у 2010 році створений Інститут нанофармакології.
* У спільній лабораторії виконано: 1. Розроблена технологія отримання наночастинок срібла, міді, їх композитів, а також нанозаліза, наноцирконію, наноалю-мінію інших металів, нановуглецю. 2. Встановлено, що наночастинки срібла, міді, та іх композити, проявляють більш виражену протимікробну дію ніж ці метали звичайних розмірів (Інститут епідеміології та інфекційних хвороб).
* У спільній лабораторії виконано: 3. Розроблена технологія отримання лікарських форм: мазь, гель, емульсія наночастинок срібла, міді, їх композитів (Львівський національний медичний університет, доц. Білоус С.Б.). 4. Розроблена технологія отримання супозиторій наночастинок срібла (Харківський медичний університет, проф. Звягінцева Т.В., доц. Сирова Г.О.). 5. Встановлено, що у цих лікарських формах наночастинки срібла, міді та їх композити проявляють більш виражену протимікробну дію, ніж ці метали звичайних розмірів (інститут епідеміології та інфекційних хвороб).
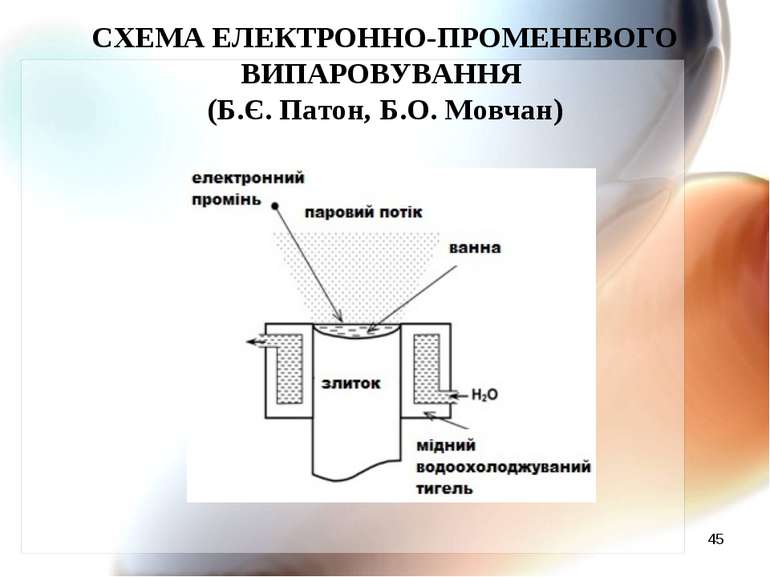
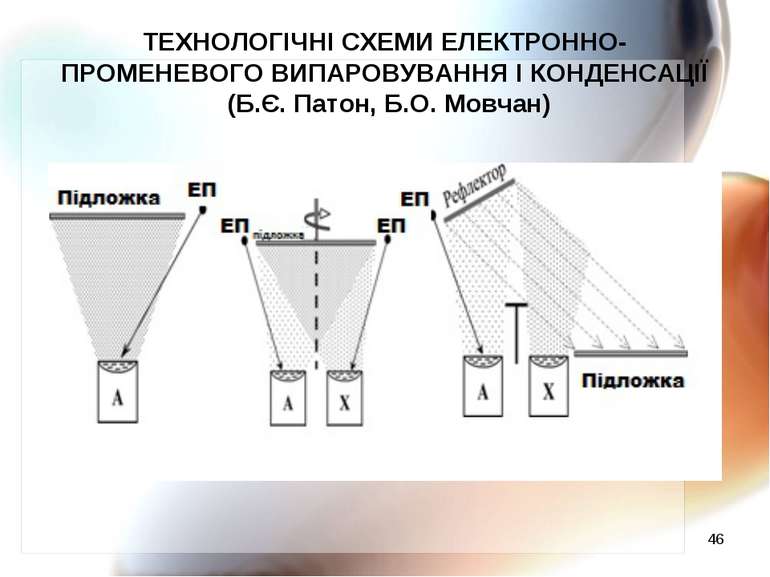
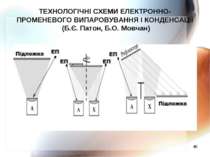
* ТЕХНОЛОГІЧНІ СХЕМИ ЕЛЕКТРОННО-ПРОМЕНЕВОГО ВИПАРОВУВАННЯ І КОНДЕНСАЦІЇ (Б.Є. Патон, Б.О. Мовчан)
* Бактерицидна дія суспензії наночастинок CuO та Cu2O, отриманих ЕПТ, стандартного порошку CuO і розчину CuSO4 на St. aureus (Інститут епідеміології та інфекційних захворювань, В.Ф. Марієвський) “-” відсутність колоній St. aureus; 106 – кількість колоній Суспензії наночастин CuO та Cu2O затримували ріст мікроорганізмів в розведенні 1:16 та 1:8, розчин CuSO4 – в розведенні 1:4, а звичайний CuO – в розведенні 1:2. Розведення 1:2 1:4 1:8 1:16 1:32 CuO нано - - - 102 105 Cu2O нано - - 102 105 106 CuSO4 нано - - 105 106 106 CuO стандарт - 103 105 106 106 Контроль 106 106 106 106 106
* Бактерицидна дія суспензії наночастинок CuO та Cu2O, отриманих ЕПТ, стандартного порошку CuO і розчину CuSO4 на E. coli (Інститут епідеміології та інфекційних захворювань, В.Ф. Марієвський) “-” відсутність колоній E. coli; 106 – кількість колоній Суспензії наночастин CuO та Cu2O затримували ріст мікроорганізмів в розведенні 1:16 та 1:8, розчин CuSO4 – в розведенні 1:4, а звичайний CuO – в розведенні 1:2. Розведення 1:2 1:4 1:8 1:16 1:32 CuO нано - - - 103 106 Cu2O нано - - 102 106 106 CuSO4 нано - - 105 106 106 CuO стандарт - 103 103 106 106 Контроль 106 106 106 106 106
* Колоїдний розчин наносрібла (аспірант НМУ А.О. Прискока) Встановлена гостра токсичність та досліджена генотоксичність колоїдного розчину наносрібла. Проведені дослідження комплексоутворення наносрібла з компонетом біомембрани – амінокислотами.
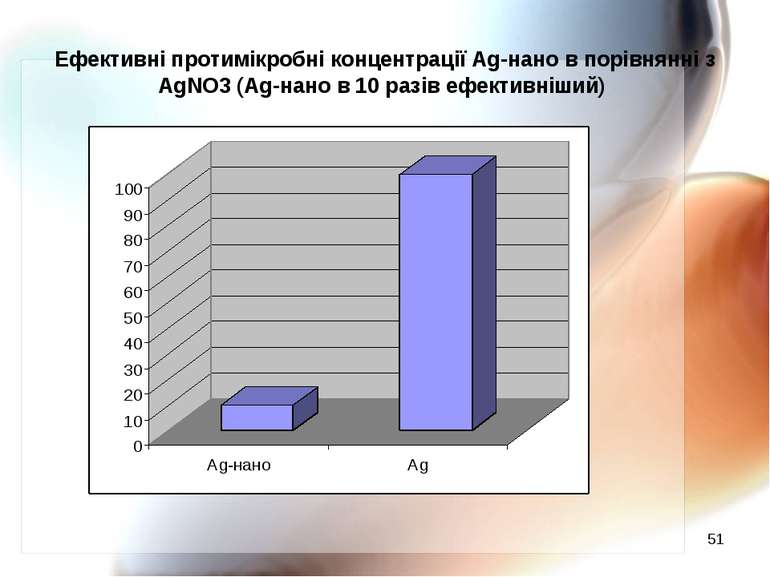
* Ефективні протимікробні концентрації Ag-нано в порівнянні з AgNO3 (Ag-нано в 10 разів ефективніший)
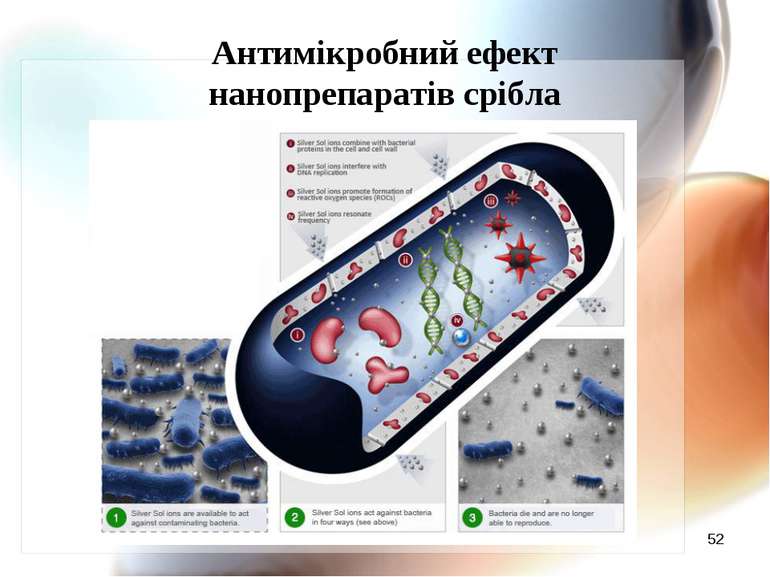
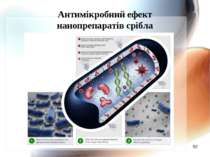
Механізм антимікробної дії наносрібла Наночастинки срібла адсорбуються на поверхні мікробної мембрани; Наночастинки руйнують молекули ліпополісахариду, акумулюються всередині мембрани, формуючи “осередки” і підвищуючи проникність мембрани. Наночастинки срібла проникають всередину клітини, викликаючи наступні ефекти (Li Q., Mahendra D., Lyon D. et al., 2008) : 2.1. Срібло зв’язується з цитохромами і блокує дихальний ланцюг; 2.2. Срібло здатне зв’язуватись з компонентами електрон-транспортного ланцюга, а також ДНК, пригнічуючи його реплікацію(за Dunn K., Edwards_Jones V., 2004); 2.3. Срібло зв’язується з білками, особливо багатими на сульфгідрильні групи,пригнічуючи активність ферментів.
Препарати на основі наносріблас S-Gel Гідрофільний гель, виготовлений на основі Карбополу із вмістом діючої речовини 0,02 та 0,1 мг/г; Розмірність наночастинок срібла 7 – 20 нм; наночастинки сферичної форми Препарат виявив антимікробний ефект проти багатьох штамів мікробів, включаючи мультирезистентні до антибіотиків. Препарат виявився ефективним і по відношенню до грибку Aspergillus niger;
* S-Gel Для препарату характерний пост-агентний (подібний до пост-антибактеріального) ефект, коли інгібіція росту культури зберігалась навіть після видалення препарату. Наночастинки S-Gel виявили синергізм у комбінації з антибіотиком цефтазидином, адитивний ефект із стрептоміцином, канаміцином, ампіклоксом, поіміксином Б, а також антагонізм із хлорамфеніколом. (Jain J, Arora S, Rajwade J. M. et al, 2009)
* Дослідження фармакологічних властивостей нанозаліза та наноміді (аспіранти Дорошенко А.М., Сімонов П.В.) Досліджуються протимікробні властивості субстанцій та колоїдних розчинів даних металів. Вивчається взаємодія металів з компонентами біомембрани. Визначається гостра токсичність та генотоксичність нанометалів. Досліджуються молекулярні механізми дії нанометалів.
Нанокомпозити (аспірант Савченко Д.С.) Розроблена технологія отримання композитів наносрібла з кремнеземом. Досліджуються протимікробні та адсорбуючі властивості даного композиту. Вивчається гостра і хронічна токсичність, а також генотоксичність. *
Нановісмут (аспірант Карнаухова А.В.) Розроблена технологія отримання колоїдного розчину нановісмуту. Вивчаються протимікробні властивості, гостра токсичність, а також генотоксичність. *
* Дослідження Національного медичного університету спільно з Інститутом біоколоїної хімії ім. Ф.Д. Овчаренко Національної академії наук України Розроблена технологія отримання колоїдних розчинів наночастинок срібла, міді, заліза, вісмуту. Визначається їх гостра токсичність на мишах. Досліджено вплив на ДНК. Проводиться вивчення впливу срібла, міді, заліза, вісмуту на паренхіматозні органи, ембріони тварин (спільно з Дніпропетровською медичною академією). Розробляється технологія отримання лікарських форм (мазь, гель, супозиторії, ампули для парентерального введення) наночастинок срібла, міді, заліза, вісмуту.
* ЗАПРОШЕННЯ Співробітники лабораторії електронно-променевої нанотехнології неорганічних матеріалів для медицини Інституту електрозварювання ім. Є.О. Патона та Національного медичного університету ім. О.О. Богомольця, також Інститут біоколоїдної хімії ім. Ф.Д. Овчаренка запрошують присутніх до співробітництва в галузі нанотехнологій, наномедицини, нанофармакології, нанотоксикології, нанобезпеки наноматеріалів! Спільно перемагати антибіотикорезистентність!
Людина та мікроорганізми Rubintein E., Ronfld A. – канадські вчені (2000) “Резістентність створюється людиною, і тільки людина може вирішити цю проблему”.
Схожі презентації
Категорії