Презентація на тему:
Відомості про розчини. Колігативні властивості розчинів
Завантажити презентацію
Відомості про розчини. Колігативні властивості розчинів
Завантажити презентаціюПрезентація по слайдам:
Розчини. Колігативні властивості розчинів План 1. Загальна характеристика розчинів. 2. Розчинність твердих речовин і газів у рідинах. 3. Колігативні властивості розчинів. Закон Рауля. Закони Коновалова. 4. Ебуліоскопія та кріоскопія. 5. Явище осмосу.
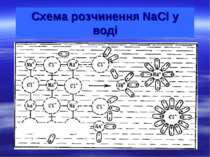
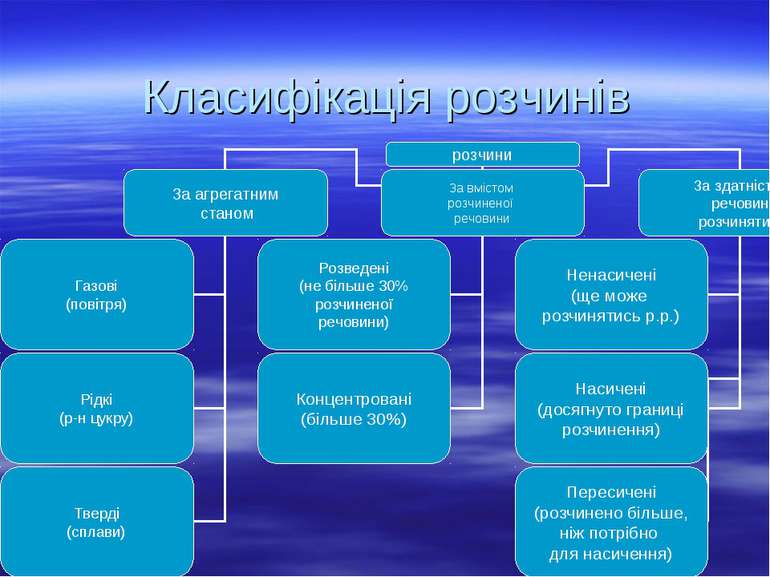
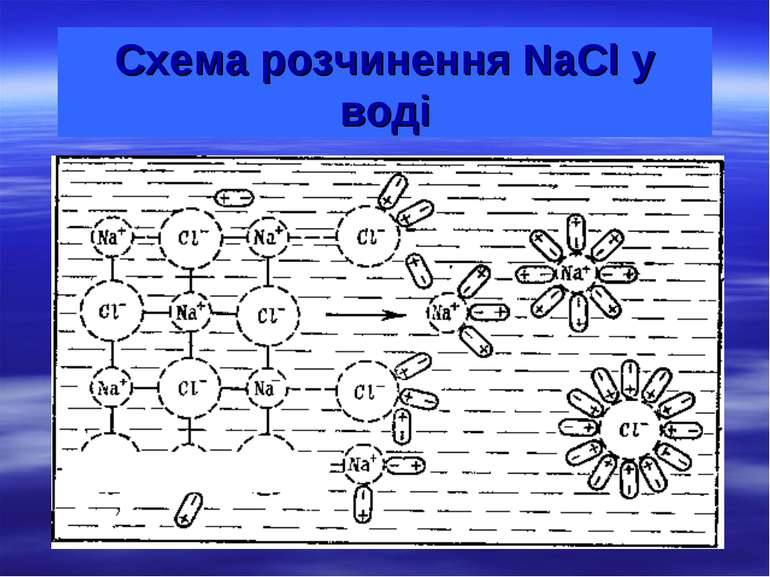
Колігативні властивості розчинів Розчином називають дво- або багатокомпонентну гомогенну систему, склад якої може безперервно змінюватись у межах, визначених розчинністю. Хімічні компоненти, при змішуванні яких утворюється розчин та які можна виділити з нього у чистому вигляді, називають компонентами розчину. Речовина, що при розчиненні не змінює свого агрегатного стану, або входить до складу розчину у більшій кількості, називають розчинником. У природі найпоширенішим розчинником є вода. Другим компонентом розчину є розчинена речовина (одна або кілька). Частинками р.р. є окремі молекули або йони розміром не менше 1 нм, які рівномірно розподілені між молекулами розчинника.
Закон Генрі-Дальтона: Розчинність газу при сталій температурі в рідині прямо пропорційна його парціальному тиску. Або в математичній формі (Т = соnst): m = k p, де m – маса газу, який розчиняється в 1 л розчинника; р - тиск газу (або парціальний тиск, коли маємо суміші газів); k – коефіцієнт, який характеризує природу компонентів розчину. Важливий наслідок із закону Генрі: об’єм газу, який розчиняється при постійній температурі в даному об’ємі рідини, не залежить від його парціального тиску.
Способи вираження концентрації розчинів. Масова частка – це відношення маси розчиненої речовини до маси розчину. Виражається в частці від 1 або в %: W = m(розч.реч-ни) / m(р-ну) 100% Об’ємна частка - це відношення об’єму розчиненої речовини до об’єму розчину. Виражається в частці від 1 або в %: WV = Vреч / Vзаг 100% У фармації застосовують іноді масово-об’ємну частку – це відношення маси розчиненої речовини до об’єму розчину. W = mреч / Vрозч 100%
Молярність (молярна концентрація) – це число молів розчиненої речовини в 1 л розчину. Виражається в моль/л: (М)СМ = (реч, моль) / Vроз – ну (моль/л) нормальність (нормальна концентрація) - це число еквівалентів розчиненої речовини в 1л розчину. Нормальність позначають CN або N і вимірюють в молях на літр: CN, моль/л. CN = (еквів) / Vр-ну, моль/л Доповнення до закону еквівалентів: якщо дві речовини 1 і 2 взаємодіють між собою, то для їх розчинів з концентраціями CN1 і CN2 характерна рівність: CN1 V1 = CN2 V2 Де CN1 і CN2 – нормальності розчинів речовин 1 і 2, які взаємодіють між собою; V1 і V2 – об’єми розчинів речовин 1 і 2. Знаючи, нормальність і об’єм однієї речовини, а також об’єм іншої речовини, що вступає в реакцію з першою, можна розрахувати її нормальність: CN2 = CN1 V1/ V2
Мольна частка – це відношення числа молів розчиненої речовини до загального числа молів розчину (розчинника і розчиненої речовини). Якщо розчин складається з двох компонентів – розчиненої речовини і розчинника, то мольна частка розчиненої речовини: Х1 = 1/ 1+ 2 Де 1, 2 – кількості молів розчиненої речовини у розчині і розчинника відповідно. Моляльна концентрація (моляльність) – це кількість молів розчиненої речовини в 1 кг розчинника. Позначається : m (або Сm) = (реч)/Vр-ну, (г/мл, г/л) Титр розчину – це число грамів розчиненої речовини в 1 мл розчину Т = m(реч)/Vр-ну, (г/мл, г/л).
Способи вираження складу розчинів ВАГОВІ Масова частка ω, [%] Мольна частка χ, [%] Моляльність Сm, [моль/кг] ОБ’ЄМНІ Молярність См, [моль/л] Нормальність СN, [моль-екв./л] Титр Т, [г/мл]
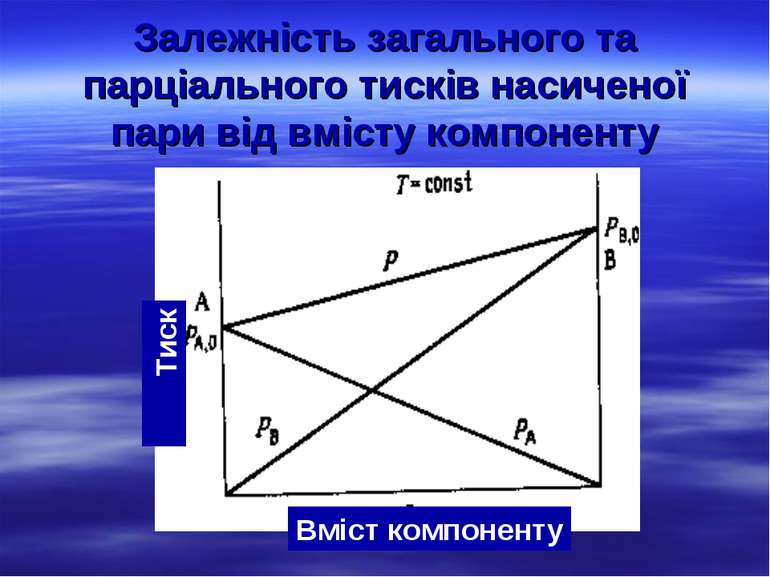
Зниження тиску насиченої пари розчинника над розчином Тиск насиченої пари – це тиск тієї частини пари, яка перебуває у рівновазі з рідиною за даної температури. Молекули розчинника А, відриваючись з поверхні, створюють певний тиск або пружність пари над рідиною, який визначається природою розчинника і температурою. Якщо розчинити яку-небудь нелетку тверду речовину В, то в одержаному розчині частина молекул розчинника зв'язується у сольвати з речовиною В і тому кількість молекул розчинника зменшується. Отже, тиск насиченої пари розчинника над розчином менший, ніж над розчинником.
Залежність загального та парціального тисків насиченої пари від вмісту компоненту Вміст компоненту Тиск
Відносне зниження тиску насиченої пари розчинника над розчином дорівнює мольній частці розчиненої речовини. (тонометричний закон Рауля). Математично закон Рауля можна записати так: Р0 – Р/Р0 = р.р./ р-ка + р.р. р.р. – число молів розчиненої речовини; р-ка – число молів розчинника; Якщо розчини дуже розбавлені, то р.р. р-ка і тоді рівняння можна спростити, ввівши Р = Р0 – Р: Р = Р0 р.р. / р-ка .
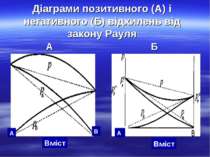
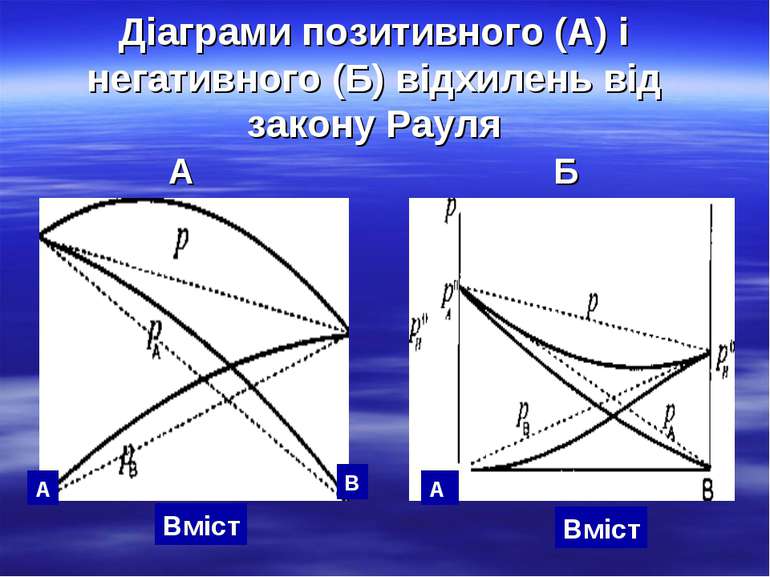
Діаграми позитивного (А) і негативного (Б) відхилень від закону Рауля А Б А В А Вміст Вміст
Різниця між температурами кипіння розчину і чистого розчинника називається підвищенням температури кипіння розчину ( t кип). Різниця між температурами замерзання чистого розчинника і розчину називається зниженням температури замерзання розчину ( t зам). Нехай tкип і tзам – температури кипіння і замерзання розчину; tкип і tзам температури кипіння і замерзання чистого розчинника; тоді tкип = t кип - tкип; tзам = t зам - tзам.
Вивчаючи замерзання і кипіння розчинів, Рауль встановив, що для розбавлених розчинів неелектролітів підвищення температури кипіння і зниження температури замерзання пропорційні концентрації розчину (другий закон Рауля): tкип = Е Cm, tзам = K Cm. Де m – молярна концентрація розчину; Е – ебуліоскопічна стала; К – кріоскопічна стала.
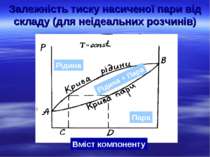
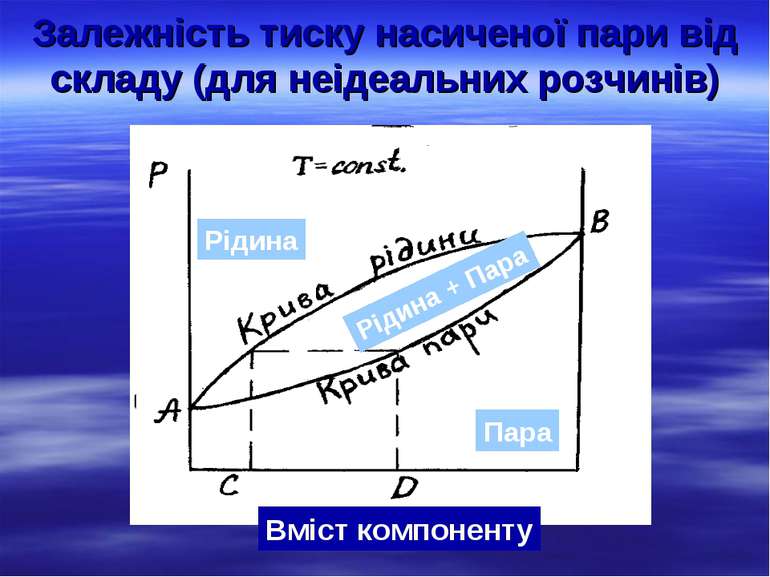
Залежність тиску насиченої пари від складу (для неідеальних розчинів) Рідина Пара Рідина + Пара Вміст компоненту
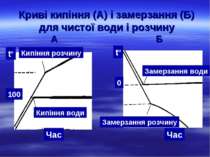
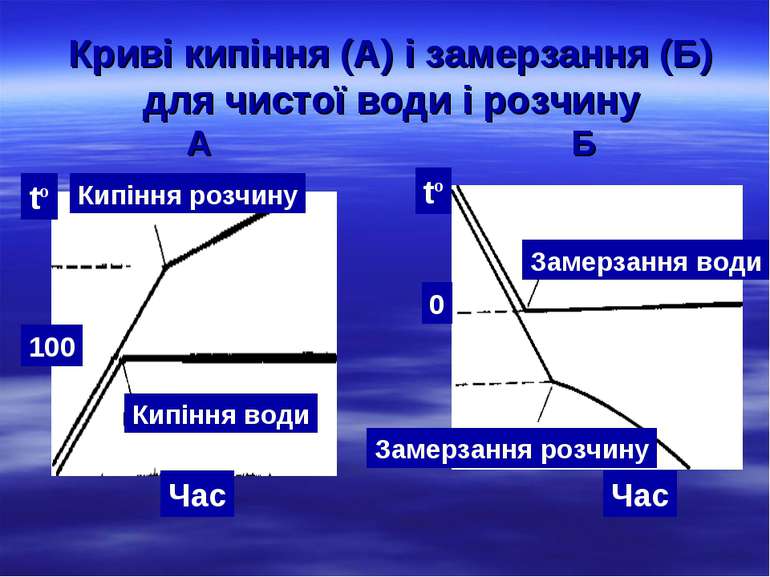
Криві кипіння (А) і замерзання (Б) для чистої води і розчину А Б Кипіння води tº Кипіння розчину Час tº Замерзання води Замерзання розчину Час 0 100
Δtкип=t`кип-tкип Δtзам=t`зам-tзам де t`кип і t`зам - температура кипіння і замерзання розчину, tкип і tзам - температури кипіння та замерзання чистого розчинника Δtкип=ECm Δtзам=KCm де E і K - ебуліоскопічна та кріоскопічна стала, Cm – моляльна концентрація M=Еmp.p/ Δtкипmp-ка M=Kmp.p/ Δtзамmp-ка
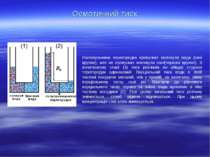
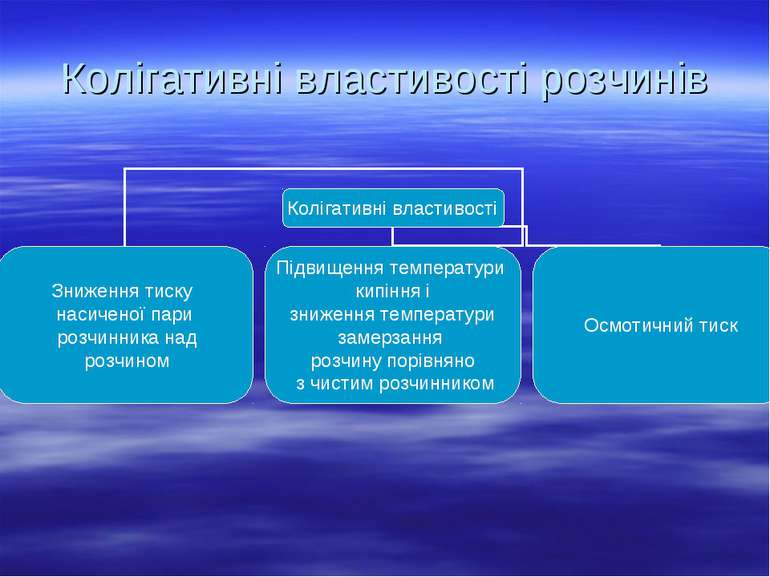
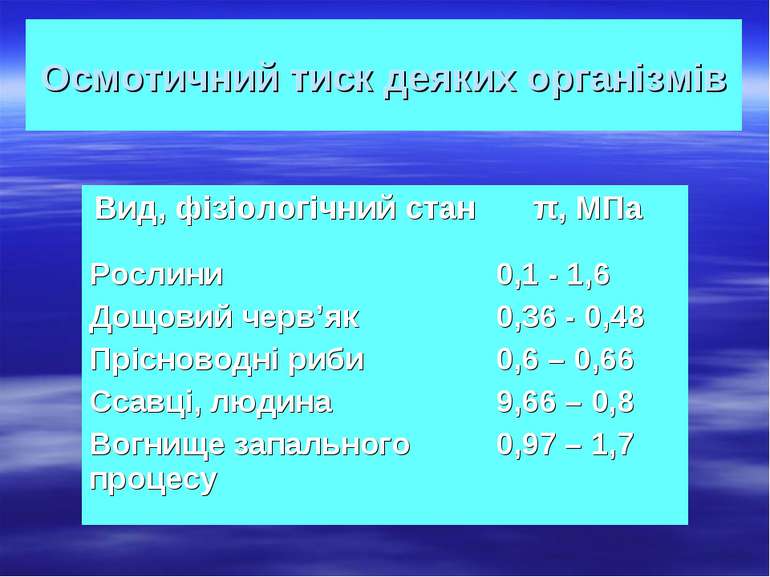
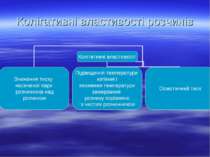
Властивості розчинів, які залежать лише від їхньої концентрації і не залежать від природи розчиненої речовини, називаються колігативними. Процес односторонньої дифузії молекул через напівпроникну перегородку називається осмосом. Осмотичний тиск – це тиск, який чисельно дорівнює додатковому тиску, який необхідний для припинення осмосу. Як показав Я. Г. Вант – Гофф (1885.), осмотичний тиск розчину чисельно лорівнює тиску, який чинила б розчинена речовина, якби вона при тій самій температурі перебувала в газоподібному стані і займала об’єм, що дорівнює об’єму розчину. Це і є закон осмотичного тиску.
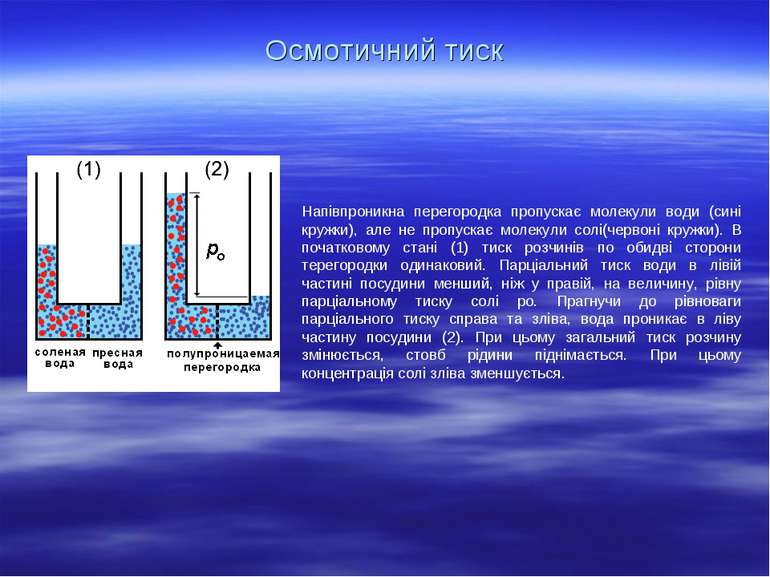
Осмотичний тиск Напівпроникна перегородка пропускає молекули води (сині кружки), але не пропускає молекули солі(червоні кружки). В початковому стані (1) тиск розчинів по обидві сторони терегородки одинаковий. Парціальний тиск води в лівій частині посудини менший, ніж у правій, на величину, рівну парціальному тиску солі po. Прагнучи до рівноваги парціального тиску справа та зліва, вода проникає в ліву частину посудини (2). При цьому загальний тиск розчину змінюється, стовб рідини піднімається. При цьому концентрація солі зліва зменшується.
Схожі презентації
Категорії







![Способи вираження складу розчинів ВАГОВІ Масова частка ω, [%] Мольна частка χ... Способи вираження складу розчинів ВАГОВІ Масова частка ω, [%] Мольна частка χ...](https://svitppt.com.ua/images/35/34762/770/img7.jpg)















![Способи вираження складу розчинів ВАГОВІ Масова частка ω, [%] Мольна частка χ... Способи вираження складу розчинів ВАГОВІ Масова частка ω, [%] Мольна частка χ...](https://svitppt.com.ua/images/35/34762/210/img7.jpg)