Презентація на тему:
Вчення про розчини. Колігативні властивості розчинів
Завантажити презентацію
Вчення про розчини. Колігативні властивості розчинів
Завантажити презентаціюПрезентація по слайдам:
План 1. Розчини.Кількісний склад розчинів 2. Фізична, хімічна та фізико-хімічна теорій розчинів. 3. Розчинність газів в рідинах. Закон Генрі. Газова емболія. 4. Розчинність твердих речовин і рідин в рідинах. 5. Осмос. Закон Вант-Гоффа. Гемоліз і плазмоліз. 5. Тиск пари розчину. Закон Рауля. 6. Кипіння і замерзання розчинів.
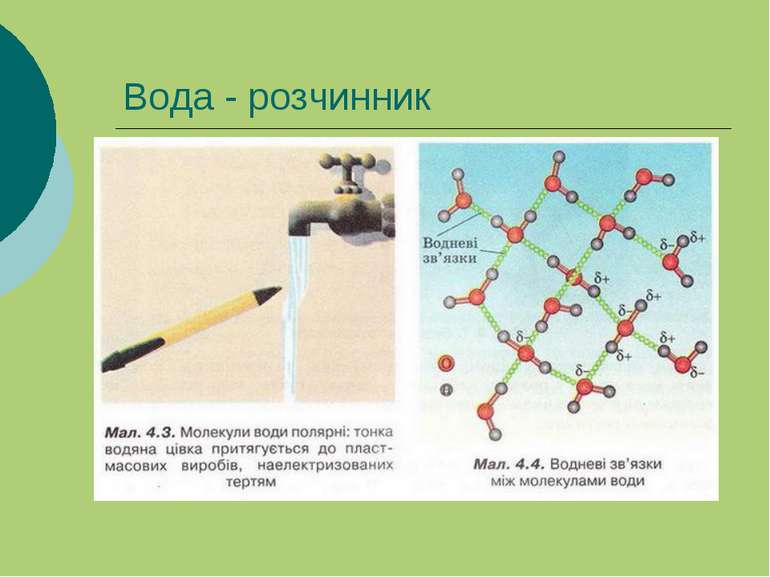
Вода - розчинник В організмі дорослої людини масою 70 кг міститься 45-50 л води, з яких 3.5 л – плазма крові (5 л крові) 10.5 л –лімфа і позаклітинна вода тканин
Розчини –гомогенні системи змінного складу, що складаються з двох або більше компонентів та продуктів їх взаємодії.
Классифікація розчинів За агрегатним станом: рідкі(морська вода) газоподібні тверді (сплави металів). За концентрацією: Ненасичені Насичені Пересичені
пересичені розчини пересичені розчини зустрічаються порівняно рідко, і їх утворюють лише деякі речовини, наприклад декагідрат сульфату натрію — Na2SO4•10H2O, пентагідраттіосульфату натрію — Na2S2O3 • 5H2O тощо. Пересичені розчини дуже нестійкі і досить легко розкладаються з виділенням надлишку розчиненої речовини і утворенням насиченого розчину.
концентрований і розбавлений розчин Не слід плутати поняття насичений і ненасичений розчини з поняттями концентрований і розбавлений. Назви концентрований і розбавлений показують лише, багато чи мало розчиненої речовини міститься в даній кількості розчинника, і нічого не вказують на ступінь його насичення. Концентрований розчин може бути і насиченим і ненасиченим. Наприклад, якщо в 100 г води при 100°С розчинити 200 г нітрату калію KNO3, то такий розчин буде досить концентрованим, але ненасиченим, бо для одержання насиченого розчину при цих умовах потрібно розчинити не 200, а 245 г цієї солі
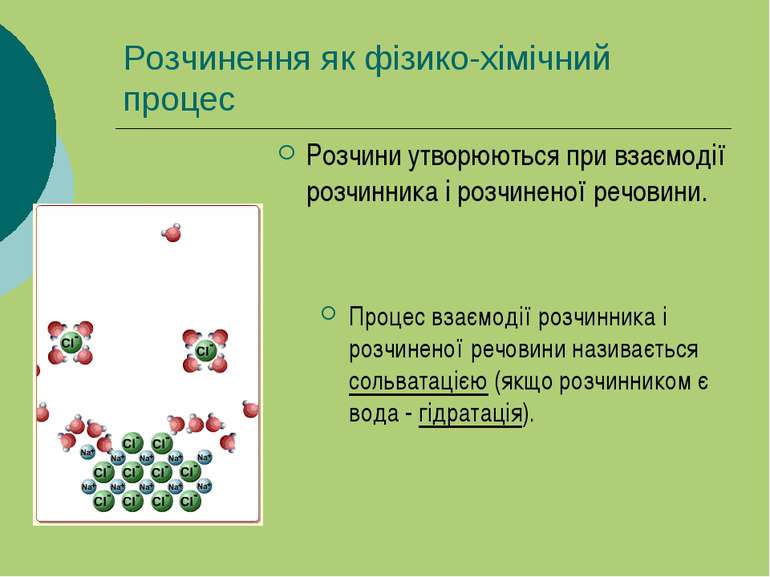
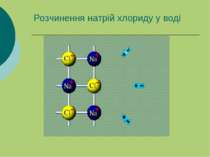
Розчинення як фізико-хімічний процес Розчини утворюються при взаємодії розчинника і розчиненої речовини. Процес взаємодії розчинника і розчиненої речовини називається сольватацією (якщо розчинником є вода - гідратація).
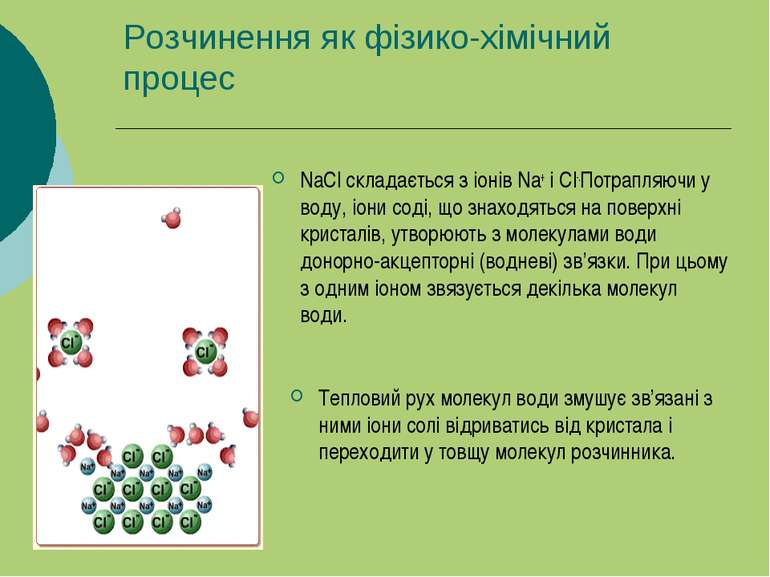
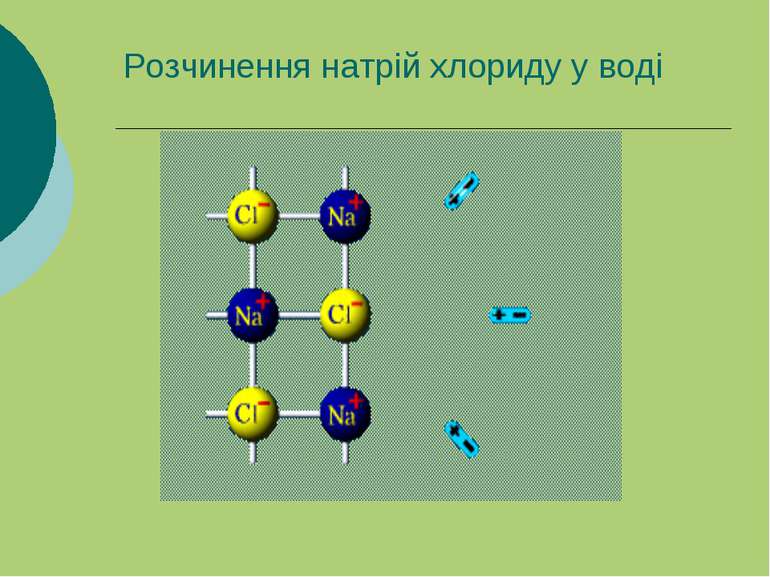
Розчинення як фізико-хімічний процес NaCl складається з іонів Na+ і Cl-.Потрапляючи у воду, іони соді, що знаходяться на поверхні кристалів, утворюють з молекулами води донорно-акцепторні (водневі) зв’язки. При цьому з одним іоном звязується декілька молекул води. Тепловий рух молекул води змушує зв’язані з ними іони солі відриватись від кристала і переходити у товщу молекул розчинника.
Теорії розчинів Хімічна (гідратна) теорія Д.І. Менделєєва: між розчиненою речовиною і розчинником відбувається хімічна взаємодія Фізична теорія розчинів: процес розчиненя є фізичним процесом рівномірного розподілу частинок розчиненої речовини в середовищі індиферентного розчинника
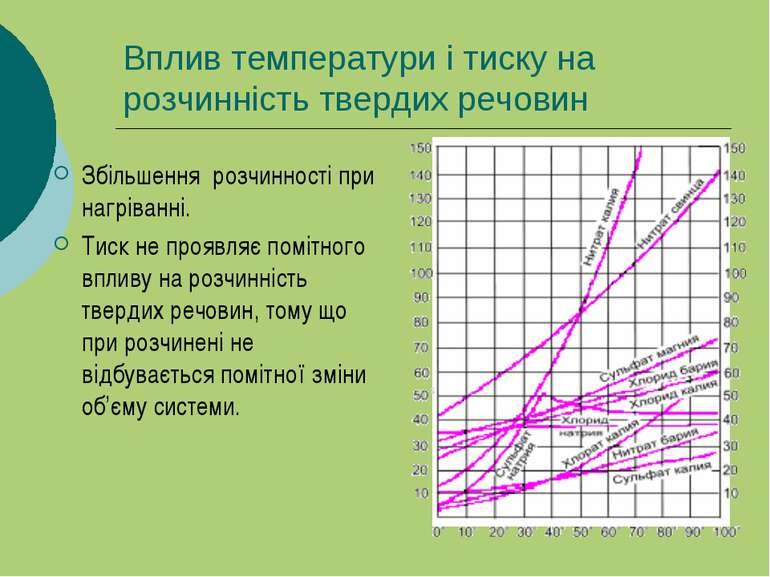
Вплив температури і тиску на розчинність твердих речовин Збільшення розчинності при нагріванні. Тиск не проявляє помітного впливу на розчинність твердих речовин, тому що при розчинені не відбувається помітної зміни об’єму системи.
Розчинність газів З підвищенням тиску розчинність газів у рідинах збільшується Розчинність газів із збільшенням температури зменшується. Це зв’язано перш за все з тим, що молекули газів при тепловому русі здатні покидати розчин значно легше.
Розчинність газів Закон Генрі при постійній температурі розчинність даного газу у рідині прямо пропорційна парціальному тиску газу N = k P ПОРУШЕННЯ ВМІСТУ РОЗЧИНЕНИХ ГАЗІВ У КРОВІ –ГІРСЬКА ХВОРОБА, КЕСОННА ХВОРОБА
Взаємна розчинність рідин Залежноі від природи рідини можуть змішуватися при будь-яких співвідношеннях (необмежена взаємна розчинність), бути практично нерозчинними одна в одній чи володіти обмеженою розчинністю. Підвищення температури призведе до збільшення взаємної розчинності і при деякій температурі, називається критичною температурою розчинення, взаємна обмежена розчинність рідин стає необмеженою.
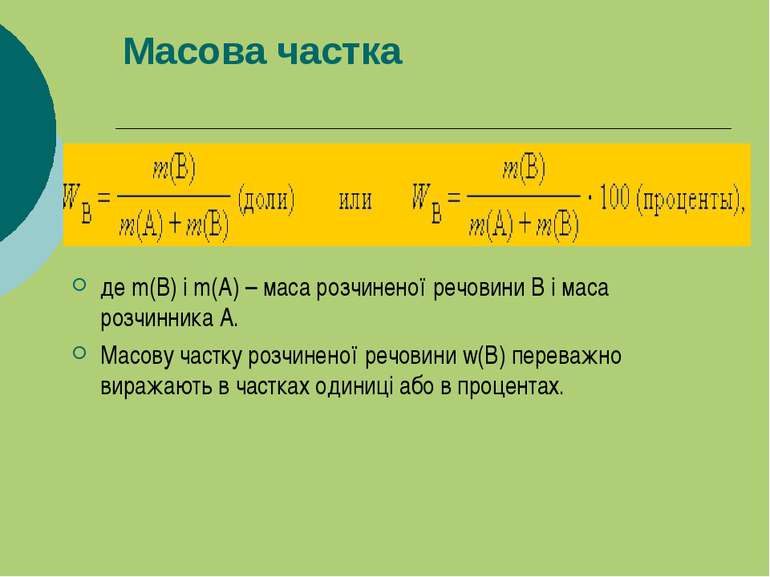
Масова частка де m(B) і m(A) – маса розчиненої речовини B і маса розчинника A. Масову частку розчиненої речовини w(B) переважно виражають в частках одиниці або в процентах.
Молярна концентрація C де μ(B) – молярна маса B, V – об’єм розчину. Молярна концентрація показує, скільки моль розчиненої речовини міститься в 1 літрі розчину. Розчин концентрації 0,1 М містить 0,1 моль речовини на літр розчину і називається ДЕЦИМОЛЯРНИМ. Розчини концентрації 0,01 М (або 0,01 моль на літр) інколи називають САНТИМОЛЯРНИМИ.
Колігативні властивості розчинів Властивості розчинів, які не залежать від природи компонентів, а залежать від кількості частинок в системі називаются колігативними. Дифузія Осмотичний тиск Зниження тиску пари розчинника над розчином Підвищення температури кипіння розчинів Зниження температури замерзання розчинів
Дифузія Дифузія – це самочинний процес вирівнювання концентрації розчиненої речовини в результаті хаотичного теплового руху частинок
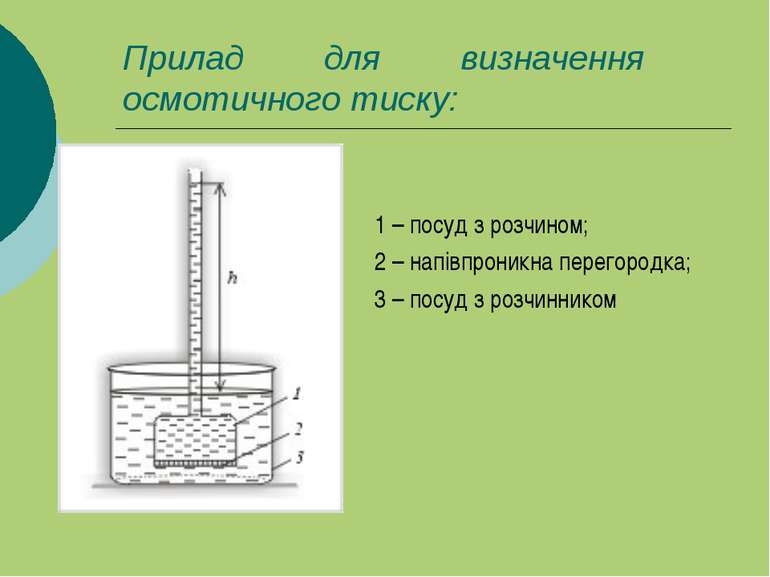
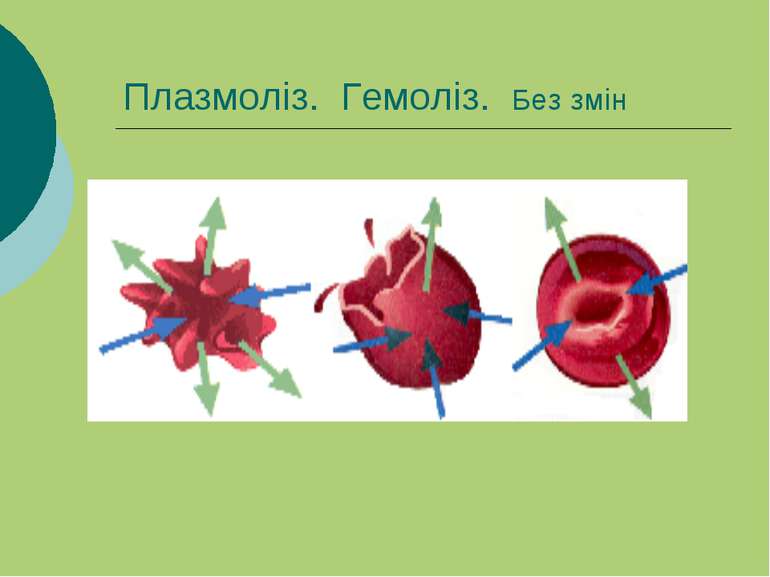
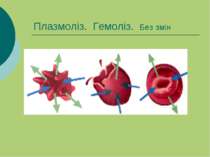
Осмотичний тиск Одностороння дифузія молекул розчинника через напівпроникну мембрану в більш концентрований розчин називається осмосом. Сила, яка змушує розчинник переходити через напівпроникну мембрану в розчин, називається осмотичним тиском.
Прилад для визначення осмотичного тиску: 1 – посуд з розчином; 2 – напівпроникна перегородка; 3 – посуд з розчинником
Закон Вант-Гоффа де С – молярна концентрація розчину R – універсальна газова стала T – абсолютна температура Осмотичний тиск ідеального розчину рівний тому тиску, який чинила б розчинена речовина, як би вона, перебувала в газоподібному стаяні при тій же температурі, займала б той же обєм, який займає розчин.
Ізотонічні, гіпертонічні та гіпотонічні розчини Розчини з однаковим осмотичним тиском називаються ізотонічними. 0,9% NaCl – ізотонічний (фізіологічний) розчин Розчини з більшим осмотичним тиском від стандартного розчину називаються гіпертонічними Розчини з меншим осмотичним тиском від стандартного розчину називаються гіпотонічними
Закони Рауля Ро – тиск пари розчинника над чистим розчинником Р – тиск пари розчинника над розчином NB – мольна частка розчиненої речовини Відносне зниження тиску пари розчинника над розчином дорівнює мольній частці розчиненої речовини і не залежить від природи розчиненої речовини.
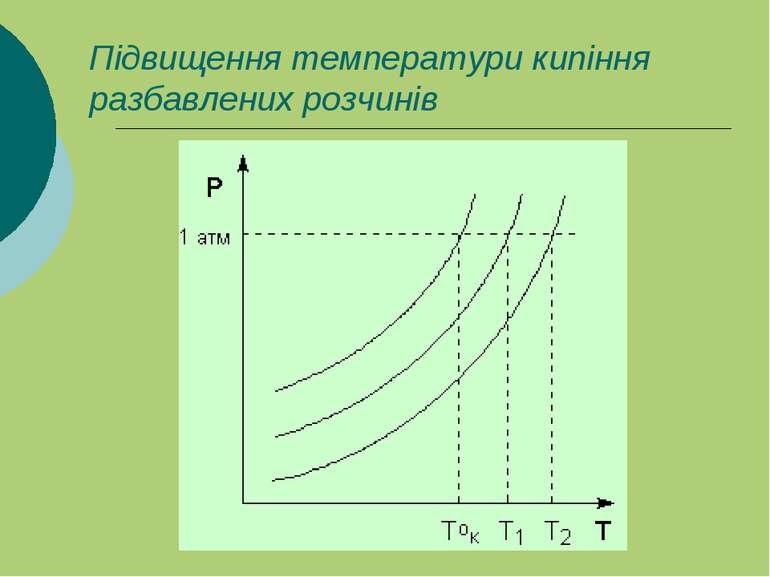
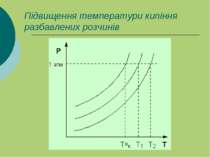
Температура кипіння розбавлених розчинів . Коэфіцієнт пропорційності E - ебуліоскопічна стала розчинника, не залежна від природи розчиненої речовини. В – моляльна концентрація
Температура кристалізації разбавлених розчинів величина зниження температури замерзання Δtзам, рівна різниці між температурою і температурою початку кристалізації розчину tзам: Коефіцієнт пропорційності K – кріоскопічна стала розчинника – визначається природою розчинника.
ТИТРИМЕТРИЧНИЙ АНАЛІЗ Закон еквівалентів Основні поняття титриметрії. Суть методу нейтралізації (протолітометрії). Суть методу осадження. Метод Мора. Методи редоксметрії. Окисно-відновні реакції. Комплексонометрія.
ТИТРИМЕТРИЧНИЙ АНАЛІЗ Закон еквівалентів Речовини вступають в хімічні реакції і утворюються в кількостях, що пропорційні їх еквівалентам m1 : E1 = m2 : E2 , m -маса речовини, Е –еквівалентна маса Основна формула для розрахунків в об”ємному аналізі N1 V1 = N2 V2
Суть титриметрії Титриметричний, або об”ємний аналіз – метод кількісного хімічного аналізу, який базується на вимірюванні точного об’єму розчину з точно відомою концентрацією (титранту), витраченого на взаємодію з визначуваною речовиною. Метод титриметрії полягає в тому, що до розчину визначуваної речовини А поступово додають розчин реактиву Т точно відомої концентрації (титрант): А + Т = продукт
Основні поняття титриметрії Об”ємний аналіз грунтується на титруванні – додаванні невеликих порцій одного з розчинів до відомого об”єму іншого розчину. Розчини реагенту Т точно відомої концентрації, який застосовується для титрування, називають стандартним або робочим розчином або ще титрантом (титрованим розчином)
Класифікація титриметричних методів за типом реакції кислотно-основне титрування (метод нейтралізації, протолітометрія) осаджувальне титрування (седиметрія) комплексиметрія (комплексонометрія) окисно-відновне титрування (редоксиметрія)
Схожі презентації
Категорії