Презентація на тему:
Розв’язування розрахункових задач з хімії
Завантажити презентацію
Розв’язування розрахункових задач з хімії
Завантажити презентаціюПрезентація по слайдам:
1. Поняття електролітичної дисоціації. Електроліти та неелектроліти Електролітична дисоціація – це процес розпаду речовини на йони під час розчинення у воді чи іншому полярному розчиннику або під час розплавлення. За здатністю проводити електричний струм у розчиненому стані чи розплаві речовини поділяють на електроліти та неелектроліти.
2. Дисоціація кислот Розчинні у воді кислоти дисоціюють на катіони Гідрогену та аніони кислотного залишку: HCl H+ + Cl– HNO3 H+ + NO3– Багатоосновні кислоти дисоціюють ступінчасто з послідовним відщепленням кожного з йонів Гідрогену.
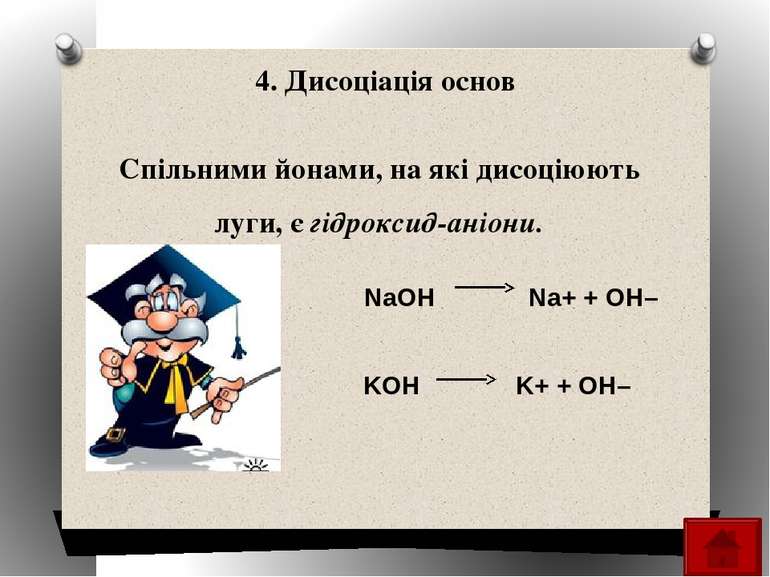
4. Дисоціація основ KOH NaOH K+ + OH– Na+ + OH– Спільними йонами, на які дисоціюють луги, є гідроксид-аніони.
4. Дисоціація солей Розчини середніх солей не утворюють під час дисоціації однакових для них іонів: MgCl2 Fe2(SO4)3 Солі – це електроліти, що дисоціюють з утворенням катіонів металічного елемента та аніонів кислотного залишку. Mg2+ + 2Cl– 2Fe3+ + 3SO42–
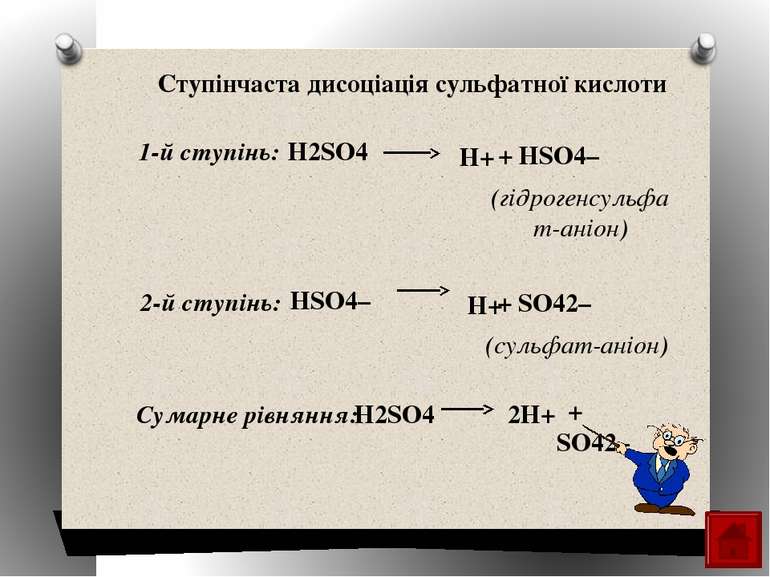
H2SO4 2H+ + SO42– Ступінчаста дисоціація сульфатної кислоти H2SO4 H+ + HSO4– HSO4– H+ + SO42– (гідрогенсульфат-аніон) (сульфат-аніон) Сумарне рівняння: 1-й ступінь: 2-й ступінь:
Зверніть увагу! У рівняннях електролітичної дисоціації пишуть коефіцієнти для того, щоб зрівняти суму позитивних зарядів катіонів і суму негативних зарядів аніонів, адже розчин загалом електронейтральний.
- це електроліти, при дисоціації яких у водних розчинах як катіонів утворюються тільки йони водню Кислоти НBr → + Br - Н2SO3 → 2 + SO3 2- Н+ Н+ Н+
кислий смак зміна забарвлення індикатора Взаємодія з деякими металами з виділенням водню обумовлені наявністю Загальні властивості кислот: Н+
Кислоти – це електроліти, що дисоціюють з утворенням катіонів Гідрогену та аніонів кислотного залишку. Виходячи з точки зору теорії електролітичної дисоціації, можна дати таке визначення кислот:
Виходячи з точки зору теорії електролітичної дисоціації, можна дати таке визначення основ: Основи – це електроліти, що дисоціюють з утворенням катіонів металічного елемента та гідроксид-аніонів.
Основи - це електроліти, при дисоціації яких у водних розчинах як аніонів утворюються тільки гідроксид-йони NaOH → Na + + OН- Ca(OH)2 → Ca2+ + 2 Мe(OH)n → Men+ + n OН- OН- ОН-
мильність на дотик їдка дія зміна забарвлення індикатора обумовлені наявністю Загальні властивості лугів: ОН-
обумовлені властивостями всіх йонів, які утворюються в процесі дисоціації Властивості розчинів солей: Na+ Сl- K+ SO4 2- Al3+
Висновки: загальні властивості розчинів кислот зумовлені наявністю в них катіонів Гідрогену; загальні властивості розчинів основ зумовлені наявністю в них гідроксид-аніонів; розчини солей не мають однакових для них іонів, тому не виявляють загальних властивостей.
Використана література: Ярошенко О.Г. Хімія: підруч. для 9 кл. загальноосвіт. навч. закл. / О.Г. Ярошенко. – К: Освіта, 2009. - 223 с. 2. Сухан В.В. Хімія: Посібник для вступників до вищих навчальних закладів / В.В. Сухан, Т.В. Табенська, А.Й. Капустян, В.Ф. Горлач. – 3-є вид. – К: Либідь,1996. - 448 с.
Схожі презентації
Категорії