Презентація на тему:
Розв’язування розрахункових задач з хімії
Завантажити презентацію
Розв’язування розрахункових задач з хімії
Завантажити презентаціюПрезентація по слайдам:
Дидактичні принципи навчання Забезпечення самостійності й активності учнів; Досягнення єдності знань і умінь; Встановлення зв’язків навчання з життям.
Розрахункові задачі можна використовувати на всіх етапах навчального процесу: Під час вивчення навчального матеріалу; Під час його засвоєння; Під час перевірки та контролю учнів.
У процесі розв’язування задач з хімії забезпечується: Вироблення оптимальної методики підходу до теоретичного обґрунтування умови задачі; Єдність навчання, розвитку, виховування учнів; Закріплення правил, термінів, законів, рівнянь; Осмислення зв’язку фізичних величин, політехнічну підготовку знань учнів; Конкретизація, систематизація, зміцнення і перевірка знань учнів; Поєднання теорії з практикою, вміння втілювати свої знання у життя; Розвиток логічного мислення, активізація розумової діяльності, виховання ініціативності, самостійності, уважності; ілюстрація хімічних закономірностей, принципів хімічної технології, хімізації народного господарства, продуктивності апаратів, якості та виходу готового продукту.
У процесі розв’язування задач в учнів виховується: Працелюбність; Цілеспрямованість; Відповідальність; Наполегливість у досягненні визначеної мети.
За навчальними цілями і змістом задачі є неоднорідні : одні стимулюють більш глибоке засвоєння теоретичних питань, зокрема закони, тому їх слід віднести до групи теоретичних задач; другі допомагають учням глибше осмислити практичні питання, а тому можуть бути віднесені до групи практичних задач; треті об’єднують в собі і теоретичні і практичні запитання і забезпечують одночасне вдосконалення і теоретичних і практичних знань учнів.
Обчислення за хімічними формулами Обчислення відносної молекулярної маси речовини; Обчислення масової частки елемента у сполуці; Обчислення числа атомів (молекул) у певній кількості речовини; Обчислення маси певної кількості речовини та кількості речовини певної її маси; Обчислення об’єму газу у певній кількості речовини; Обчислення маси певного об’єму газу за нормальних умов і об’єму газу, який займає за н.у. певна маса газу; Обчислення відносної густини і молекулярної маси газів;
Обчислення з використанням понять про розчини: Обчислення масової частки розчиненої речовини в розчині; Обчислення маси розчиненої речовини в розчинах; Обчислення розчинності речовини. Обчислення пов’язані з молярною концентрацією;
Обчислення за рівняннями хімічних реакцій: Обчислення за хімічними рівняннями кількості речовини, яка бере участь у реакції, за відомою кількістю іншої речовини, що реагує; Обчислення за хімічним рівняннями мас речовин або об’ємів газів (н.у.) за відомою кількістю речовини, що вступає в реакцію або добута в результаті реакції; Обчислення об’ємних відношень газів під час хімічних реакцій; Обчислення за термохімічними рівняннями; Обчислення маси або об’єму продукту реакції за відомою масою чи об’ємом вихідної речовини, що містить домішки; Визначення масової або об’ємної частки виходу продукту реакції за відношенням до теоретично можливого; Обчислення за хімічними рівняннями , якщо одну з речовин, що реагує, взято у надлишку.
Виведення формул речовин: Виведення молекулярної формули газуватої органічної речовини на основі її густини, відносної густини за воднем чи за повітрям та масовими частками елементів; Виведення молекулярної формули газуватої органічної речовини на основі маси чи об’єму продуктів згоряння.
У 7 класі Тема: Основні поняття хімії І. Обчислення за хімічними формулами. Обчислення відносної молекулярної маси речовини; 2. Обчислення масової частки елемента у сполуці.
У 8 класі Тема: Кількість речовини. Розрахунки за хімічними формулами. І. Обчислення за хімічними формулами. 1. Обчислення числа атомів (молекул) у певній кількості речовини; 2. Обчислення маси певної кількості речовини та кількості речовини певної її маси; 3. Обчислення маси певного об’єму газу за нормальних умов і об’єму газу, який займає на н.у. певна маса газу; 4. Обчислення об’єму у певній кількості речовини; 5. Обчислення відносної густини і молекулярної маси газів; Тема: Класи неорганічних сполук І. Обчислення за хімічними формулами. ІІ. Обчислення за рівняннями хімічних реакцій. 1. Обчислення за хімічними реакціями кількості речовини, яка бере участь у реакції, зо відомою кількістю іншої речовини, що реагує; 2. Обчислення за хімічними реакціями мас речовин або об’ємів газів (н.у.), за відомою кількістю речовини, що вступає в реакцію або добута в результаті реакції; 3. Обчислення об’ємних відношень газів під час хімічних реакцій;
Тема: Періодичний закон і будова атома. І. Обчислення за хімічними формулами. 1. Обчислення масової частки елементу у сполуці; 2. Визначення елемента за відомою молекулярною масою його сполуки; ІІ. Обчислення за рівняннями хімічних реакцій. Визначення елемента на основі розрахунків за хімічними рівняннями.
У 9 класі Тема: Розчини Обчислення з використанням понять про розчини: Обчислення масової частки розчиненої речовини в розчині; Обчислення маси розчиненої речовини в розчинах; Обчислення розчинності речовини; Обчислення пов’язані з молярною концентрацією. Тема: Хімічні реакції Обчислення за рівняннями хімічних реакцій Обчислення за термохімічними рівняннями. Тема: Органічні сполуки Виведення формул речовини Виведення молекулярної формули газуватої органічної речовини на основі її: густини, відносної густини за воднем чи за повітрям та масовими частками елементів; Виведення молекулярної формули газуватої органічної речовини на основі маси чи об’єму продуктів згоряння.
У 10 класі Тема: Загальні відомості про неметали та їх сполуки. Обчислення за рівняннями хімічних реакцій Обчислення за хімічними реакціями, якщо одну з речовин, що реагує, взяти у надлишку; Визначення масової або об’ємної частки виходу продукту реакції за відношенням до теоретично можливого. Тема: Метали Обчислення маси або об’єму продукту реакції за відомою масою чи об’ємом вихідної речовини, що містить домішки
Для виконання задач як ефективного методу навчання, які розвивають мисленневі здібності учнів, необхідні певні умови: Наявність запасу опорних знань; Осмислення кожним учнем мети задачі; Ясність прийомів розв’язування задач.
Алгоритм розв’язування розрахункових задач Прочитайте умову задачі, повторіть її своїми словами, з’ясуйте, що дано та що треба знайти. Коротко запишіть умову задачі, користуючись знаннями хімічної мови. Запишіть необхідні формули та рівняння реакцій. Зверніть увагу на правильність вибору фізичних величин та їх одиниць. Продумайте рішення задачі. Використовуйте найбільш простий і короткий спосіб розв’язання. Якщо можна, розв’яжіть задачу кількома способами; Напишіть розв’язання задачі. Запишіть відповідь; Зробіть припущення, перевіряючи правильність отриманої відповіді. При розв’язуванні різними способами відповідь завжди повинна бути однаковою.
Типи задач з теми «Розчини»: Задачі на обчислення масової частки розчиненої речовини; Задачі на обчислення масової частки газоподібної речовини в розчині; Задачі на обчислення масової частки речовини в розчині, що утворюється в результаті змішування; Задачі з використанням поняття «густина розчину»; Задачі з використанням поняття «кристалогідрати»; Задачі на обчислення масової частки речовини в розчині, що утворюється внаслідок хімічної взаємодії розчиненої речовини з розчинником; Задачі на обчислення масової частки речовини в розчині, що утворюється внаслідок хімічної взаємодії розчиненої речовини з розчинником, якщо в результаті виділяється газоподібний продукт; Задачі з використанням олеуму; Задачі на обчислення об’ємної частки розчиненої речовини; Задачі на обчислення коефіцієнту розчинності; Задачі на обчислення молярної концентрації;
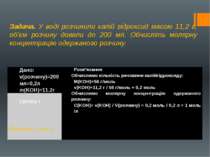
Задача. У воді розчинили калій гідроксид масою 11,2 г, об’єм розчину довели до 200 мл. Обчисліть молярну концентрацію одержаного розчину. Відповідь: 1 моль /л Дано: v(розчину)=200мл=0,2л m(KOH)=11.2г Розв’язання: Обчислимо кількість речовиникалійгідроксиду: M(KOH)=56г/моль v(KOH)=11,2 г / 56 г/моль = 0,2 моль Обчислимо молярну концентрацію одержаного розчину: C(KOH)=v(KOH) /V(розчину)= 0,2 моль / 0,2 л = 1 моль /л С(KOH)-?
Способи розв’язування задач на обчислення масової частки речовини в розчині: Проведення послідовних обчислень; Алгебраїчний спосіб; Задача. Обчисліть масу сульфатної кислоти з масовою часткою кислоти 50%, яку необхідно додати до розчину сульфатної кислоти масою 400 г з масовою часткою кислоти 10%, щоб одержати розчин з масовою часткою розчиненої речовини 30%. Розв’язання: Підставляємо числові дані в цю формулу та розв’язуємо рівняння: -0,2m=-80; m=400 Відповідь: 400 г. Обчислення за формулою правила змішування; Розв’язування за діагональною схемою «правила змішування» (правило хреста) Графічний. mг 50%-й розчинH2SO4 400 г 10%-й розчинH2SO4 ↓ 30%
Якщо заняття фізичною культурою і спортом зміцнює організм дитини фізично загартовує його, то розв’язування задач є засобом зміцнення вищої нервової діяльності , поліпшення пам’яті, збільшення її обсягу.
Схожі презентації
Категорії