Презентація на тему:
Роль фосфора
Завантажити презентацію
Роль фосфора
Завантажити презентаціюПрезентація по слайдам:
Історія відкриття фосфору За іронією долі фосфор відкривався кілька разів. Причому всякий раз отримували його з . сечі. Є згадки про те, що арабський алхімік Альхильд Бехиль (XII століття) відкрив фосфор при перегонці сечі в суміші з глиною, вапном і вугіллям. Проте датою відкриття фосфору вважається 1669 рік. Гамбургський алхімік-аматор Хеннінг Бранд, купець, що розорився, мріяв за допомогою алхімії поправити свої справи, піддавав обробці найрізноманітніші продукти. Передбачаючи, що фізіологічні продукти можуть містити «первинну матерію», основою філософського каменя, що вважалася, Бранд зацікавився людською мочей. Він зібрав близько тонни сечі з солдатських казарм і випаровував її до утворення сиропообразной рідини. Цю рідину він знов дистилював і отримав важке червоне «уринное масло», яке переганялося з утворенням твердого залишку. Нагріваючи останній, без доступу повітря, він відмітив утворення білого диму, що осідав на стінках судини і яскраво світив в темноті. Бранд назвав отриману ним речовину фосфором, що в перекладі з грецького означає «светоносец». Декілька років «рецепт приготування» фосфору зберігався в строгому секреті і був відомий лише декільком алхімікам. Втретє фосфор відкрив Р.Бойль в 1680 році.
Природні з'єднання і здобуття фосфору По поширеності в земній корі фосфор випереджає азот, сірку і хлор. На відміну від азоту фосфор, із-за великої хімічної активності зустрічається в природі лише у вигляді з'єднань. Найбільш важливі мінерали фосфору - апатит Са5Х(РО4) 3 (Х - фтор, рідше хлор і гидрооксильная група) і фосфорил основою якого є Са3(РО4) 2. Найбільше родовище апатитов знаходиться на Кольському півострові, в районі Хибінських гір. Поклади фосфоритов знаходяться в районі гір Каратау, в Московській, Калузькій, Брянській областях і в інших місцях. Фосфор входить до складу деяких білкових речовин, що містяться в генеративних органах рослин, в нервових і кісткових тканинах організмів тварин і людини. Особливо багаті фосфором мозкові клітки. В наші дні фосфор виробляють в електричних печах, відновлюючи апатит вугіллям у присутності кремнезему: Ca3(PO4) 2+3SiO2+5C®3CaSiO3+5CO+P2. Пари фосфору при цій температурі майже повністю складаються з молекул Р2, які при охолоджуванні конденсуються в молекули Р4.
Хімічні властивості Електронна конфігурація атома фосфору 1S22S22P63S23P33d0 Зовнішній електронний шар містить 5 електронів. Наявністю трьох неспарених електронів на зовнішньому енергетичному рівні пояснює те, що в нормальному, незбудженому стані валентність фосфору дорівнює 3. Але на третьому енергетичному рівні є вакантні вічка d-орбиталей, тому при переході в збуджений стан 3S-электроны відокремлюватимуться, переходитимуть на d підрівень, що наводить до утворення 5-ти неспарених елементів. Таким чином, валентність фосфору у збудженому стані дорівнює 5. У з'єднаннях фосфор зазвичай проявляє міру окислення +5, рідше +3, -3. 1. Реакції з киснем: 4P0 + 5O2 2P2+5O5 (при недоліку кисню: 4P0 + 3O2 2P2+3O3) 2. З галогенами і сіркою: 2P0 + 3Cl2 2P+3Cl3 P0 + 5S P2+5S5 (галогеніди фосфору легко розкладаються водою, наприклад: PCl3 + 3H2O H3PO3 + 3HCl PCl5 + 4H2O H3PO4 + 5HCl) 3. З азотною кислотою: 3P0 + 5HN+5O3 + 2H2O 3H3P+5O4 + 5N+2O 4. З металами утворює фосфіди, в яких фосфор проявляє міру окислення, - 3: 2P0 + 3Mg Mg3P2-3 (фосфід магнію легко розкладається водою Mg3P2 + 6H2O 3Mg(OH)2 + 2PH3 (фосфін)) 3Li + P Li3P-3 5. З лугом: 4P + 3NaOH + 3H2O PH3 + 3NaH2PO2 У реакціях (1,2,3) - фосфор виступає як відновник, в реакції (4) - як окислювач; реакція (5) - приклад реакції диспропорціонування. Фосфор може бути як відновником, так і окислювачем
Техніка безпеки. У виробництві фосфору і його з'єднань потрібне дотримання особливих запобіжних засобів, оскільки білий фосфор - сильна отрута. Тривала робота в атмосфері білого фосфору може привести до захворювання кісткових тканин, випадання зубів, омертвіння ділянок щелеп. Запалавши, білий фосфор викликає хворобливі опіки, що довго не гояться. Зберігати білий фосфор слід під водою, в герметичних судинах. Фосфор, що горить, гасять двоокисом вуглецю, розчином CuSO4 або піском. Обоженную шкіру слід промити розчином KmnO4 або CuSO4. Протиотрутою при отруєнні фосфором є 2%-ый розчин CuПри тривалому зберіганні, а також при нагріванні білий фосфор переходить в червону модифікацію (вперше його отримали лише 1847 року). Назва червоний фосфор відноситься відразу до декількох модифікацій, що розрізняються по щільності і забарвленню: вона вагається від помаранчевої до темно-червоної і навіть фіолетової. Всі різновиди червоного фосфору нерастворимы в органічних розчинниках, і в порівнянні з білим фосфором вони менш реакционноспособны і мають полімерну будову: це тетраедри Р4, зв'язані один з одним в безконечні ланцюги (рис.2). Червоний фосфор знаходить вживання в металургії, виробництві напівпровідникових матеріалів і ламп розжарювання, використовується в сірниковому виробництві. Найбільш стабільною модифікацією фосфору є чорний фосфор. Його отримують аллотропным перетворенням білого фосфору при t=2200C і підвищеному тиску. На вигляд він нагадує графіт. Кристалічна структура чорного фосфору шарувата, така, що складається з гофрованих шарів (рис.3). Чорний фосфор - це найменш активна модифікація фосфору. При нагріванні без доступу повітря він, як і червоний, переходить в пару, з якої конденсується в білий фосфор. SO4.
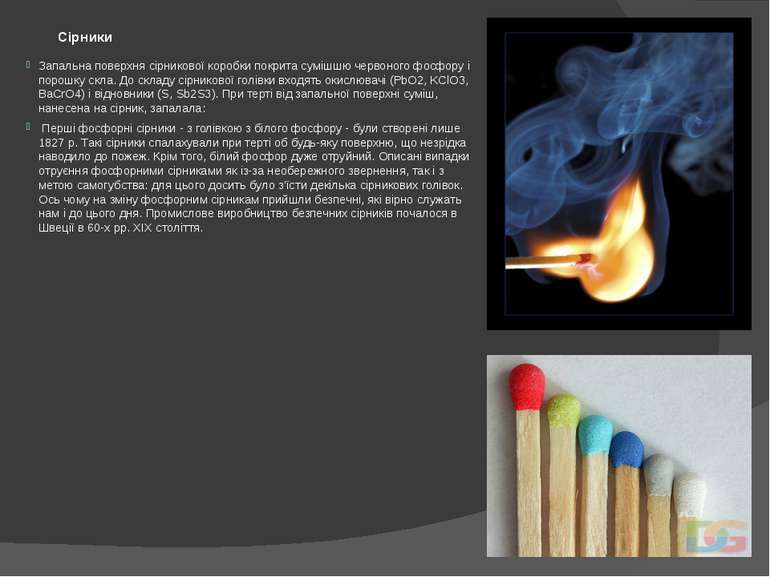
Сірники Запальна поверхня сірникової коробки покрита сумішшю червоного фосфору і порошку скла. До складу сірникової голівки входять окислювачі (PbO2, KСlO3, BaCrO4) і відновники (S, Sb2S3). При терті від запальної поверхні суміш, нанесена на сірник, запалала: Перші фосфорні сірники - з голівкою з білого фосфору - були створені лише 1827 р. Такі сірники спалахували при терті об будь-яку поверхню, що незрідка наводило до пожеж. Крім того, білий фосфор дуже отруйний. Описані випадки отруєння фосфорними сірниками як із-за необережного звернення, так і з метою самогубства: для цього досить було з'їсти декілька сірникових голівок. Ось чому на зміну фосфорним сірникам прийшли безпечні, які вірно служать нам і до цього дня. Промислове виробництво безпечних сірників почалося в Швеції в 60-х рр. XIX століття.
Значення фосфору Фосфорна кислота має велике значення як один з найважливіших компонентів живлення рослин. Фосфор використовується рослинами для побудови своїх самих життєво важливих частин - насіння і плодів. Похідні ортофосфорной кислоти дуже потрібні не лише рослинам, але і тваринам. Кістки, зуби, панцирі, кігті, голки, Шип у більшості живих організмів полягає, в основному, з ортофосфату кальцію. Крім того, ортофосфорная кислота, утворюючи різні з'єднання з органічними речовинами, активно беруть участь в процесах обміну речовин живого організму з довкіллям. В результаті цього похідні фосфору містяться в кістках, мозку, крові, в м'язових і сполучних тканинах організмів людини і тварин. Особливо багато ортофосфорной кислоти у складі нервових (мозкових) клітин, що дозволило А.Е. Ферсману, відомому геохімікові, назвати фосфор "елементом думки". Вельми негативно (захворювання тварин рахітом, недокрів'я, і ін.) позначається на стані організму пониження вмісту в раціоні живлення з'єднань фосфору або введення їх в незасвоєній формі. Ферсман Олександр Євгенійович [27.10 (8.11) .1883, Петербург, - 20.5.1945, Сочі], радянський геохімік і мінералог, академік АН СРСР (1919). Учень Ст І. Вернадського.
Вживання фосфору Застосовують ортофосфорную кислоту в даний час досить широко. Основним її споживачем служить виробництво фосфорних і комбінованих добрив. Для цих цілей щорік добувається у всьому світі фосфоросодержащей руді близько 100 млн. т. Фосфорні добрива не лише сприяють підвищенню врожайності різних сільськогосподарських культур, але і додають рослинам зимостійкість і стійкість до інших несприятливих кліматичних умов, створюють умови для швидшого дозрівання урожаю в районах з коротким вегетативним періодом. Вони також сприятливо діють на грунт, сприяючи її структуризації, розвитку грунтових бактерій, зміні розчинності інших речовин, що містяться в грунті, і придушенню деяких шкідливих органічних речовин, що утворюються. Немало ортофосфорной кислоти споживає харчова промисловість. Річ у тому, що на смак розбавлена ортофосфорная кислота дуже приємна і невеликі її добавки в мармелад, лимонад і сиропи помітно покращують їх смакові якості. Цією ж властивістю володіють і деякі солі фосфорної кислоти. Гидрофосфати кальцію, наприклад, з давніх пір входять в хлібопекарські порошки, покращуючи смак булочок і хліба. Цікаві і інші вживання ортофосфорной кислоти в промисловості. Наприклад, було відмічено, що просочення деревини самою кислотою і її солями роблять дерево негорючим. На цій основі зараз виробляють вогнезахисні фарби, негорючі фосфодревесные плити, негорючий фосфатний пінопласт і інші будівельні матеріали. Різні солі фосфорної кислоти широко застосовують в багатьох галузях промисловості, в будівництві, різних областях техніки, в комунальному господарстві і побуті, для захисту від радіації, для зм'якшування води, боротьби з котельним накипом і виготовлення різних миючих засобів.
Схожі презентації
Категорії